ALKBH5对紫外线诱导的晶状体上皮细胞氧化损伤模型中DNA损伤修复的影响△
李鹏飞 鲍思洁 王从玉 王思文 孙诚浩 康丽华 管怀进
已有研究发现,在紫外线照射引起的DNA损伤位点处发生N6-甲基腺苷(m6A)修饰的聚集,通过多种机制促进DNA修复,对抗紫外线照射引起的损伤[8-9]。m6A是真核生物mRNA中最丰富的内部表观遗传学修饰,参与mRNA代谢全部环节,通过调节RNA稳定性和翻译调节基因表达,在各种生物过程中发挥重要作用[10-12]。m6A修饰过程受到m6A甲基转移酶复合物(MTC)、去甲基化酶和m6A识别酶的动态调控[13-14]。其中,ALKBH5作为去甲基化酶,在氧化应激诱导的DNA损伤修复中发挥重要作用[15-16]。虽然已有研究发现,ALKBH5在皮质型ARC的LEC中的表达显著上调,但是其在ARC发生发展过程中的作用机制尚不清楚[17]。
本研究中,我们通过对LEC进行紫外线B(UVB)照射构建氧化损伤模型,探究m6A去甲基化酶ALKBH5在氧化损伤模型中对损伤性DNA修复的影响,为ARC的防治提供理论依据。
1 材料与方法
1.1 一般资料选取2021年4月至10月在南通大学附属医院眼科住院并行超声乳化白内障吸除术的ARC患者8例8眼为ARC组,选择同期住院并接受透明晶状体摘除术的黄斑前膜患者8例8眼为对照组,收集所有患者的临床资料及晶状体前囊膜,所有患者的晶状体混浊程度均根据LOCSⅢ分级系统进行分级。ARC组患者排除标准:(1)并发性、外伤性、代谢性、药物及中毒性白内障等其他类型的白内障;(2)双眼中有一眼为无晶状体眼;(3)合并高血压、糖尿病或自身免疫病。对照组患者排除标准:(1)合并高度近视、葡萄膜炎或青光眼等眼部疾病;(2)合并高血压、糖尿病或其他全身性疾病。ARC组患者男5例、女3例,年龄为50~80(66.1±3.4)岁,对照组患者男4例、女4例,年龄为50~80(65.6±2.7)岁,两组患者间性别和年龄差异均无统计学意义(P=0.94、0.18)。本研究通过南通大学附属医院伦理委员会审批(伦理审查批号:2021-L091),所有患者均签署知情同意书。
1.2 材料人LEC细胞系SRA01/04细胞购自中国科学院上海生命科学研究所。DMEM培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;手持式紫外线检测灯购自中国光豪分析仪器公司;逆转录试剂盒购自美国Thermo Scientific公司,Trizol试剂盒购自美国Invitrogen公司,引物购自上海生工生物工程股份有限公司;靶向ALKBH5设计的siRNAs购自中国锐博生物科技有限公司;CCK-8试剂盒购自日本同仁化学研究所;15A3抗体购自英国Abcam公司;GAPDH抗体、荧光二抗(辣根过氧化物酶标记的山羊抗兔和山羊抗鼠IgG)均购自中国ABclonal公司。
1.3 细胞培养和UVB处理将SRA01/04细胞复苏后,加入完全培养基(含体积分数10%胎牛血清和10 g·L-1青链霉素的DMEM培养基),并置于 37 ℃、含体积分数5% CO2培养箱中培养。待培养皿中的细胞融合度达80%左右时,用Hanks液清洗细胞2次,加入适量的无菌PBS,置于手持式紫外线检测灯(波长为275~400 nm ,峰值为310 nm )下30 cm处照射。UVB照射时间梯度为0 min、10 min、15 min、30 min、45 min。照射后加入完全培养基继续培养24 h,进行后续实验。
1.4 qRT-PCR检测根据Trizol试剂盒的步骤提取ARC组(n=3)和对照组(n=3)患者晶状体前囊膜上皮细胞中的总RNA。按照说明书行qRT-PCR检测,以GAPDH为内参,使用2-△△Ct分析,实验均重复3次。GAPDH上游引物为5’-TGAAGGTCGGAGTCAACGGATTTGGT-3’,下游引物为5’-CATGTGGGCCATGAGGTCC ACCAC-3’。ALKBH5上游引物为5’-CCCGAGGGCTTCGTCAACA-3’,下游引物为5’-CGACACCCGAATAGGCTTGA-3’。同样方法检测经不同方法处理后SRA01/04细胞中ALKBH5 mRNA和11个DNA氧化损伤修复基因(ODRGs)的表达,其中11个ODRGs的引物序列见表1。

表1 11个ODRGs的引物序列
1.5 免疫印迹实验检测取ARC组(n=5)和对照组(n=5)患者的晶状体前囊膜,提取上皮细胞,加入蛋白裂解液冰上裂解,提取蛋白上清,于125 g·L-1的凝胶上进行电泳(电压80 V转120 V)分离蛋白;采用湿转法转膜(电流250 mA,2 h);采用5 g·L-1脱脂奶粉室温下封闭2 h;参照说明书将稀释好的目的一抗(ALKBH5稀释度为11000;GAPDH稀释度为16000)加入PVDF膜中,置于4 ℃冰箱孵育过夜;次日,用TBST漂洗,然后加入辣根过氧化物酶标记的山羊抗兔(二抗)IgG在室温下孵育2 h;最后,TBST洗涤后加入显影剂,置于暗室内曝光显影。以GAPDH为内参。同样方法检测经不同方法处理后SRA01/04细胞中ALKBH5蛋白表达。
1.6 细胞分组及转染检测siALKBH5转染效率时,实验分为转染siALKBH5组(针对ALKBH5 mRNA的三个不同区域设计靶向敲低ALKBH5的siRNA,命名为siALKBH5#1、siALKBH5#2和siALKBH5#3)、转染对照siNC组(转染对照siNC)和Control组(未经任何处理)。检测ALKBH5在细胞氧化损伤模型中的功能时,实验分为Control组(未经任何处理)、UVB组(采用UVB照射)、UVB+siNC组(转染对照siNC,同时采用UVB照射处理)以及UVB+siALKBH5#3组(转染siALKBH5#3,同时采用UVB照射处理)。转染方法:6孔板每孔中加入Lipofectamine 3000和siRNA充分混匀后室温孵育15 min,之后,置于培养箱中继续培养72 h后,进行后续实验。
那什么时间是最佳时间段呢?根据数据分析显示,这一类客户他们通常在晚上7~8点钟是比较闲的,因为他们在忙碌的工作后终于可以在家放松紧张了一天的神经。这时候如果你给他们电话,他们都会和你用心交谈。
1.7 CCK-8法检测细胞活力CCK-8法检测Control组、UVB组、UVB+siNC组以及UVB+siALKBH5#3组细胞活力,具体方法为:将SRA01/04细胞以每孔1×104个的密度接种于96孔板,每组设6个复孔,培养箱培养24 h;分组处理后弃培养基,向每孔加入100 μL完全培养基和10 μL CCK-8溶液;继续置于培养箱中孵育1~2 h(操作过程中注意避光);使用酶标仪测定450 nm处的吸光度。
1.8 免疫荧光染色检测DNA氧化损伤UVB+siNC组和UVB+siALKBH5#3组SRA01/04细胞分组处理后,PBS清洗,40 g·L-1多聚甲醛室温固定30 min,加入30 g·L-1牛血清白蛋白和体积分数0.5% Triton X-100溶液,室温封闭2 h;依据15A3抗体(15A3抗体可检测到发生损伤DNA的标志物8-oxoG,而8-oxoG为ALKBH5修复损伤DNA的结合底物[8])说明书,使用10 g·L-1牛血清白蛋白配一抗反应液,4 ℃孵育过夜;次日取出洗涤后,加入荧光二抗,室温下孵育2 h(操作过程中注意避光);之后,Hoechst(110 000)孵育8 min染细胞核(操作过程中注意避光),荧光显微镜下避光观察、拍照。
1.9 统计学方法实验数据均采用Graphpad prism 8统计学软件分析。多组间比较均采用单因素方差分析,两样本间比较采用t检验。所有实验均重复3次。检验水准:α=0.05。
2 结果
2.1 ARC患者晶状体前囊膜上皮细胞中ALKBH5 mRNA和蛋白表达qRT-PCR和免疫印迹实验检测结果显示,与对照组相比,ARC组患者晶状体前囊膜上皮细胞中ALKBH5 mRNA和蛋白表达均显著升高,差异均有统计学意义(均为P<0.05)(图1)。
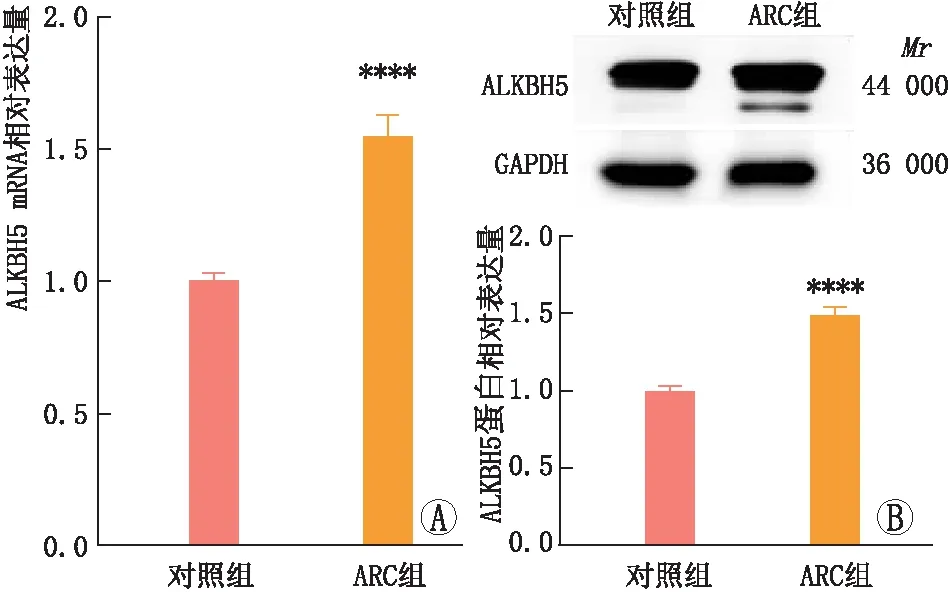
图1 ARC组和对照组患者晶状体前囊膜上皮细胞中ALKBH5的mRNA和蛋白表达 A:qRT-PCR检测ALKBH5 mRNA表达;B:免疫印迹实验检测ALKBH5蛋白表达。与对照组相比,****P<0.000 1。
2.2 UVB照射对LEC中ALKBH5表达的影响
2.2.1 UVB照射对LEC中ALKBH5 mRNA表达的影响qRT-PCR检测结果显示,与UVB照射0 min时相比,SRA01/04细胞中ALKBH5 mRNA表达量在UVB照射10 min时上升,在UVB照射30 min和45 min时下降,差异均有统计学意义(均为P<0.05);UVB照射15 min与0 min时相比差异无统计学意义(P>0.05)。其中,UVB照射10 min时ALKBH5 mRNA的表达量最高(图2)。
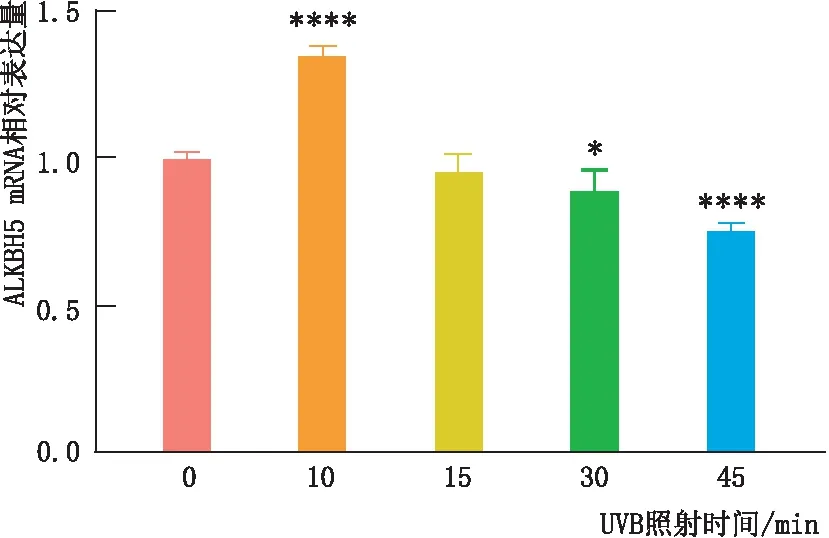
图2 qRT-PCR检测UVB照射不同时间SRA01/04细胞中ALKBH5 mRNA表达 与照射0 min时相比,*P<0.05,****P<0.000 1。
2.2.2 UVB照射对LEC中ALKBH5蛋白表达的影响免疫印迹实验检测结果显示,在UVB以时间梯度照射SRA01/04细胞后,SRA01/04细胞中ALKBH5的蛋白表达量呈上升后下降趋势。与UVB照射0 min时相比,SRA01/04细胞中ALKBH5蛋白表达量在UVB照射10 min时和15 min时上升,在UVB照射45 min时下降,差异均有统计学意义(均为P<0.05);UVB照射30 min与照射0 min时相比差异无统计学意义(P>0.05)。其中,UVB照射10 min时ALKBH5的蛋白表达量升高最明显(图3)。因此,本实验细胞UVB照射氧化损伤模型的构建均采用辐射强度为0.09 mW·cm-2的手持式紫外线检测灯照射SRA01/04细胞10 min。

图3 免疫印迹实验检测UVB照射不同时间SRA01/04细胞中ALKBH5蛋白表达 与照射0 min时相比,**P<0.01,***P<0.001。
2.3 ALKBH5敲降模型验证qRT-PCR和免疫印迹实验检测结果显示,与转染对照siNC组相比,转染siALKBH5#3后,SRA01/04细胞中ALKBH5 mRNA和蛋白表达均显著降低(均为P<0.001)(图4)。因此,选取siALKBH5#3用于后续功能实验的ALKBH5敲降模型。
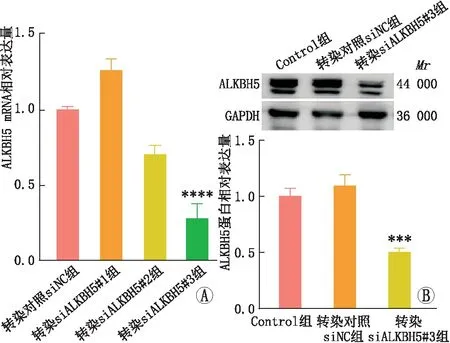
图4 不同siALKBH5转染SRA01/04细胞后mRNA和蛋白水平的敲降效率验证 与转染对照siNC组相比,***P<0.001,****P<0.000 1。
2.4 敲降ALKBH5对LEC状态的影响
2.4.1 ALKBH5转染后细胞活力检测CCK-8法检测结果显示,与Control组相比,UVB和UVB+siNC组SRA01/04细胞活力均明显降低(均为P<0.000 1);与UVB+ siNC组和UVB组相比,UVB+siALKBH5#3组SRA01/04细胞活力明显降低,差异均有统计学意义(均为P<0.000 1)(图5)。
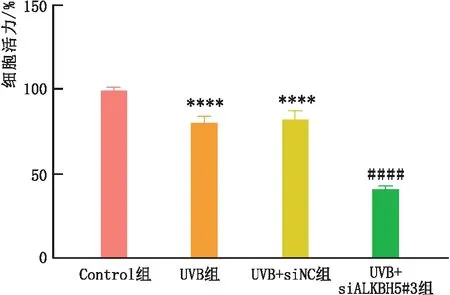
图5 siALKBH5#3转染对SRA01/04细胞活力的影响 与Control组相比,****P<0.000 1;与UVB组和UVB+siNC组相比,####P<0.000 1。
2.4.2 ALKBH5敲降后细胞内DNA氧化损伤程度变化免疫荧光染色检测结果显示,与UVB+siNC组(荧光强度为33.8±2.7)相比,UVB+siALKBH5#3组SRA01/04细胞的15A3染色(荧光强度为68.0±6.0)明显增多,差异具有统计学意义(t=10.39,P<0.000 1)(图6)。
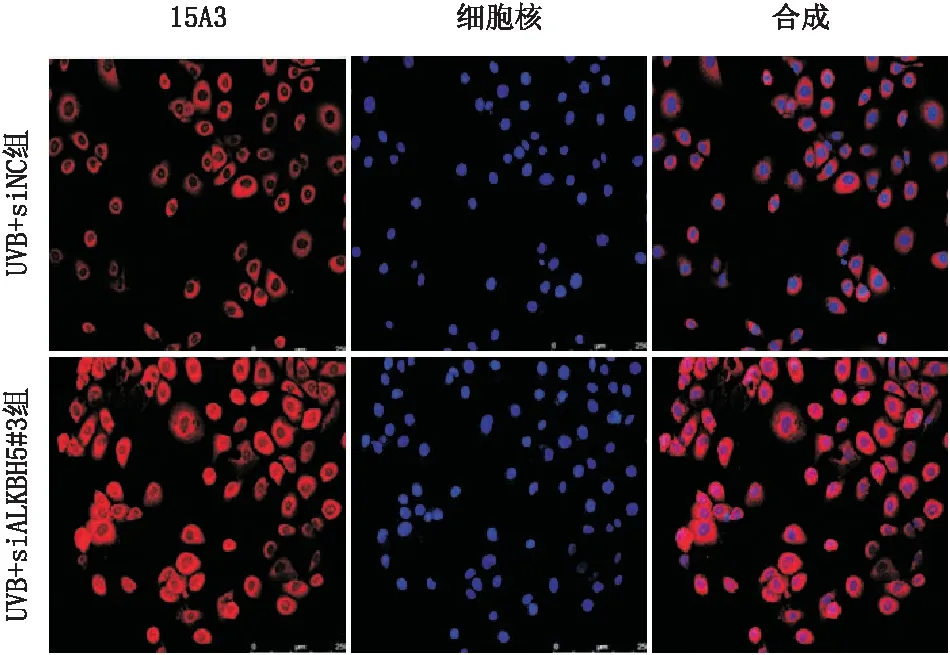
图6 siALKBH5#3转染对SRA01/04细胞DNA氧化损伤的影响
2.5 敲降ALKBH5对LEC的ODRGs表达的影响qRT-PCR检测结果显示,与转染对照siNC组相比,转染siALKBH5#3组SRA01/04细胞中TREX1、FANCD2、LIG1、MSH2、MSH3、RPA2、SMUG1、XRCC6mRNA的表达均显著升高,DCLRE1AmRNA的表达显著降低,差异均有统计学意义(均为P<0.01);两组间MGMT和MRE11AmRNA的表达差异均无统计学意义(均为P>0.05)(图7)。
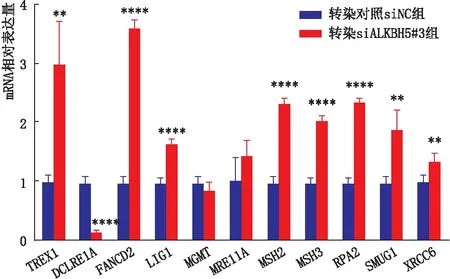
图7 敲降ALKBH5对SRA01/04细胞ODRGs表达的影响 与转染对照siNC组相比,**P<0.01,****P<0.000 1。
3 讨论
LEC是晶状体中唯一的细胞类型,在维持晶状体内部环境的稳态以及维持晶状体光学透明度方面发挥着关键作用[18]。LEC内的氧化应激诱发因素主要包括外源性紫外线和内源性的线粒体呼吸链所产生的活性氧(ROS),当ROS的产生超过细胞自身生理性的抗氧化防御机制时,就会导致氧化和抗氧化失衡,从而引发氧化应激反应[19-21]。有研究显示,氧化应激可导致每个生物体每天大约104个DNA发生氧化损伤[22]。氧化损伤往往是不可避免的,因此,在机制方面针对DNA损伤修复调控的研究在ARC的防治中具有重要意义。
m6A是发生在腺苷N6位的甲基化,在真核生物的mRNA中广泛分布,调控多种生物活动过程,包括转录、翻译、干细胞的维持和分化以及肿瘤的恶化等[23-25]。也有研究发现,在氧化应激条件下可以通过多种机制调节m6A修饰水平,促进DNA修复,维持基因稳定性[8,16]。Xiang等[8]研究发现,紫外线诱导的DNA损伤能特异性触发m6A甲基转移酶METTL3在DNA损伤位点的瞬时募集,促进m6A RNA水平全面升高,进而诱导与核苷酸切除修复和跨损伤合成有关的 DNA 聚合酶κ(Pol κ)定位DNA损伤位点,参与损伤DNA的修复。Yu等[16]研究发现,在ROS诱导的氧化应激过程中,ROS通过激活ERK/JNK信号通路促进m6A去甲基化酶ALKBH5 SUMO化,抑制ALKBH5活性,诱导mRNA m6A修饰,从而提高氧化修复基因的稳定性,促进DNA修复过程。所以,m6A可以通过响应氧化应激诱导的DNA损伤来调节DNA修复,在此过程中m6A调节酶起到了重要的调控作用。
m6A调节酶可分为3种类型,共同参与m6A动态可逆的调控过程,即m6A甲基转移酶复合物(MTC),包括METTL3、METTL14、WTAP等,负责催化m6A;m6A去甲基化酶,包括FTO、ALKBH5,负责将m6A删除;m6A识别酶,包括 YT521-B 同源域蛋白家族(YTHDF1/2/3 和 YTHDC1/2)等[21],负责特异性识别m6A修饰位点并与之结合[26]。本研究通过对比ARC组和对照组患者晶状体前囊膜样本,发现m6A去甲基化酶ALKBH5在ARC患者晶状体前囊膜上皮细胞中的表达显著升高,这也一定程度上提示了m6A水平的改变。另外,在采用UVB以时间梯度照射LEC构建的氧化损伤模型中,发现在UVB照射10 min后,ALKBH5 mRNA和蛋白表达水平均显著上升。因此,我们推测m6A去甲基化酶ALKBH5在LEC的氧化损伤过程中可能发挥着重要调控作用。
为了进一步探究ALKBH5在UVB诱导的LEC氧化损伤模型中的功能,本研究首先利用靶向ALKBH5的小干扰RNA(siRNA)对其进行了敲降实验,然后比较了各组中的细胞活力改变和DNA损伤情况,结果发现,同样经过UVB照射10 min,敲降ALKBH5的LEC与未处理组和干扰组相比细胞活力更差;15A3荧光染色结果也同样提示,遭受相同程度的UVB照射,敲降ALKBH5的细胞更易发生DNA损伤。因此,我们可以确定ALKBH5在LEC响应氧化应激损伤的过程中起到了保护作用,可对抗由UVB照射诱导的DNA损伤,具体机制尚不明确,仍然有待深入研究。
在DNA损伤修复过程中,首先检查点激酶CHK1和CHK2被激活,然后启动细胞周期检查点,从而引起细胞周期停滞和DNA修复[27]。DNA修复主要包括直接修复、碱基切除修复、核苷酸切除修复、错配修复、单链断裂修复以及双链断裂修复等途径[28]。相关研究发现,ALKBH5能调控ODRGs的表达[16,29-30]。课题组前期通过微阵列分析筛选和qRT-PCR检测验证了96个ODRGs,发现了在ARC和对照患者样本中显著差异表达的11个ODRGs,这些差异表达的ODRGs在DNA修复途径中发挥不同功能,促进DNA的损伤修复——LIG1、MGMT、SMUG1参与碱基切除修复,DCLRE1A、RPA2参与核苷酸切除修复,TREX1、MSH2、MSH3参与错配修复,FANCD2参与同源重组,MRE11A、XRCC6参与双链断裂修复[31]。对此,我们在LEC中靶向ALKBH5进行敲低,观察这些ODRGs的表达情况,结果发现,TREX1、FANCD2、LIG1、MSH2、MSH3、RPA2、SMUG1、XRCC6mRNA的表达在ALKBH5敲降后均显著升高,而DCLRE1A mRNA的表达显著降低,MGMT和MRE11AmRNA的表达则未见明显差异,表明敲降ALKBH5后,细胞内ODRGs的表达明显改变。其中,表达升高最为显著的FANCD2,在DNA损伤反应的早期阶段可发挥信号转导作用被ATM磷酸化,从而触发细胞周期停滞[32],同时还作为与其他信号转导通路协同作用的检查点机制的中心,在及时修复受损DNA中发挥着至关重要的作用[33]。此外,作为哺乳动物细胞中重要的3’-5’ DNA核酸外切酶,TREX1除了能优先选择错配的核苷酸,参与错配修复外[34],还可通过降解细胞周期S期出现的单链DNA,阻止慢性ATM依赖性检查点的激活[35],多阶段促进DNA损伤修复。
综上所述,ALKBH5在ARC患者以及UVB诱导的细胞氧化损伤模型中表达升高。在UVB诱导的细胞氧化损伤模型中靶向敲降ALKBH5,可导致细胞活力下降以及DNA损伤程度加重,同时ODRGs表达升高,促进DNA损伤修复。而在ARC患者中,ALKBH5表达的显著升高也意味着ODRGs的表达受到抑制,从而无法对LEC中长期累积的DNA损伤进行及时修复,最终导致ARC的发生。因此,我们的结果证实了m6A去甲基化酶ALKBH5在UVB诱导的LEC氧化损伤模型中诱导性表达上升,敲降ALKBH5可影响细胞内ODRGs表达变化,参与调控LEC内损伤DNA的修复,阻止ARC的发生。

