NFC杨梅汁加工及贮藏环节微生物群落多样性分析
宣晓婷,崔 燕,程 焕,邓文艺,尚海涛,林旭东,张 铁,凌建刚,
(1.宁波市农业科学研究院农产品加工研究所,浙江宁波 315400;2.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058;3.湖南一品东方生物科技有限公司,湖南 长沙 410000)
杨梅(Myrica rubra Sieb.etZucc.)主产于长江中下游以南地区,因其风味独特浓郁、酸甜可口、营养价值高(富含花色苷、类黄酮、酚酸类等活性成分)而深受消费者喜爱。杨梅采收期主要集中在梅雨高温季节,且易受到机械损伤、微生物侵染等问题而导致品质下降,甚至失去其商品价值。因此杨梅产业亟需寻找一种减少采后损失、提高产品市场竞争力的技术手段。近年来,随着大众消费者对健康和营养的需求转变,非浓缩还原果汁(Not-from-concentrate juice,NFC)逐渐受到广大消费者的喜爱。NFC果汁在加工过程中温度低、时间短,所以较传统的浓缩还原果汁能更好地保留新鲜水果中原有的营养和风味。将杨梅鲜果加工成高品质的NFC杨梅汁可以有效地解决难运输、短销售期、短贮藏期等难点[1]。
超高压技术(High Hydrostatic Pressure,HHP)是NFC果汁加工过程中的重要环节,作为一种新型的食品非热加工技术,它的作用机理是通过水为传压介质,均匀地施压于果汁物料,可以达到杀菌、钝酶、改善品质等效果,且很好地保留了果汁原有的色香味和营养活性物质,因此超高压技术被广泛应用于单一型果汁[2-3]、复合型果汁[4]和果蔬复合汁[5],目前关于超高压控制果汁中微生物生长、延长货架期等研究已有相关报道[3,6],Stinco C M等人[6]研究发现超高压(450,600 MPa)处理胡萝卜浊汁5 min可延长其货架期至14周;Blaszczak W等人[3]也发现400~600 MPa使得黑莓汁的菌落总数降至检测限值(1 CFU/mL)以下。关于加工环节、贮藏及超高压处理对NFC果汁中微生物多样性变化的研究极少,因此开展杨梅汁加工、贮藏及超高压处理对其微生物组的研究非常必要。
早期的微生物群落多样性的研究主要采用纯培养、理化鉴定等技术手段,但对于自然环境中出现的不可培养或是无法鉴定的微生物则束手难测[7-8]。随着研究技术手段的不断更替,免培养技术应运而生,包括温度梯度凝胶电泳、变性梯度凝胶电泳[9-10]、限制性片段长度多态性[11-12]、荧光原位杂交[13]等。免培养技术增加了可鉴定的微生物种类,但距离全面建立微生物种类的数据库还存在很大的差距。因此,作为第二代测序技术的高通量测序技术有效克服了传统纯培养技术的局限性,同时因其能同时对数百万个DNA分子进行测序,精度高、无偏性等优势被广泛用于快速鉴定微生物多样性和鉴别新微生物种群[14]。目前,基于16S rRNA基因的高通量测序技术以罗氏公司454测序技术、Illumina公司Solexa测序技术和ABI公司的Solid测序技术为代表,广泛应用于检测各类食品中的微生物多样性,如发酵乳品[14-15]、酒类[16-18]、调味料[19-20]、水产品[21]、蔬菜[22]等,但在果汁领域的应用极少,仅在哈密瓜汁、樱桃等有相关文献报道[20-21]。
基于高通量测序方法对杨梅汁在加工环境、贮藏期、超高压处理过程中细菌群落结构进行比较分析,更加全面地展现杨梅汁在全产业链中微生物多样性及演替变化,为更好地控制杨梅汁中微生物奠定理论基础。
1 材料与方法
1.1 材料与仪器
东魁杨梅,宁波宁海善福果蔬专业合作社提供,选择新鲜无虫蛀、无腐烂的成熟果实,清洗去除污垢杂质,原料冷冻贮存。
PCR产物纯化试剂盒,美国Thermo公司提供;PCR扩增试剂及引物,TaKaRa公司提供;AxyPrep DNA凝胶回收试剂盒,AXYGEN公司提供;Phusion R High-Fidelity PCR Master,美国New England Biolabs公司提供;其他试剂,均为进口或国产分析纯。
超高压设备,北京速原中天有限公司产品;NovaSeq6000 DNA测序仪,德国Illumina公司产品;GeneAmp R 9700 PCR仪,美国ABI公司产品;QuantiFluorTM-ST蓝色荧光定量系统,美国Promega公司产品;PowerPacUniversal水平电泳仪、SUBCELL GT电泳槽,美国Bio-Rad公司产品。
1.2 试验方法
1.2.1 工艺流程杨梅→挑选→清洗→去核→榨汁→过滤→超高压杀菌→杨梅汁。
1.2.2 操作要点
(1)原料选择和清洗。选择新鲜无虫蛀、无腐烂的成熟果实,清洗去除污垢杂质。
(2)去核。杨梅在榨汁前进行人工去核,杨梅果肉备用。
(3)榨汁和过滤。为了最大限度地保留果蔬营养物质,将清洗后去核的杨梅在低温下进行榨汁,然后用纱布进行过滤。
(4)超高压处理。根据国家标准GB 7101—2015,并基于超高压杨梅汁的菌落总数预试验结果,确立超高压参数为压力500 MPa,保压时间5 min,设备升压时间为3 min,泄压时间3~5 s。将样品置于超高压灭菌仓中进行处理,处理结束后,将样品取出备用。
1.2.3 组别的设置
(1)加工环节试验组。试验组以杨梅原果为空白对照组(A1),选取重要加工环节(榨汁和杀菌)的杨梅样品分别设为A2和A3组,对比3组加工环节试验组(Group 1)杨梅样品中微生物菌群组成。
(2)贮藏期试验组。试验组以超高压杀菌后的杨梅汁为对照组(A3),在4℃下贮藏1,2,3周的杨梅汁样品,分别设为A4,A5,A6组,对比4组贮藏期试验组(Group 2)杨梅汁样品中细菌群落组成。
(3)超高压试验组。试验组以超高压杀菌(500 MPa/5 min)后的杨梅汁为对照组(A3),设500 MPa/10 min超高压试验组为A7,500 MPa/5 min+5 min超高压试验组为A8(即反复升泄压1次)。对比3组超高压试验组(Group 3)杨梅汁样品中细菌群落组成。
1.2.4 基因组DNA抽提
基于CTAB/SDS方法提取样品中的总基因组DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA浓度和纯度。根据浓度,用无菌水将DNA稀释至1 ng/μL。
1.2.5 PCR扩增及测序
参考张敏等人[14]和杨胜平等人[21]的方法进行PCR扩增。全部样品重复3次,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用Axy-PrepDNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测,选择400~450 bp亮主条的样品进行进一步试验。
扩增样品混合后采用GeneJET Gel Extraction Kit纯化,在超微量紫外分光光度计上精确定量后,等量混合在Illumina PE250测序平台进行测序,PCR扩增及测序工作由上海元莘生物医药科技有限公司完成。
1.3 数据分析
基于3次重复试验所得的原始数据,采用Trimmomatic、Usearch 10.0软件处理进行分类单元OTU(Operational taxonomic unit)聚类分析和物种分类学分析,基于OTU聚类分析结果,通过QIIME 1.9.1软件对OTU进行Chao1、ACE、Shannon和Simpson指数等多样性指数分析,以及对测序深度the Good's coverage的检测。基于分类学信息,可以在门和属分类水平上进行菌群结构的统计分析。根据稀释性曲线可得出测序深度情况。根据样品间丰度相似性聚类,将聚类后数据表示在Heatmap图中,通过颜色梯度及相似程度来可视化反映样品间在各分类水平上群落组成的相似性和差异性。
2 结果与分析
2.1 样品序列数的特点
通过细菌的16S rDNA测序,加工环节试验组(Group 1)3个样品共产生191 952个序列标签,平均长度为382.45 bp,所有序列按97%的相似度进行OTU分类,总共聚成296个OTU。贮藏试验组(Group 2)4个样品共产生249 131个序列标签,平均长度为383.75 bp,OTU分类共聚成497个OTU。超高压试验组(Group3)3个样品共产生184 246个序列标签,平均长度为381.40 bp,OTU分类共聚成332个OTU。
2.2 样品菌群多样性分析
不同加工环节杨梅样品的信息、序列丰度及微生物多样性见表1,杨梅汁贮藏期样品的信息、序列丰度及微生物多样性见表2,不同超高压处理杨梅汁样品的信息、序列丰度及微生物多样性见表3,细菌群落基于UniFrac的稀释曲线见图1。

表1 不同加工环节杨梅样品的信息、序列丰度及微生物多样性

表2 杨梅汁贮藏期样品的信息、序列丰度及微生物多样性

表3 不同超高压处理杨梅汁样品的信息、序列丰度及微生物多样性
试验将不同样品相似度为97%的OTU进行聚类分析,评价3组试验组样品间的微生物菌群相似性,通过稀释曲线(Rarefaction curve)体现样品的测序深度情况[22-25]。稀释曲线使用97%相似度的OTU,用来比较测序数据量不同的样品中物种的丰富度[26]。由图1可知,稀释曲线逐渐趋于平缓,表明测序结果合理,且能反映样品中物种的丰富度和均匀度,其中曲线部分在横轴上的范围大,说明样品中物种丰度较高。

图1 细菌群落基于UniFrac的稀释曲线
细菌群落的多样性分析(Alpha-diversity)可以反映微生物菌群的丰度和多样性,包括Chao指数、Shannon指数、Simpson指数和覆盖率。由表1可知,加工环节中杀菌后杨梅汁中细菌Shannon指数明显高于其他组,说明杀菌后杨梅汁中微生物群落种群差异性较大。从OTU数可知,杀菌后杨梅汁的数值最高,其次是杨梅原料组,榨汁组最少。样品的Chao1指数有与OTU相类似的结果,这是由于Chao1算法通常是估算样品中所含OTU数目的指数,在生态学中常用来估计物种总数。随着加工环节的进程,样品的Simpson指数逐渐降低,Simpson指数是用于估算样品中微生物多样性指数,其数值越大,说明随着杨梅汁的加工,样品的群落多样性越低。有研究报道,超高压处理会导致菌群相对丰度和多样性降低,且对不同微生物的影响也不同[27-28],研究结果与之相一致。此外,杨梅汁样品的覆盖率均大于99%,说明测序结果可以代表样品中微生物的真实情况。表2和表3显示超高压处理组和贮藏组样品OTU没有明显变化规律,说明在不同超高压处理和贮藏期过程中样品的微生物群落种群差异性较小。Toledo D A J等人[23]研究了超高压对樱桃贮藏期间微生物多样性变化,发现其随着贮藏期到第60天显著下降,且600 MPa压力下樱桃中微生物多样性明显降低。试验结果发现贮藏期过程中的样品微生物群落种群差异性较小,猜测可能的原因是由于贮藏时间较短,其微生物多样性未发现显著变化。由表3结果显示随着增压次数增加,杨梅汁微生物多样性并未发生显著降低,汪兰等人[29]研究发现超高压处理具有较好的灭菌效果且随着增压次数的增加,菌落总数也有不同程度的减少,但对于微生物多样性的影响研究目前暂未报道。
2.3 样品细菌群落门和属水平分布
杨梅汁样品门(A,C,D)和属(B,E,F)水平菌群分布图见图2。

图2 杨梅汁样品门(a,c,d)和属(b,e,f)水平菌群分布图
3组试验中,杨梅汁的3个细菌门被鉴别,它们分别是变形菌门(Proteobacteria)、蓝藻菌门(Cyanobacteria)、未分类菌群。对杨梅汁中主要组成的3个门进行门水平菌群比例分布绘图。由图2(a)~(c)可知,所有杨梅汁样品均以变形菌门为最占优势的菌群门,占细菌总序列比值均超过55%。基于不同组试验进一步分析表明,榨汁和杀菌工艺降低了样品中变形菌门比例,而蓝藻菌门比例上升(由5.53%分别上升至40.46%和28.80%)。随着贮藏期的延长,样品中优势菌群门变形菌门占总序列比值有所上升,说明贮藏过程中优势菌群门以变形菌门为主。此外,随着超高压处理时间的延长,样品中变形菌门占总序列的比例也在上升,且循环超高压处理方式会提高其占比。研究结果表明超高压处理会导致菌群相对丰度和多样性改变,且对不同微生物的影响也不同,这与Perez Pulido R等人[27-28]的研究结果相一致。
由图2(d)~(f)可知,3组试验组中的微生物菌群的主要种属相差不大,但占比存在显著差异。杨梅汁样品中微生物菌群以葡糖杆菌属(Gluconobacter)、醋酸杆菌属(Acetobacter)、蓝藻菌属(Cyanobacteria_norank)、假单胞细菌属(Pseudomonas)、Mitochondria-norank、伯克氏菌属(Burkholderia-Paraburkholderia)为主要细菌种属。从加工环节组数据分析发现,榨汁环节降低了样品中葡糖杆菌属(53.44%降低至22.33%),而蓝藻菌属和醋酸杆菌属显著升高,分别升高至40.46%和19.85%;杀菌环节有相类似的变化规律,其中蓝藻菌属和醋酸杆菌属显著升高,分别升至28.80%和25.83%。从贮藏组数据分析发现,杨梅汁样品在贮藏第1周,原优势菌种属由蓝藻菌属变为葡糖杆菌属和醋酸杆菌属,其占总序列比分别为35.87%和30.28%;随着贮藏时间的延长,蓝藻菌属占比降低至12.32%,而葡糖杆菌属和醋酸杆菌属占比分别升至36.48%和32.18%。从超高压试验组数据分析发现,500 MPa/5 min处理组样品中细菌以蓝藻菌属(28.88%)、醋酸杆菌属(27.01%)和葡糖杆菌属(24.40%)为主要细菌种属,总占比达80.29%;随着超高压处理时间延长至10 min,样品中细菌以醋酸杆菌属(29.29%)、蓝藻菌属(27.08%)和葡糖杆菌属(24.94%)为主要细菌种属,总占比达81.31%;较直接泄压的超高压处理方式,反复泄压的超高压处理方式的样品中细菌以葡糖杆菌属(34.11%)、醋酸杆菌属(28.64%)和蓝藻菌属(22.90%)为主要细菌种属,总占比达85.65%。
应用高通量测序技术,检测果蔬中微生物多样性及相对丰度的研究相对较少。Wang L等人[30]研究了超高压对芦笋贮藏期微生物多样性的影响,研究发现芦笋中微生物以变形菌门(泛菌和假单胞菌属)、厚壁菌门(乳球菌和肠球菌)等为优势菌群。在芦笋贮藏期初期,超高压处理降低了假单胞菌的相对丰度但同时肠杆菌属显著增加。后续Toledo D A J等人[31]又研究了超高压对樱桃中微生物多样性的影响以及贮藏期间微生物的演替。微生物多样性研究发现樱桃中变形菌(Proteobacteria)的相对丰度最高,而葡糖杆菌属(Gluconobacter)和肠杆菌属(Enterobacteriaceae)是其中的优势菌属。在60 d的贮藏过程中葡糖杆菌属一直占有主导地位,这与研究的结果相类似。葡糖杆菌属是一种好氧非发酵革兰氏阴性杆菌,广泛分布于鲜花、水果等高糖环境中,也能在苹果酒、葡萄酒和啤酒等饮料环境中生长。虽然这种菌对人类没有致病性,但会导致水果腐烂和褐变[32]。葡糖杆菌和醋酸杆菌具有氧化代谢特性,可以氧化糖、有机酸和醇等部分有机小分子[33-34]。当乙醇存在时,葡糖杆菌和醋酸杆菌会产生乙酸,造成乙酸腐败。
2.4 样品细菌群落相似性分析
基于UniFrac的聚类树分析和主成分分析(Principal Component Analysis,PCA),试验将不同样品相似度为97%的OTU进行聚类分析3组试验组各自样品间的微生物群落相似性,通过Heatmap图可视化展现不同样品在属水平上群落组成的相似性和差异性[31]。
Group 1样品中细菌群落热图分析(a)和层次聚类分析(b)见图3,Group 2样品中细菌群落热图分析(a)和层次聚类分析(b)见图4,Group 3样品中细菌群落热图分析(a)和层次聚类分析(b)见图5,细菌群落基于UniFrac的主成分分析见图6。
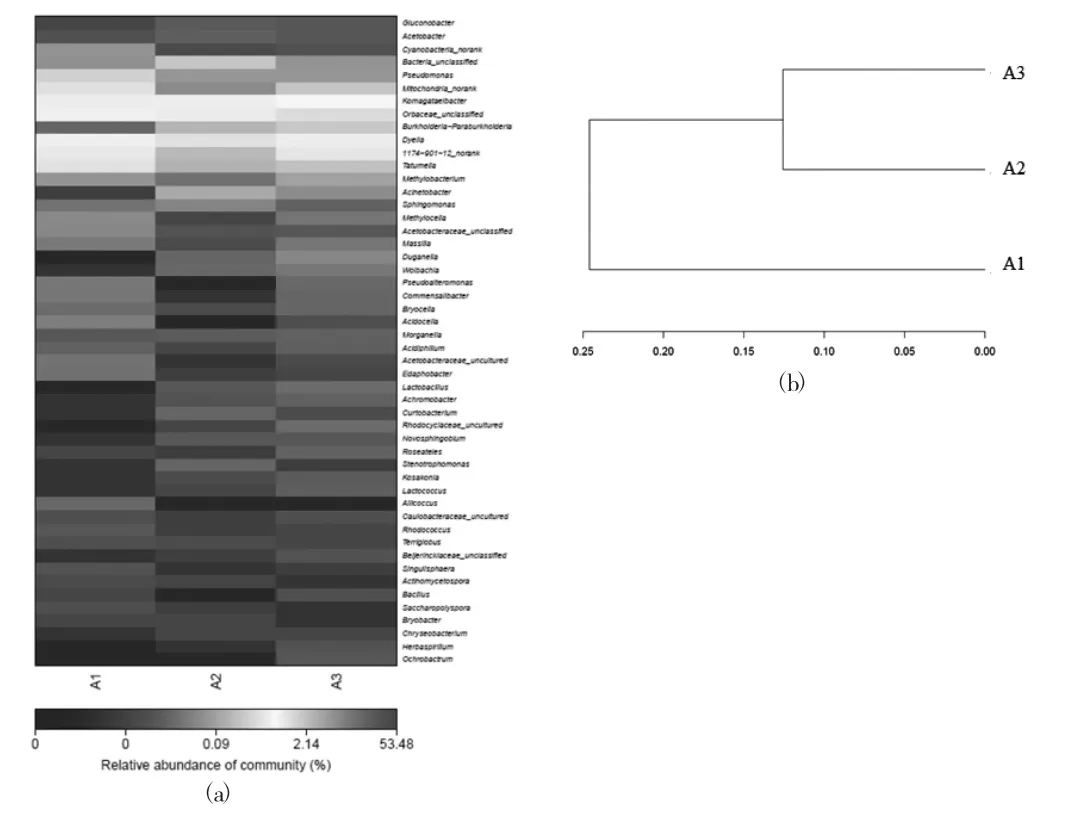
图3 Group 1样品中细菌群落热图分析(a)和层次聚类分析(b)

图4 Group 2样品中细菌群落热图分析(a)和层次聚类分析(b)
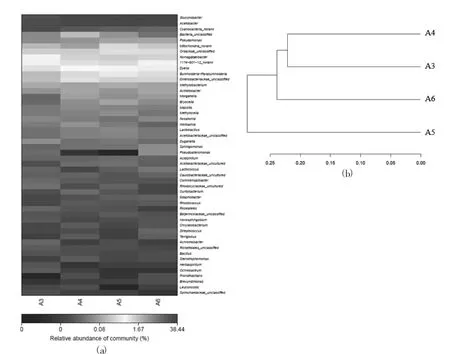
图5 Group 3样品中细菌群落热图分析(a)和层次聚类分析(b)

图6 细菌群落基于UniFrac的主成分分析
图3(a)、图4(a)和图5(a)分别为加工环节、贮藏期、超高压处理对杨梅中微生物群落影响热图分析,热图通过颜色梯度及相似程度来反映样品群落相似性,其中红色代表高丰度的细菌群落,蓝色代表低丰度的细菌群落。从图中可以看出杨梅汁样品中微生物菌群均以葡糖杆菌属(Gluconobacter)、醋酸杆菌属(Acetobacter)和蓝藻菌属(Cyanobacteria-norank)为排名前3的优势菌属。由图2(b)可知,加工环节试验组样品共聚成两类,第1类为空白对照组,第2类为榨汁和杀菌组样品,这就说明加工环节改变了杨梅样品中的微生物群落结构,增加了其差异性。图3(b)为贮藏期杨梅汁样品微生物群落动态变化的层次聚类分析。由图3(b)可知,样品共聚成3类,第1类为对照组和贮藏1周后的杨梅汁样品,第2类和第3类分别为贮藏2周和3周后的杨梅汁样品,说明贮藏中后期杨梅汁样品中的微生物群落差异性增加。图4(b)为样品中细菌群落层次聚类分析,所有超高压处理样品共聚成2类,第1类是500 MPa/5 min处理组和500 MPa/5 min+5 min组,第2类是500 MPa/10 min试验组样品,结果表明超高压处理时间的延长会改变杨梅汁样品中微生物多样性,而与单循环超高压处理相比,反复循环超高压处理后杨梅汁微生物菌群结构更接近对照组试验。
PCA主成分分析是一种多元统计方法,通过正交变换将一组可能相关变量降维转换为一组称为主成分的线性不相关变量的值,当累计贡献率超过80%时,即代表基本包含样品的信息。样品组成越相似,反映在PCA图中的距离越近。由图6可知,较榨汁加工试验组,杀菌试验组与空白对照组距离更远,说明杀菌后杨梅汁中的微生物差异性增加;贮藏3周试验组比贮藏1周试验组距离更远,说明随着贮藏期的延长,杨梅汁中微生物群落差异性增加;超高压试验组中,延长处理时间和改变泄压方式均增加了杨梅汁中的微生物差异性,且前者的影响较后者更大。
3 结论
综上所述,杨梅汁中微生物多样性在加工过程中呈逐步下降趋势,但在不同超高压处理和贮藏过程中杨梅汁的微生物群落种群差异性较小。在加工过程中,杨梅汁以变形菌门为主,其中榨汁和杀菌工艺降低了杨梅汁中变形菌门比例,而随着贮藏期的延长、超高压处理时间的延长或者循环超高压处理方式会提高样品中变形菌门比例。在属水平上,杨梅汁中微生物以葡糖杆菌属(Gluconobacter)、醋酸杆菌属(Acetobacter)、蓝藻菌属(Cyanobacterianorank)等为优势菌属。在加工环节试验组以蓝藻菌属为主;贮藏期试验组优势菌种属由蓝藻菌属变为葡糖杆菌属和醋酸杆菌属。通过探究杨梅汁在加工、贮藏和超高压杀菌环节中微生物群落结构与多样性变化,为进一步控制杨梅汁加工贮藏过程中关键环节的微生物安全性提供依据和参考。
此外,有研究证实超高压会导致微生物进入亚致死状态,这是由于杀菌不彻底、微生物胁迫耐受性等因素导致食源性致病菌出现正常和死亡以外的第3种生理状态——亚致死损伤状态,在产品贮藏、运输等过程中,一旦处于亚致死状态的致病菌处于适宜的环境条件下,亚致死菌能够自我修复并且恢复到正常的状态,一旦进入人体便会存在潜在危害,给食品安全保障带来严重隐患,未来将针对存在亚致死菌的食品,对其在贮藏期间微生物多样性变化的内在规律开展更深入的研究。

