不同产地杜仲雄花指纹图谱的建立及其化学模式识别研究
张 智,龙 华,曾 罗,李 韬,李 鹂
不同产地杜仲雄花指纹图谱的建立及其化学模式识别研究
张 智,龙 华,曾 罗,李 韬,李 鹂*
吉首大学生物资源与环境科学学院,湖南 吉首 416000
建立4个产地21批杜仲雄花的高效液相色谱(HPLC)指纹图谱,为杜仲雄花的质量控制提供参考。采用HPLC法,色谱柱为Agilent HC-C18色谱柱(250 mm×4.6 mm,5.0 μm);流动相为乙腈-0.1%甲酸水溶液;梯度洗脱;体积流量0.8 mL/min;柱温35 ℃;程序变化波长;进样量20 μL。通过相似度评价、偏最小二乘法分析(partial least squares discriminant analysis,PLS-DA)、系统聚类分析(hierarchical cluster analysis,HCA)以及气候因子相关性分析等对杜仲雄花指纹图谱进行分析评价。建立4个产地杜仲雄花HPLC指纹图谱,共标定15个共有峰,指认出其中6个色谱峰,分别为桃叶珊瑚苷、京尼平苷酸、绿原酸、京尼平苷、芦丁、槲皮素;21批杜仲雄花指纹图谱与对照图谱的相似度为0.911~0.989;PLS-DA分析表明不同产地杜仲雄花样品具有一定差异,根据变量投影重要性(variable importance in the projection,VIP)筛选出7个差异性成分;差异性成分峰面积结合气候因子的相关性分析结果显示9号峰峰面积与3、4月平均最低气温呈显著正相关,15号峰槲皮素峰面积与3月平均降水天数呈显著负相关,其余差异性成分与气候因子未呈现出明显的相关性。该方法可应用于杜仲雄花的质量评价,为杜仲雄花质量控制与资源开发提供参考。
杜仲雄花;指纹图谱;高效液相色谱法;偏最小二乘法分析;聚类分析;桃叶珊瑚苷;京尼平苷酸;绿原酸;京尼平苷;芦丁;槲皮素
杜仲Oliv.为我国特有单科单属单种植物,落叶乔木且雌雄异株[1]。杜仲传统以树皮入药,在我国已有2000多年药用历史,其树皮和叶为《中国药典》2020年版收载[2]。由于其良好的药理作用与经济价值,在我国被广泛栽种,主要产地有湖南、陕西、四川、贵州、河南等[3]。杜仲雌雄异株,雄花簇生于当年生枝条基部,早春开花,单株花期较短,仅1周左右,产量高,易采集[1,4]。杜仲雄花中含有与杜仲皮、叶类似的环烯醚萜类、黄酮类、酚酸类等成分,具有良好的抗炎抑菌、抗氧化、降血压、降血糖等药理作用,同时还含有丰富的营养成分[5-8]。2014年杜仲雄花被国家卫生计生委批准为新食品原料[9],已开发出杜仲雄花茶、杜仲雄花酒、保健品、功能饮料等,利用前景广阔。不同产地因其温度、湿度、海拔、土壤等生态因子的不同,影响着有效成分含量高低,进而导致不同产地的植物原料具有功效不同[10-11]。由于杜仲的广泛种植,不同产地的植物化学成分含量未知且不同产地之间含量差异大,加上缺乏切实可行的质量评价标准,因此有必要寻找和探究导致次生代谢组分出现差异的原因及其主要变量,实现杜仲雄花质量评价和控制。
指纹图谱技术能够体现有效成分的整体性、稳定性,以及不同产地间的共有性图谱片段,被认为是控制天然药材质量的有效手段之一[12-13],但指纹图谱提供的信息量过大,不利于统计分析。近年来,模式识别技术作为化学计量学的重要组成部分,已成为提取复杂中药化学指纹图谱特征的重要数学方法,具有较好的预测精度和广泛的适用性[14]。2者的结合能够快速筛选出主要的差异性成分,达到区分不同产地、不同质量样品的目的[15-16]。已有杜仲指纹图谱的研究以杜仲皮、叶为主,杜仲雄花指纹图谱研究侧重于对不同花期进行评价,并探讨了杜仲雄花次生代谢成分积累规律[17]。本研究拟采用高效液相色谱(HPLC)法对杜仲4个主要产地的21批杜仲雄花建立指纹图谱,结合化学模式识别评价整体质量、筛选不同产地的差异性成分,并与各产地气候因子进行相关性分析,以探讨不同产地差异性成分的积累规律,了解杜仲雄花质量与产地的关系,为今后杜仲栽培基地的选择、雄花质量控制的完善提供参考。
1 仪器与试药
1.1 仪器
Agilent1260-II型高效液相色谱仪,配备G7155A DAD检测器、G7111A四元泵、G7129A自动进样器(美国安捷伦科技有限公司);BPX-52型电热恒温干燥箱(上海博讯实业有限公司医疗设备厂);KQ2200型超声波清洗器(昆山市超声仪器有限公司);PX84ZH型电子天平(美国奥豪斯仪器公司)。
1.2 主要试剂与材料
对照品绿原酸(批号100081-201610)、京尼平苷(批号110749-201919)、槲皮素(批号100081-201610)均购自中国食品药品检定研究院;对照品芦丁(批号B20771)、京尼平(批号B20635)购自上海源叶生物科技有限公司;对照品桃叶珊瑚苷(批号479-98-1)、京尼平苷酸(批号27741-01-1)购自成都克洛玛生物科技有限公司,以上对照品质量分数均≥98%。乙腈、甲醇(HPLC级,瑞典欧普森色谱纯试剂公司);甲酸(HPLC级,天津市科密欧化学试剂有限公司);纯净水。
不同产地21批杜仲雄花样品,于2021年4月分别采集自四川省资阳市乐至县、贵州省遵义市红花岗区、湖南省张家界市慈利县、陕西省汉中市略阳县4个省区。选择花期处于盛花前期长势良好的杜仲雄株(树龄为25年以上),每株样品分别采集上、中、下3部分杜仲雄花枝条,以内置冰袋的泡沫保温箱及时带回实验室处理。去杂质,60 ℃烘干至恒重,粉碎,过80目筛,存于自封袋中避光干燥处保存,备用。样品经吉首大学生物资源与环境科学学院李鹂教授鉴定为杜仲科植物杜仲Oliv.的雄花,样品来源信息见表1。
2 方法
2.1 色谱条件
色谱柱为Agilent HC-C18色谱柱(250 mm×4.6 mm,5.0 μm);流动相为乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱条件:0~15 min,5%~7% A;15~20 min,7%~14% A;20~42 min,14% A;42~45 min,14%~23% A;45~55 min,23%~25% A;55~60 min,25%~50% A;60~65 min,50%~100% A;65~75 min,100% A;75~77 min,100%~5% A;77~82 min,5% A;体积流量0.8 mL/min;柱温35 ℃;进样量20 μL;程序变化波长:0~8 min,202 nm;8~15 min,238 nm;15~25 min,324 nm;25~30 min,238 nm;30~40 min,240 nm;40~50 min,254 nm;50~82 min,374 nm。
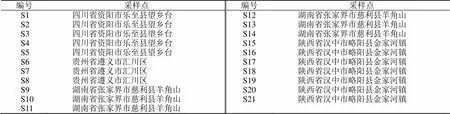
表1 杜仲雄花样品来源信息
2.2 供试品溶液制备
分别精密称取0.05 g样品粉末与4.0 mL 50%甲醇溶液混匀,称定质量,室温静置1 h,超声提取30 min,放冷,再次称定质量,用50%甲醇补足挥发溶剂,摇匀,使用0.22 μm微孔滤膜滤过,即得供试品溶液。
2.3 对照品溶液制备
分别精密称取1.5 mg桃叶珊瑚苷、1.4 mg京尼平苷酸、0.4 mg京尼平、0.6 mg芦丁、5.2 mg绿原酸、0.8 mg京尼平苷、0.5 mg槲皮素对照品,加入5 mL 50%甲醇溶解,制备成母液,备用。母液中各对照品质量浓度分别为0.3、0.28、0.08、0.12、1.04、0.16、0.1 mg/mL。
2.4 精密度试验
取同一批次(S1)杜仲雄花样品,按“2.2”项方法制备成供试品溶液,在“2.1”项下连续进样6次,记录色谱图。以5号峰(绿原酸)为参照峰,计算各共有峰的相对保留时间RSD均小于1%,各共有峰的相对峰面积RSD小于3%,表明仪器精密度良好。
2.5 稳定性试验
取同一批次(S1)杜仲雄花样品,按“2.2”项下方法制备成供试品溶液,在“2.1”项下色谱条件下于0、2、4、8、12、24 h测定,记录色谱图。以5号峰(绿原酸)为参照峰,计算各共有峰的相对保留时间RSD均小于1%,各共有峰的相对峰面积RSD小于3%,表明供试品溶液在24 h内稳定性良好。
2.6 重复性试验
取同一批次(S1)杜仲雄花样品,按“2.2”项下方法平行制备供试品溶液6份,在“2.1”项下色谱条件下进样,记录色谱图。以5号峰(绿原酸)为参照峰,计算各共有峰的相对保留时间RSD均小于1%,各共有峰的相对峰面积RSD小于3%,表明该方法重复性良好。
2.7 气候数据
综合考虑杜仲开花季节及环境条件,选取了3、4月的气温、降水量、湿度等12个气候因子用于研究。气候因子源于中国天气网(http://www. weather.com.cn/)进行下载收集。
2.8 化学模式识别
本研究采用系统聚类分析(hierarchical cluster analysis,HCA)以及偏最小二乘法分析(partial least squares discriminant analysis,PLS-DA)对各组数据进行分析。HCA属于无监督分析方法,即输入样本时不需要人为的给定分类标签,直接对数据进行建模分类,可以明显区分组间差异;而后者PLS-DA为有监督分析方法,在输入样本时需要人为给定分类标签,从而建立分类模型,PLS-DA可以有效地对组间观察值进行区分,并且能够找到导致组间区别的差异性变量。
3 结果与分析
3.1 HPLC指纹图谱建立与共有峰的确定
将21批杜仲雄花样品按照“2.2”项下方法制备成供试品溶液,在“2.1”项下色谱条件下进行分析,记录色谱图。导入“中药色谱指纹图谱相似度评价系统”(2012)版软件,以S1样品色谱图为参照图谱,采用中位数法,时间窗宽度为0.1 min,经多点校正后进行色谱峰的匹配,得到21批杜仲雄花样品的指纹图谱(图1)以及对照指纹图谱(图2),并进行相似度评价。从指纹图谱中共标定了15个共有峰,通过与混合对照品溶液色谱图(图3)对比,指认了其中6个峰,分别为1号峰桃叶珊瑚苷、2号峰京尼平苷酸、5号峰绿原酸、6号峰京尼平苷、11号峰芦丁以及15号峰槲皮素。
相似度评价结果(表2)表明,21批杜仲雄花样品图谱与对照指纹图谱之间的相似度在0.911~0.989,均在0.9以上,说明21批样品的化学成分基本一致,质量相对稳定,仅部分成分在含量上具有一定差异。5批四川乐至样品间的相似度为0.979~0.998,3批贵州遵义样品间的相似度为0.926~0.985,6批湖南慈利样品间的相似度为0.832~0.994,7批陕西略阳样品间的相似度为0.929~0.997。不同产地样品间的相似度为0.751~0.984,其中贵州遵义样品(S7、S8)与陕西略阳样品间的相似度整体较低,大多低于0.9,说明2产地的杜仲雄花间存在差异较大。

图1 21批杜仲雄花样品指纹图谱
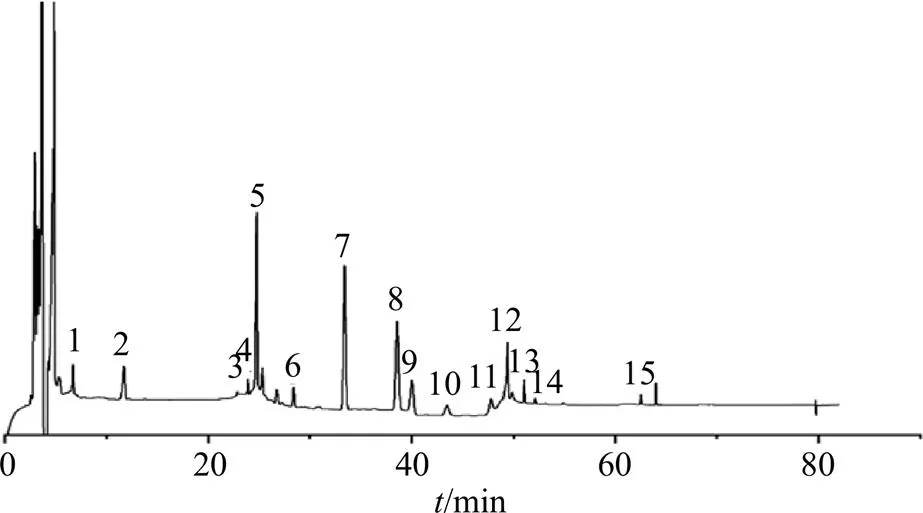
图2 杜仲雄花HPLC对照指纹图谱
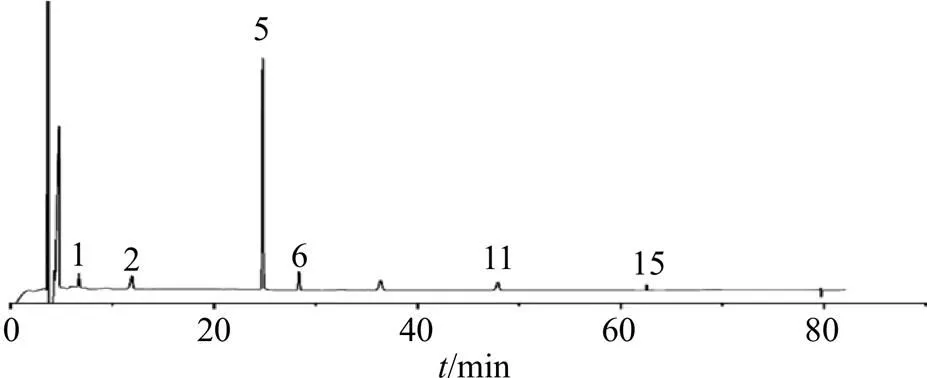
1-桃叶珊瑚苷 2-京尼平苷酸 5-绿原酸 6-京尼平苷 11-芦丁 15-槲皮素
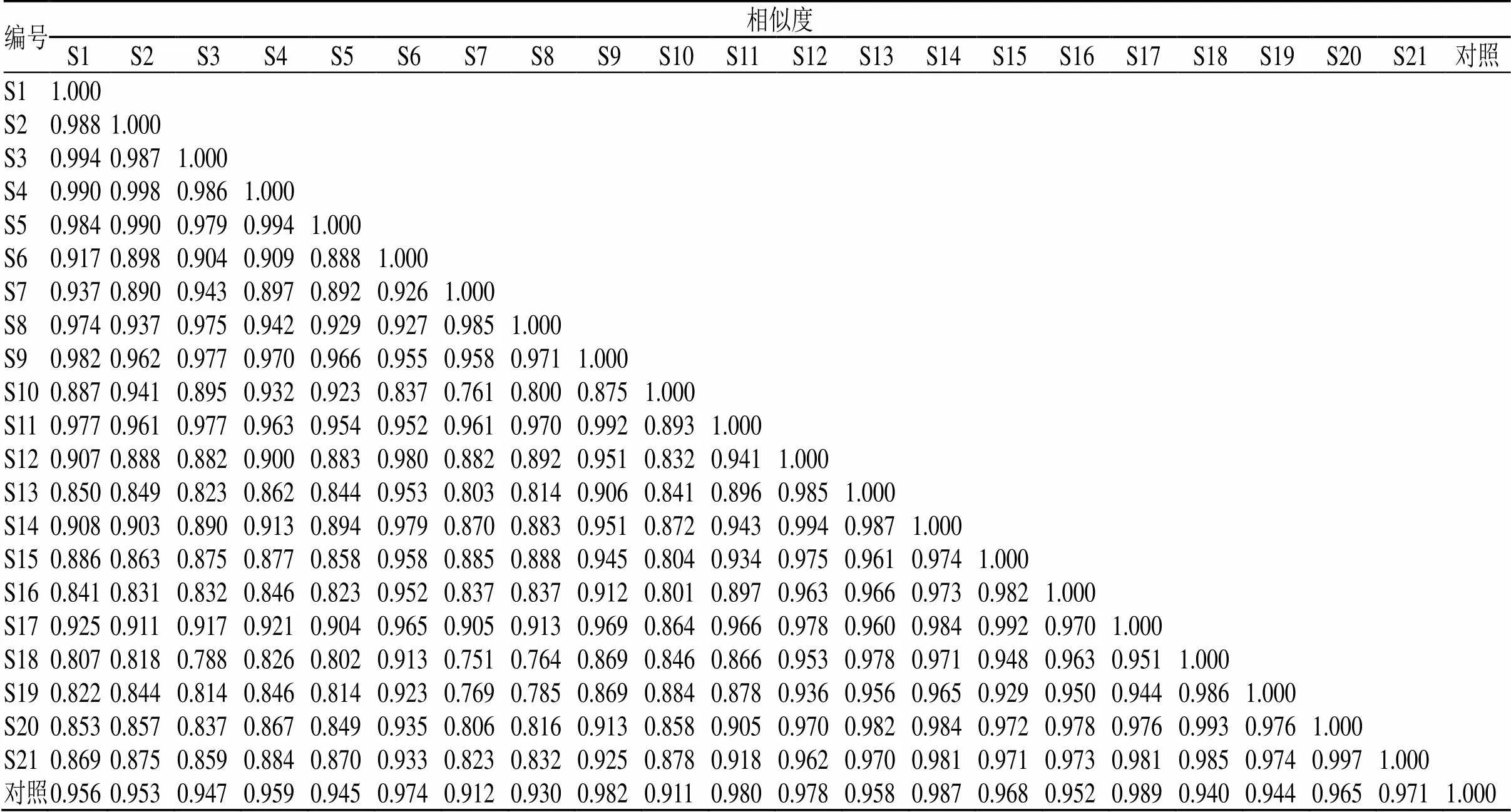
表2 指纹图谱相似度结果
3.2 HCA与PLS-DA
以21批杜仲雄花中15个共有峰峰面积为变量,组成21×15的数据矩阵进行HCA。原始数据经得分标准化后采用组间对比和距离公式作为样品的测度,分析结果见图4。结果显示以相对距离13.0为阈值,21批样品分为5个类别,即S1~S7聚为1类,S8~S9、S11~S12、S14聚为1类,S13、S15~S18、S20~S21聚为1类,S10单独聚为1类,S19单独聚为1类。聚类结果与雄花产地来源关联性不明显,存在产地交叉的现象。4个不同产地中仅四川乐至的样品被整体归为1类。湖南慈利和陕西略阳都存在单个样品独立为1类的现象,说明该样品与同产地其他样品间差异较大。
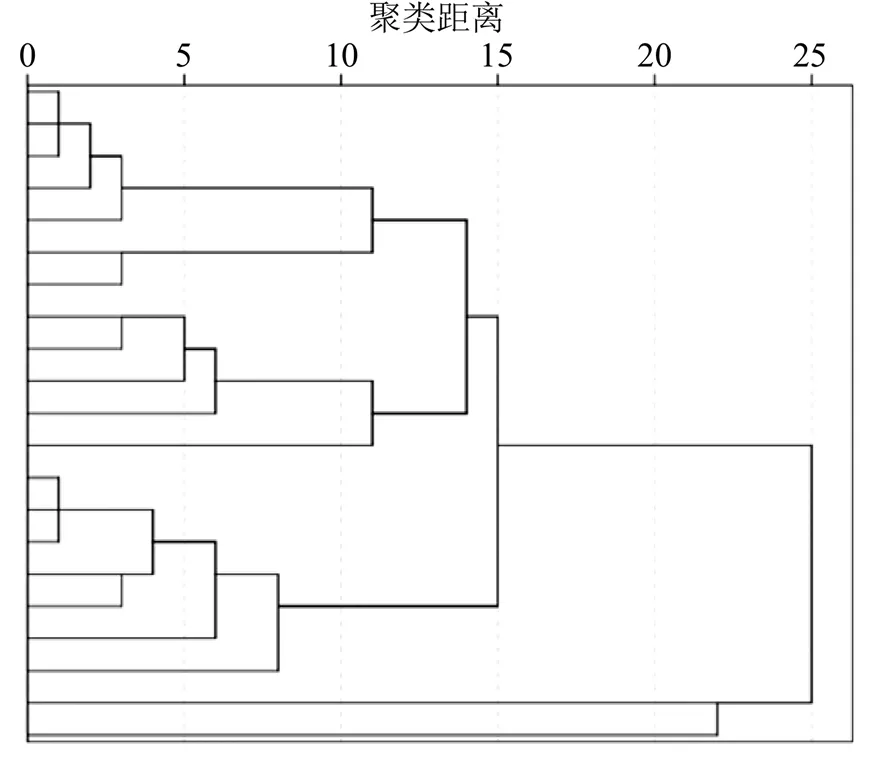
图4 21批杜仲雄花HCA图
为了更好地区分21批杜仲雄花样品,筛选出影响较大的差异性成分,选择有监督模式的PLS-DA进行判别分析。以21批样品中15个共有峰的峰面积为变量,组成1个21×15的新矩阵,采用SIMCA 14.1软件对新组成的矩阵进行PLS-DA,结果见图5。该模型的累积解释能力参数2和2分别为0.819和0.865,预测能力参数2为0.731,均大于0.5,说明模型稳定可靠。不同产地杜仲雄花样本点在得分图中完全被分开,相互之间没有出现样本交叉的情况,能够直观显示出各组间差异。根据模型中变量投影重要性(variable importance in the projection,VIP),分析筛选主导不同产地杜仲雄花样品相区分的差异性成分。VIP>1的变量被认为是重要变量[18-19]。模型中VIP>1的化学成分共有7个(图6),分别是15、1、11、9、4、13、3号峰,其中15号峰为槲皮素,1号峰为桃叶珊瑚苷、11号峰为芦丁。
3.3 差异性成分峰面积与气候因子相关性分析
依据PLS-DA结果,分别计算4个不同产地中7个VIP>1的成分峰面积的均值,通过SPSS 25.0软件与产地气候因子进行相关性分析,明确与差异性成分具有相关性的生态因子,结果见表3。15号峰槲皮素峰面积与3月平均降水天数呈显著负相关;9号峰峰面积与3月平均最低气温、3月平均气温、4月平均最低气温、4月平均气温呈显著的正相关;其余差异性成分与气候因子并未呈现出显著的相关性。从整体看,温度对9号峰化学成分以及4号峰化学成分的积累有促进作用,对3号峰化学成分的积累有抑制作用,降水量和湿度则对槲皮素、桃叶珊瑚苷影响较大,他们可能促进桃叶珊瑚苷的积累,抑制槲皮素的积累。
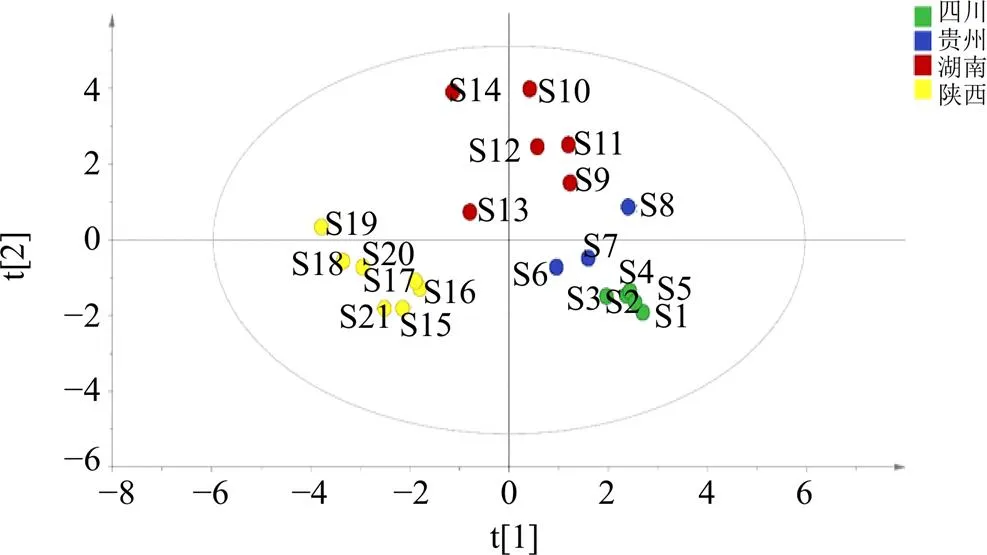
图5 21批杜仲雄花PLS-DA图
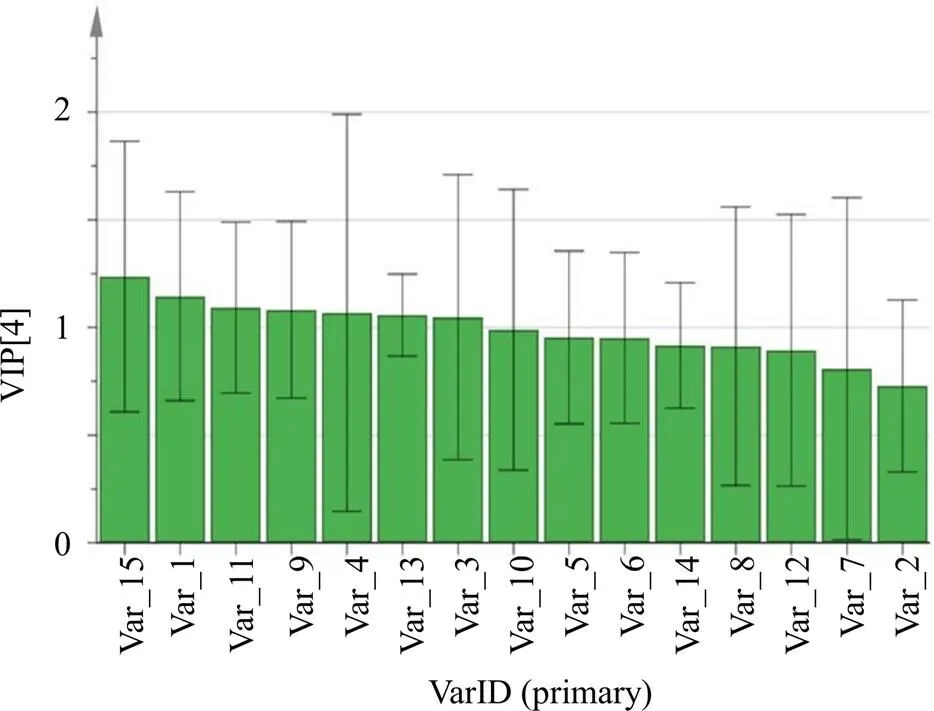
图6 差异性标志物VIP图
3.4 差异性成分峰面积与气候因子相关性分析
依据PLS-DA结果,分别计算4个不同产地中7个VIP值大于1的成分峰面积的均值,通过SPSS 25.0软件与产地气候因子进行相关性分析,明确与差异性成分具有相关性的生态因子,结果见表3。15号峰槲皮素峰面积与3月平均降水天数呈显著负相关;9号峰峰面积与3月平均最低气温、3月平均气温、4月平均最低气温、4月平均气温呈显著的正相关;其余差异性成分与气候因子并未呈现出显著的相关性。从整体看,温度对9号峰化学成分以及4号峰化学成分的积累有促进作用,对3号峰化学成分的积累有抑制作用,降水量和湿度则对槲皮素、桃叶珊瑚苷影响较大,它们可能促进桃叶珊瑚苷的积累,抑制槲皮素的积累。

表3 差异性成分与气候因子的相关系数
*和**分别表示相关性达到0.05和0.01的显著水平
*and**respectively represent significant levels of correlation of 0.05 and 0.01
4 讨论
本实验分别考察了不同浓度提取溶剂(50%、60%、70%甲醇),不同超声时间(20、30、40 min)对杜仲雄花样品色谱峰数目、峰分离度以及峰形的影响,结果显示50%甲醇提取,超声30 min所处理的样品效果最佳。考察了不同体积流量(1.0、0.8 mL/min),不同流动相乙腈-0.1%甲酸水溶液、甲醇-0.1%甲酸水溶液对分离效果的影响,确定乙腈-0.1%甲酸水溶液,体积流量为0.8 mL/min,可使各成分理想分离,且峰形较好。检测波长采用多波长检测,相较于单一波长检测,多波长的优势在于通过优选色谱峰的最大吸收波长,获取更多的共有峰信息,反映样品的峰信息更准确、更直接。综合各种因素,优化得到上述最终色谱条件。
21批杜仲雄花样品的相似度评价结果表明不同产地杜仲雄花质量较稳定,化学成分种类基本一致,差异主要为化学成分的含量。相似度结果高于前人对不同产地杜仲叶的相似度评价结果[20],其原因可能是由于杜仲雄花花期短,采集时间集中,且本研究中采集样点范围较小。HCA结果存在产地交叉的现象,尤其是湖南慈利和陕西略阳产地中都有单个样品独立为1类,表明该样品与同产地其他样品间差异较大,其原因可能是遗传因素的影响更大,超过了产地和气候的影响。杜仲经历长期的引种栽培,其群体间遗传变异小,相似程度高,遗传变异主要存在于群体内[21]。湖南慈利和陕西略阳均为我国杜仲的主要原生地及主产区,具有种质资源丰富、产量大等优点。推断当地长期对野生种质栽培驯化,在遗传背景上有一定体现,这也提示我们应当加强关注对杜仲原生地中种质资源的收集和保存,为将来杜仲良种选育提供基础。PLS-DA是一种有监督的判别分析方法,可以有效对组间观察值进行区分,并且能够找到导致组间区别的影响变量,有效提高组内聚集性。PLS-DA结果显示4产地样品分别聚集在各自所在区域,相互间无交叉,不同产地区别直观可见,区分效果较好。经VIP值筛选分析发现槲皮素、桃叶珊瑚苷、芦丁等是引起差异的主要成分。从指纹图中可知陕西略阳杜仲雄花的芦丁、京尼平苷峰面积明显大于其他产地,四川乐至杜仲雄花的槲皮素峰面积明显大于其他产地,在考虑杜仲雄花不同的药用价值或是与其他药用植物配伍时,可以侧重选择杜仲雄花的不同产地。气候因子相关性分析结果表明15号峰槲皮素和9号峰峰面积与气候因子存在一定相关性,其余成分峰面积与气候因子并无显著相关性,这可能是由于杜仲适生性强,4个产地气候因子的差异并不是造成差异性成分积累的主要因素。差异性成分的积累可能更多的受当地土壤条件、光照强度、日照时长等其他因素的影响,其作用规律有待进一步深入研究。整体而言,不同产地杜仲雄花具有一定的质量差异,主要表现为几个单一成分的差异,前人对不同产地杜仲叶的指纹图谱研究中也表现出类似的结果[20],推测这也是杜仲仅有主要产地而无明确道地产地的原因之一[3],在将来建立杜仲栽培基地时应综合考虑其生态环境的适宜性,以期提高杜仲雄花品质。本实验建立的指纹图谱方法可为杜仲雄花质量控制与资源开发利用提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志(第三十五(二)卷) [M]. 北京: 科学出版社, 1979: 116.
[2] 中国药典 [S]. 一部. 2020: 172-173.
[3] 何方, 张康健, 王承南, 等. 杜仲产区的划分 [J]. 经济林研究, 2010, 28(2): 86-87.
[4] 杜庆鑫, 刘攀峰, 庆军, 等. 杜仲种质资源雄花主要数量性状变异及概率分级 [J]. 北京林业大学学报, 2016, 38(11): 42-49.
[5] Li R, Huang T, Nie L L,. Chemical constituents from staminate flowers ofOliver and their anti-inflammation activity[J]., 2021, 18(8): e2100331.
[6] Chen S Y, Zeng X C, Zong W J,. Aucubin alleviates seizures activity in Li-pilocarpine-induced epileptic mice: Involvement of inhibition of neuroinflammation and regulation of neurotransmission [J]., 2019, 44(2): 472-484.
[7] Fu G, Tong H, Zeng H,. Antioxidant and xanthine oxidase inhibitory activity ofOliver leaf extracts [J]., 2018, 31(4): 1333-1339.
[8] 杜庆鑫, 刘攀峰, 魏艳秀, 等. 杜仲雄花氨基酸多样性及营养价值评价 [J]. 天然产物研究与开发, 2016, 28(6): 889-897.
[9] 国家卫生和计划生育委员会公告 2014年第6号 [J]. 中华人民共和国国家卫生和计划生育委员会公报, 2014(4): 8-11.
[10] 王玲娜, 苏征, 刘星劼, 等. 金银花活性成分与生态因子相关性研究 [J]. 中国实验方剂学杂志, 2016, 22(17): 27-31.
[11] 徐迎春, 张佳宝, 蒋其鳌, 等. 水分胁迫对忍冬生长及金银花质量的影响 [J]. 中药材, 2006, 29(5): 420-423.
[12] 刘晓凤, 王姚, 周思敏, 等. 川射干指纹图谱建立 [J]. 中成药, 2021, 43(7): 1950-1955.
[13] 刘东方, 赵丽娜, 李银峰, 等. 中药指纹图谱技术的研究进展及应用 [J]. 中草药, 2016, 47(22): 4085-4094.
[14] 李晶峰, 杨海南, 郅慧, 等. 不同产地槐角HPLC指纹图谱建立及化学模式识别研究 [J]. 中草药, 2021, 52(21): 6677-6682.
[15] 杨冰月, 彭亮, 颜永刚, 等. HPLC指纹图谱结合化学模式识别分析不同产地款冬花生品与蜜炙品 [J]. 中草药, 2018, 49(21): 4991-4997.
[16] 林丽, 李欢欢, 谢辉, 等. 基于HPLC指纹图谱结合化学计量学的旋覆花药材质量评价研究 [J]. 中草药, 2021, 52(6): 1751-1758.
[17] 叶东旭, 杜红岩, 李钦, 等. 杜仲雄花HPLC指纹图谱及成分积累规律的研究 [J]. 中成药, 2012, 34(4): 706-709.
[18] 于叶霞, 李鹂, 王元忠. 基于光谱和色谱数据融合策略的青叶胆及近似种的鉴别研究 [J]. 光谱学与光谱分析, 2020, 40(8): 2440-2446.
[19] 李振雨, 陈万发, 王利伟, 等. 不同基原厚朴UPLC指纹图谱及化学模式识别研究 [J]. 中草药, 2022, 53(1): 244-249.
[20] 唐芳瑞, 刘荣华, 邵峰, 等. 不同产地杜仲叶高效液相色谱指纹图谱分析 [J]. 时珍国医国药, 2016, 27(6): 1496-1498.
[21] 李洪果, 贾宏炎, 李武志, 等. 基于SSR标记的杜仲群体遗传多样性及遗传结构 [J]. 中南林业科技大学学报, 2018, 38(5): 79-85.
Establishment of fingerprint and chemical pattern recognition ofmale flowers from different cultivation areas
ZHANG Zhi, LONG Hua, ZENG Luo, LI Tao, LI Li
College of Biological Resources and Environmental Sciences, Jishou University, Jishou 416000, China
To establish HPLC fingerprints of 21 batches of male flowersfromin four producing areas and provide experimental reference for quality control and resource development of male flowersfrom.HPLC mthod was adopted. The determination was performed on a column of Agilent HC-C18(250 mm × 4.6 mm, 5.0 μm); Mobile phase: 0.1% formic acid (A) and acetonitrile (B); Flow rate: 0.8 mL/min; Column temperature: 35 ℃; Injection volume: 20 μLwas used to detect organic chemicals in male flowers. The fingerprint of male flowers fromwas evaluated via similarity evaluation, partial least squares discriminant analysis (PLS-DA), hierarchical cluster analysis and its relationship with climatic factors were also analyzed by using correlation analysis.HPLC fingerprints of male flowers offrom four producing areas were established. A total of 15 common peaks were calibrated and six chromatographic peaks were identified, which were aucubin, geniposidic acid, chlorogenic acid, geniposide, rutin and quercetin. The similarity between the established fingerprint of 21 batches and standard reference was 0.911—0.989. The results of PLS-DA analysis showed that there existed differences among male flower samples from different producing areas. Seven differential compounds were screened by variable importance in the projection (VIP). Moreover, correlation analysis between peak area of different compounds and climatic factors indicated that the peak area of No.9 was positively correlated with the average minimum temperature in March and April. The peak area of quercetin (No.15) was negatively correlated with the average precipitation days in March. The other five compounds showed no significant correlation with climate factors.The established method in this paper could be applied to evaluate the quality of male flowers from, with view to providing reference for quality control and resource development of male flowers from.
male flowers fromOliv.; fingerprint; HPLC; partial least squares discriminant analysis; cluster analysis; aucubin; geniposidic acid; chlorogenic acid; geniposide; rutin; quercetin
R286.12
A
0253 - 2670(2022)22 - 7207 - 07
10.7501/j.issn.0253-2670.2022.22.025
2022-03-13
国家自然科学基金资助项目(31960323);吉首大学校级科研项目(Jdy20080)
张 智(1997—),男,硕士研究生,研究方向为药用植物质量评价。Tel: 15008581385 E-mail: 785434618@qq.com
李 鹂,硕士生导师,教授,主要从事药用植物资源学。E-mail: lilyjsu@126.com
[责任编辑 时圣明]

