基于弱键诱导的小檗碱-黄酮苷类超分子“结构-构象-形态-活性”传导关系探讨中药配伍理论科学内涵
刘小靖,李 桐,袁枝花,皮雯敏,郭文博,王志家,雷海民,王鹏龙
基于弱键诱导的小檗碱-黄酮苷类超分子“结构-构象-形态-活性”传导关系探讨中药配伍理论科学内涵
刘小靖,李 桐,袁枝花,皮雯敏,郭文博,王志家,雷海民*,王鹏龙*
北京中医药大学中药学院,北京 100102
以2种不同的超分子,即黄芩苷-小檗碱(BA-BBR NG)和汉黄芩苷-小檗碱(WOG-BBR NF)为研究对象,利用弱键化学从“结构-构象-形态-活性”相关性探讨中药配伍“驱邪不伤正”的科学内涵。基于2个超分子葡萄糖醛酸基团构象(A式和N式)的不同,结合2D-NMR分析和最低能量构象研究,采用激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)、场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)对超分子进行表征,从宏观和微观现象的不同探讨这种结构和构象的差异对超分子形态的影响;同时,通过微量肉汤稀释法、平板划线法、细菌形态观察及生物膜清除实验评价超分子活性的差异。BA-BBR NG形态随浓度变化,当浓度大于成胶浓度(>10 mmol/L),其形态在电镜中观察到球形超分子逐步形成“珍珠链”状超分子,而WOG-BBR NF在各浓度下均为非交联的刚性纳米纤维;BA、WOG的最优构型分别为N式和A式,但当它们各自和BBR通过弱键作用力自组装后,最优构型则转变成了A式和N式;另外,体外抑菌研究表明2个超分子对大肠杆菌、金黄色葡萄球菌和屎肠球菌的抑制作用与小檗碱相比明显不同,且超分子抑菌活性呈现“选择性”。中药超分子物质基础与单体成分相比具有独特性,单体成分结构和构象的不同,会导致分子间相互作用在弱键诱导下形成不同的超分子形态,进而影响生物活性。
黄芩苷;汉黄芩苷;小檗碱;构象;活性;超分子;弱键化学
近年来,中药复方在煎煮过程中出现的“浑浊”现象以及中药来源小分子的自组装形成超分子现象逐渐引起了广泛地关注,成为国内外学者研究的热点之一,这也为更好地探索中药复方物质基础和配伍理论提供了一个新的研究方向。黄芩-黄连是临床上常用的一类具有清热燥湿功效的经典药对,出自东汉张仲景《伤寒论》,二者相须配伍“增效减毒”,如黄连解毒汤、葛根芩连汤等[1]。当前许多研究表明黄芩中主要有效成分为黄酮类化合物,含量较为丰富的有黄芩苷(baicalin,BA)、汉黄芩苷(wogonoside,WOG)等[2-3]。黄连的主要有效成分为生物碱类,其中最具有代表性的是小檗碱(berberine,BBR)[4-5]。同时,本课题组前期研究发现黄连解毒汤呈现复杂多相态,甚至在煎煮时会出现明显的自沉淀现象,化学和生物学研究均表明多相态的成因是药效成分相互作用的结果,例如该方汤剂的多相态主要与黄芩中黄酮类成分和黄连中生物碱类成分在弱键诱导下相互作用密切相关[6-8]。
在有机化合物分子中,构象是指由C-C单键旋转而产生的原子或基团在空间排列的无数特定的形象。分子的构象不仅能改变化合物的物理和化学性质,还会在一定程度上影响其活性[9]。Ren等[10]研究发现某类含有阿拉伯糖基的齐墩果烷型三萜皂苷,其活性会因阿拉伯糖基构象的变化而完全丧失活性。杨仕平等[11]研究鱼藤酮晶体结构和活性的关系,发现其生物活性会随着环II和III构象的不同而有所不同。构型和构象对分子相互作用的影响研究主要集中于DNA、蛋白以及多糖类等大分子,少有报道将天然小分子化合物分子构象与超分子形成机制相联系。超分子属于超分子化学的研究范畴,是指基本结构单元在弱键(氢键作用力、静电引力、π-π堆积等)的驱动下,自发的聚集形成纳米尺度的有序聚集态结构的过程[12-15],且此过程往往是可逆和可调控的。在前期本课题组利用等温滴定量热仪、核磁以及质谱等技术解析BBR和BA或WOG的具体结合比例均是1∶1,并对二者分别形成类球形纳米水凝胶(nanogel,NG)和纳米纤维(nanofiber, NF)的机制进行研究,并发现这2个超分子形态的不同与WOG中8位甲氧基的存在有一定关系,结构的差异导致水煎煮过程中分子间相互作用力存在明显差异[16];在此基础上,本实验进一步探讨黄芩苷-小檗碱(BA-BBR NG)和汉黄芩苷-小檗碱(WOG-BBR NF)超分子浓度、葡萄糖醛酸构象的不同导致的微观形态差异,并利用条件致病菌(大肠杆菌)、致病菌(金黄色葡萄球菌)和益生菌(屎肠球菌)模型,更加全面地探讨超分子形态的改变对抑菌活性的影响,借此揭示中药复方物质基础存在“化学结构-分子构象-超分子形态-生物活性”间的关系,以期更深入地探索中药配伍“驱邪不伤正”的科学内涵。
1 仪器与材料
1.1 仪器
MS105 Semi-Micro十万分之一电子天平(瑞士MettlerToledo公司);C-MAG-HS4磁力搅拌器(德国 IKA有限公司);FRESCO21台式微量离心机(美国热电科技仪器有限公司);真空冷冻干燥机(德国 Christ公司);Hitachi SU-8020场发射扫描电子显微镜(德国IKA有限公司);JOEL JEM-2100F透射电子显微镜(日本电子株式会社);Leica TCSSP8型激光扫描共聚焦显微镜(德国Leica公司);YXQ-LS-75SII型高压蒸汽灭菌锅(上海博讯实业有限公司);LRH-250型恒温生化培养箱(广州瑞明仪器有限公司);Multiskan GO型多功能酶标仪(芬兰热电科技仪器有限公司)。
1.2 材料
盐酸小檗碱(BBR,成都普瑞法科技有限公司公司,质量分数>98%);BA(北京伊诺凯科技有限公司,质量分数>98%);WOG(北京伊诺凯科技有限公司,质量分数>98%);二甲基亚砜(DMSO)、氢氧化钠(北京化工厂);营养肉汤培养基、营养琼脂培养基(北京索莱宝生物科技有限公司)。
2 方法
2.1 制备超分子
称取适量BA和WOG,将二者分别调制为pH 7.0的水溶液,在80 ℃下与BBR盐酸盐水溶液以1∶1(0.1 mmol/L)的比例混合,加热搅拌1 h,离心(9000 r/min)10 min,沉积物水洗3次,收集得到BA-BBR NG、WOG-BBR NF,冻干,备用。
2.2 超分子和细菌形态表征
利用激光扫描共聚焦显微镜(laser scanning confocal microscope,LSCM)、场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)对样品及其干预治疗后的细菌进行形态学分析。
2.3 微量肉汤稀释法
观察各样品对金黄色葡萄球菌、大肠杆菌和屎肠球菌的体外抑菌作用。将干燥后的样品溶于二甲基亚砜和营养液(1∶1)中,配制成浓度为10 μmol/mL的待测液备用,利用24孔板,第1孔加入200 μL样品溶液,再用营养培养基连续稀释,使各样品的浓度梯度为1.0、0.75、0.5、0.25、0.375、0.25、0.2、0.15、0.1、0.05及0.025 μmol/mL(DMSO浓度低于5%),终体积为1 mL。每孔加50 μL(2×106CFU/mL)细菌培养物,摇匀。同时以BBR为阳性对照,营养培养基为溶剂对照。然后将24孔板放入37 ℃恒温培养箱中孵育16 h,采用酶标仪在600 nm波长下测定菌悬液的吸光度()值。所有实验重复3次,根据公式计算样品对细菌的抑制率。
抑制率=1-(样品-溶剂)/(空白菌-溶剂)
2.4 平板划线法
再次通过平板划线法测定各样品的抑菌活性,将上述各样品不同浓度下获得的菌液用灭菌后的接菌种环分区划线接种于营养琼脂板上,37 ℃恒温培养箱中培养16 h,观察菌落数。
2.5 清除生物膜
于48孔板内加入用培养基(含1%葡萄糖)稀释10倍后的菌悬液,每孔500 μL,在37 ℃恒温培养箱中培养24 h后,用注射器轻轻吸除培养基,用磷酸缓冲液(PBS)洗涤1次后,加入含BBR以及BA-BBR NG、WOG-BBR NF的培养基,使浓度为0.05 μmol/mL,同时以培养基为空白,继续在37 ℃恒温培养箱内孵育24 h。药物干预结束后,用注射器轻轻吸除液体培养基,PBS清洗3次,再用等量体积分数2.5%戊二醛固定4 h后,PBS清洗3次,然后用梯度浓度乙醇(30%、50%、70%、80%、90%、95%、100%)分别洗脱,每次脱水10 min,充分干燥后,在SEM下观察各样品对生物膜的清除情况。
按照上述方法在玻璃盖玻片上培养生物膜,药物干预后,PBS清洗3次,再加入吖啶橙(强荧光生物膜生物量指示剂),LSCM避光拍照。
2.6 细菌形态观察
于24孔板中用营养培养基稀释BBR、BA-BBR NG及WOG-BBR NF,至终浓度为0.025 μmol/mL,加入等量菌液,摇匀,在37 ℃恒温培养箱内培养 8 h后,收集菌悬液在3000 r/min下离心10 min,收集细菌。PBS清洗3次,加入体积分数为2.5%的戊二醛固定4 h,然后用梯度浓度为30%、50%、70%、80%、90%、95%的乙醇水溶液和乙醇洗脱,每次10 min,再用乙醇溶解细菌样品,取3 μL滴在硅片上,干燥后喷金,并用FESEM进行检测分析。
3 结果
3.1 超分子“结构-构象-弱键-形态”表征
3.1.1 超分子的形态表征 根据试管倒置法的结果(图1-A),BA-BBR NG的宏观形态是水凝胶,而WOG-BBR NF则表现为黄色沉淀;同时如FESEM图像(图1-B)所示,可以很清楚地看到,BA-BBR NG的视野中充满了大量水凝胶经典的交联和缠绕结构,这与前期在低浓度下观察的球形颗粒状超分子形态显著不同[16];并且首次发现当BA-BBR NG浓度大于成胶浓度(>10 mmol/L),其形态在电镜中观察到球形超分子逐步形成“珍珠链”状超分子,分子相互交叠,形成含有球形、线形及交联状等各类形态超分子的“过渡态”(图1-C),具体的组装过程如图1-D所示;同时在WOG-BBR NF的FESEM图中(图1-B),只能观察到直径为百纳米级、长度为微米级的非交联的刚性纳米纤维,未发现其微观形态随浓度变化。
如图2所示,利用LSCM分别在明场和绿场(激发波长为488 nm)下也观察到了不同形态的超分子,显而易见的是,BBR单体的水溶液经干燥后会析出针状晶体,BA-BBR NG为片层状的干凝胶,而WOG-BBR NF则分离出丝状纤维,与此同时,所有超分子体都能产生类似于BBR的绿色荧光,与扫描电镜的实验结果保持了一致。宏观和微观现象的数据初步验证了本研究的推测,即结构和构象的不同会在一定程度上影响超分子的形态特征。
3.1.2 超分子“结构-构象-弱键”关系研究 在前期工作基础上,结合已有的ROESY谱图(图3-A),能看到BA的H-1′′,5′′与自身H-8相关(交叉点b、c),这说明BA的糖基团与母核相互靠近,超分子单元呈现“U”形,而WOG中H-1′′,5′′与H-6之间有空间相关(交叉点b、c),表明糖基团远离了母核,从而呈现“I”形。进一步分析8-OCH3取代基的有无导致超分子中黄酮类糖基团构象的不同,即虽然BA和WOG的糖基团均为椅式构象,但前者以A式(alternative form,交替式)构象存在,后者以N式(normal form,正常式)构象存在[17](图3-C),故在静电引力和疏水作用下,BBR和BA或WOG形成超分子的过程中,分别形成亲水的糖基团在外侧、疏水的芳环在内侧的“U形”自组装单元和亲水的糖基团在内侧、疏水的芳环在外侧的“I形”自组装单元(图3-A)[16]。基于上述分析,进一步通过Chem 3D的MM2分子力场对BA、WOG以及BA-BBR NG、WOG-BBR NF中糖基的A式和N式构象分别进行了初步的构型优化,从而得到最优构型的总能量见表1,具体构型见图3-B。通过能量值发现,BA、WOG的最优构型分别为N式和A式,但当它们和BBR通过弱键作用力自组装后,最优构型则转变成了A式和N式;另外,Wang等[18]通过BA-BBR NG和WOG-BBR的NOESY谱图以及NaBH4还原实验发现2个超分子的构象有很大的不同,这也与本实验的结论相一致,即单体成分的结构和构象不同会导致分子间在弱键诱导下相互作用形成不同的超分子形态。
3.2 游离单体与超分子抑菌活性研究
3.2.1 利用肉汤比浊法测定超分子对3种细菌抑制活性 为更全面地探讨“结构-构象-形态-活性”的相关性,分别用BBR、BA-BBR NG和WOG-BBR NF对条件致病菌(大肠杆菌)、致病菌(金黄色葡萄球菌)以及益生菌(屎肠球菌)进行了体外抗菌活性试验。另外,由于前期发现BA和WOG在此抑菌浓度下活性较弱[16],故未作为对照组设置。由图4-I-A可知,对于大肠杆菌,WOG-BBR NF在各个浓度下均表现出与BBR相似的抑菌效果;BA-BBR NG的抑菌效果明显减弱,在最高浓度(1 μmol/mL)时,抑菌强度低于20%。对于金黄色葡萄球菌(图4-I-B),所有样品均表现出较好抑菌活性,且呈浓度相关性;值得注意的是,在低浓度(0.025~0.1 μmol/mL)下,较WOG-BBR NF和BBR来说,BA-BBR NG表现出更优越的抑菌效果。对于屎肠球菌(图4-I-C),在浓度(0.2~1 mol/mL)时,BA-BBR NG和WOG-BBR NF的活性要明显弱于BBR;在较低(0.025~0.15 mol/mL)浓度下,虽然WOG-BBR NF较其他样品表现出增强的抑制作用,但抑菌强度低于40%。总的来说,BBR对这3种细菌的抑制没有选择性,BA-BBR NG对大肠杆菌和屎肠球菌的抑制作用均显著降低,但对金黄色葡萄球菌的杀伤力增强,同时WOG-BBR NF对大肠杆菌的作用要优于BA-BBR NG;这也说明分子结构和构象的不同,会导致最终超分子形态的不同,从而使抑菌效果呈现“选择性”差异。
3.2.2 利用平板划线法测定超分子对3种细菌生长的抑制活性 采用平板划线法进一步验证BA-BBR NG和WOG-BBR NF对不同细菌生长情况的影响。从图4-II-A中,可以很清楚地看到当样品浓度为0.100 μmol/mL时,肉眼观察BBR和WOG-BBR NF培养基在相应区域内生长出的菌落数较少,而BA-BBR NG对大肠杆菌的抑制作用较弱,能看到大量明显的菌群。将金黄色葡萄球菌和各样品共孵育后的菌悬液接种于平板上(图4-II-B),样品浓度为0.100 μmol/mL时,BA-BBR NG有少量菌生长,而BBR和WOG-BBR NF能看见大量明显的菌落。图4-II-C显示BA-BBR NG和WOG-BBR NF对屎肠球菌的抑制作用均要弱于BBR,这与微量肉汤稀释法的实验数据相一致。进一步验证中药有效成分的超分子态与游离态相比,呈现对致病菌和条件致病菌的抑菌活性选择性增强,而对益生菌抑制作用选择性降低,该研究结果为中药配伍“祛邪不伤正”的科学内涵提供了数据支持。
3.2.3 超分子选择性抑制致病菌金黄色葡萄球菌的机制探讨 为了进一步观察超分子的活性差异,以金黄色葡萄球菌为例进行机制上的探讨,将BA-BBR NG、WOG-BBR NF分别与共培养,再用FESEM直接观察。由图-5可知,正常金黄色葡萄球菌在培养2 h或6 h后,菌体周围未见明显干扰因素,表面平滑,呈现出规则的球体状;有趣的是,在给药2 h后,在低浓度下的BA-BBR NG组细菌周围观察到大量纳米颗粒,细菌表面有轻微皱缩(图5-A);而在WOG-BBRNF组中,能看到细菌被嵌入到纳米颗粒中(图5-A)。此外,在给药6 h后,观察到细菌表面已被大量NPs覆盖,将细菌紧紧包裹且菌体的形态变化明显(图5-B);然而,与WOG-BBR NF共孵育的细菌依旧呈现为较圆滑的球形,形态变化不明显,表面也没有显著的损伤(图5-B),此现象与上述抑菌实验所证实的活性差异一致。并能清楚地看到经BA-BBR NG干预后的细菌,似乎被纳米颗粒紧紧“黏附”,从而增加了细菌周围局部的药物浓度,扩大了细菌与药物接触的面积,也进一步阻断了细菌氧气和营养的摄入,进而影响到金黄色葡萄球菌的生命活动,最终导致其死亡;至于WOG-BBR NF,推测是其线状形态的束缚限制了更多药物与球形的的接触,从而导致组装体抑菌活性减弱(图5-C)。根据上述实验结果,进一步推测WOG-BBR NF对的抑制能力要好于BA-BBR NG,是由于的菌体呈杆状,WOG-BBR NF能很好地全方位地将杆菌“嵌入”在药物中而更好地抑制细菌的生理活动,这也与上述抑菌实验的趋势相同;超分子对于益生菌屎肠球菌抑制作用呈现降低趋势,推测益生菌的生理结构与金黄色葡萄球菌和大肠杆菌不同有关,上述研究再次表明超分子形态与其活性密切相关,但深入的生物学机制差异还有待深入研究。
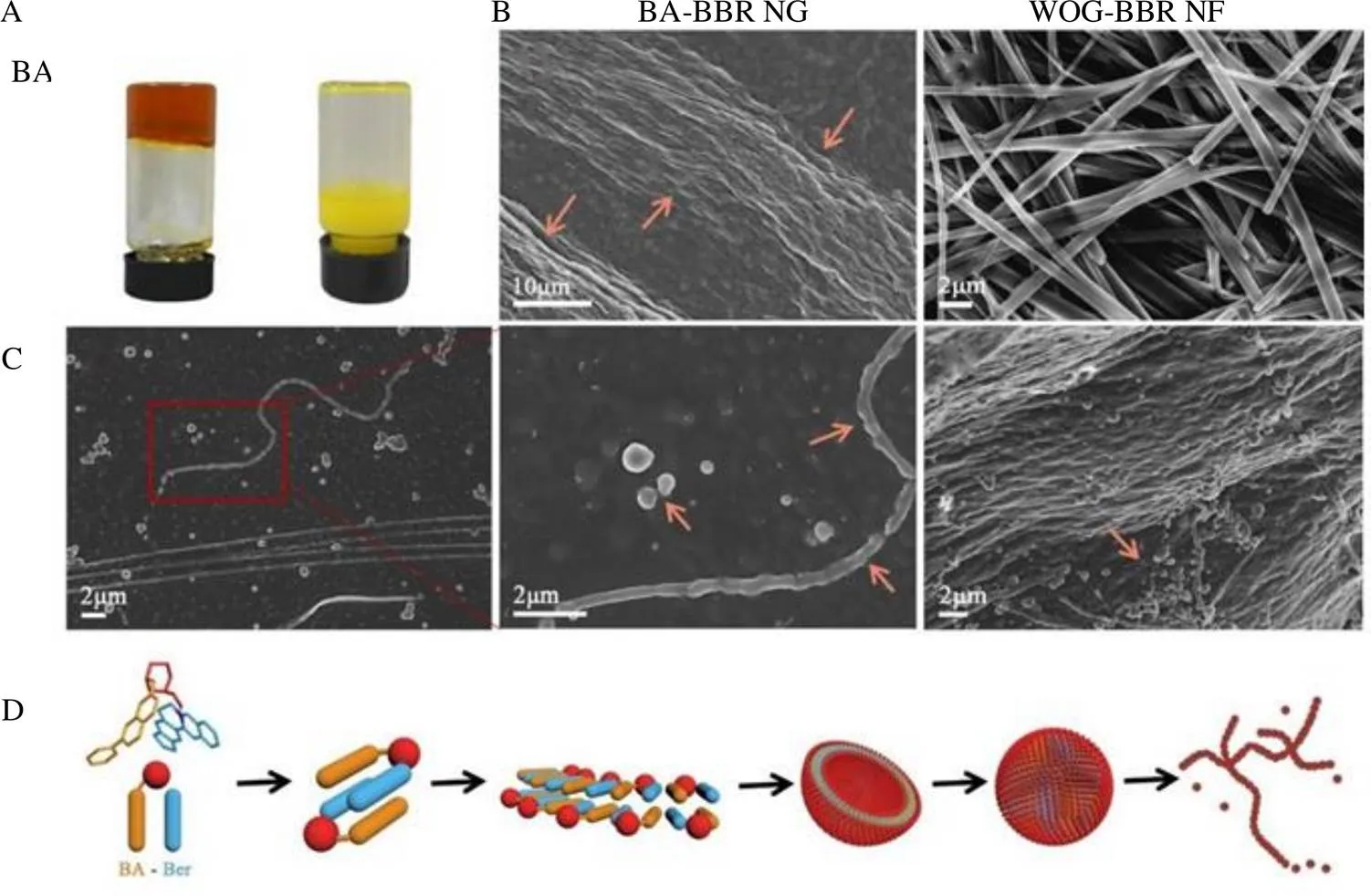
A-倒置试管图 B-FESEM图 C-BA-BBR NG在不同浓度下的自组装形态图 D-BA-BBR NG在不同浓度下的自组装机制图

A-ROESY谱图[16] B-BA-BBR NG和WOG-BBR NF超分子单元的空间构象和相关性 C-糖基团的构象;1)-A式 2)-N式

表1 最优构型总能值
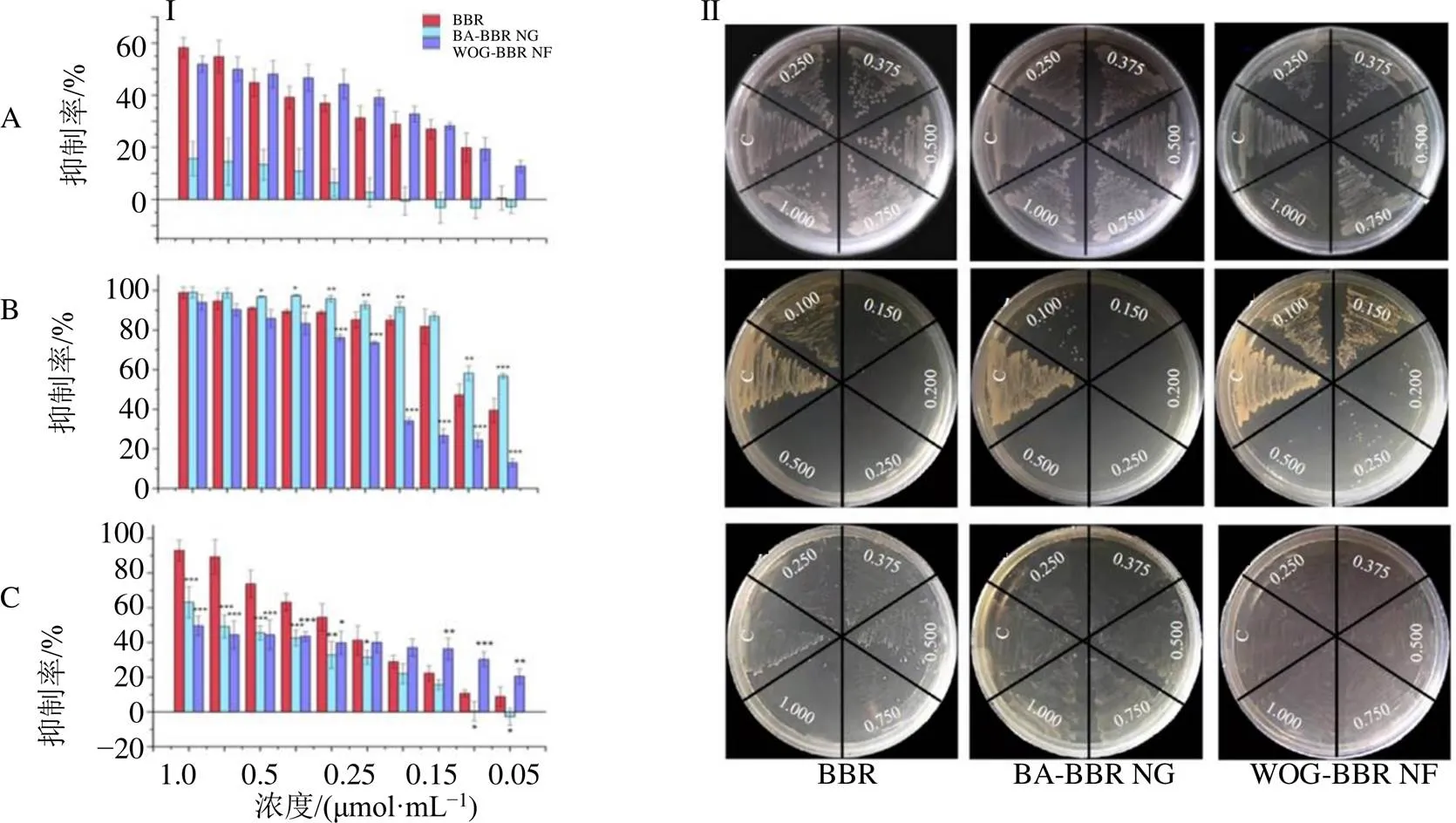
A-大肠杆菌 B-黄色葡萄球菌 C-屎肠球菌;与BBR组比较:*P<0.05 **P<0.01 ***P<0.001

图5 BA-BBR NG、WOG-BBR NF与S. aureus共培养2 h(A) 和6 h (B) 后(无需固定和脱水以防止自组装破坏)相互作用的SEM图以及抗菌机制(C)
3.2.4 超分子清除致病菌生物膜评价是临床上常见的易在医学植入材料上形成生物被膜的革兰阳性菌,这也是其产生耐药性的原因之一[19],故为从多方面更好地验证构象的不同对化合物活性的影响,利用FESEM及LSCM进一步观察了各样品对所形成生物膜的清除能力。首先,FESEM图像(图6-A、B)显示空白组的菌落分布密集,且菌体大小均匀、表面光滑,而经过各样品干预后的生物膜菌落密度均有所下降,其中BA-BBR NG组效果最为显著,菌量最少,菌体破坏严重,形态的变化也最为明显,且BBR和WOG- BBR NF对细菌形态的影响小于BA-BBR NG。与此同时,在LSCM的观察下,绿色荧光代表细胞膜完整的活菌;结果表明,空白组(图6-C)的金黄色葡萄球菌在硅片上大量附着,覆盖整个表面,形成厚重的生物膜;对于给药组而言,经BA-BBR NG干预后的生物膜亮度明显减弱,说明其密度显著降低,活菌数量大幅下降(图6-C);BBR也表现出稍弱于BA-BBR NG的生物膜清除能力(图6-C),相比之下,WOG-BBR NF给药组的生物膜清除效果不明显,活菌数量依旧较多,结果如图6-C-4所示,这与上述FESEM的分析结果相吻合,证实不同形态超分子的活性确实存在较大的差异。
4 讨论
BA和WOG分别与BBR形成的超分子无论是在物理性质、化学性质,还是在生物活性方面都有显著的差异,本研究表明导致超分子形态差异的原因除了2种黄酮苷类化合物取代基上的不同,还与BA-BBR NG和WOG-BBR NF中糖基构象的差异有关,正是基于这种结构和构象的不同,BBR会在弱键作用下形成不同的超分子形态,进而影响生物活性。目前诸多实验研究均发现天然产物来源小分子间会发生相互作用,这些中药药效成分主要通过氢键、π-π堆积、静电作用等弱键作用力自组装形成如水凝胶、纳米颗粒等超分子,同时具备有别于单体的分布、吸收、代谢等特性[20-24];如李文等[25]研究发现甘草蛋白与小檗碱共煎能形成类球形的超分子颗粒,同时还能增强小檗碱的抗菌活性;Huang等[26]研究报道小檗碱和肉桂酸也能通过氢键和π-π堆积自主装形成稳定、有序的类球形纳米颗粒,并具有良好的生物相容性和缓慢释药能力,纳米粒会黏附在细菌表面,使局部环境中药物浓度增大从而提高小檗碱的抗菌能力;此外,也有实验研究表明小檗碱和马兜铃酸共煎煮时,通过静电作用和π-π堆积自组装形成疏水基团在外、亲水基团在内的线性多相超分子而阻断马兜铃酸的毒性基团,从而降低马兜铃酸的急性肾毒性[27];但经文献调研发现,甚少有报道研究天然小分子构象的差异在超分子自组装中扮演的角色,故本研究从这一角度出发,初步探索了影响中药超分子形貌的因素之一;同时基于弱键化学探究了“化学结构-分子构象-超分子形态-生物活性”间的相关性,为更深层次研究传统中药配伍科学内涵提供依据。
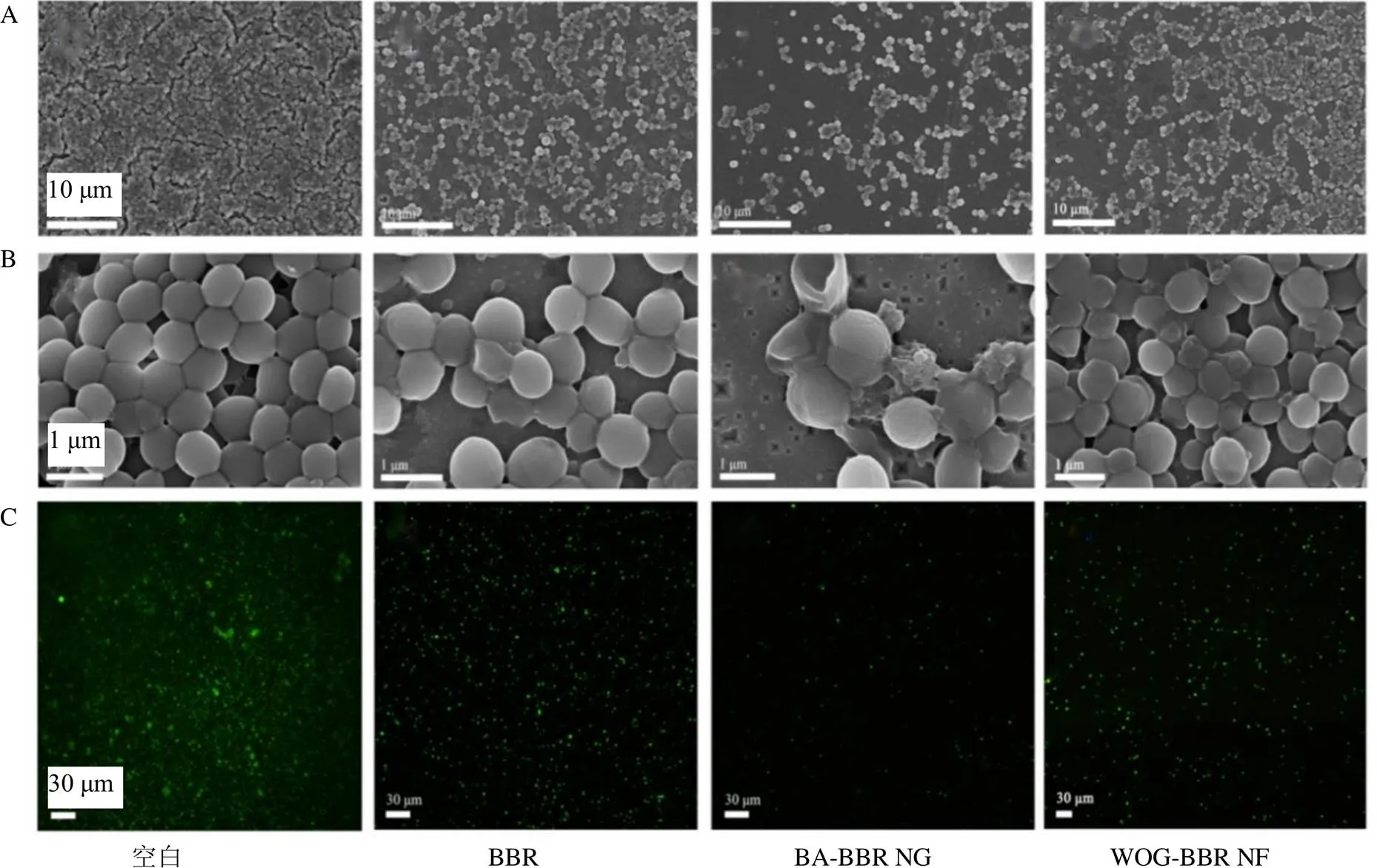
图6 不同样品生物膜的SEM图像(A, B) 和LSCM图(C)
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 478.
[2] 温华珍, 肖盛元, 王义明, 等. 黄芩化学成分及炮制学研究 [J]. 天然产物研究与开发, 2004, 16(6): 575-580.
[3] Zhao Q, Chen X Y, Martin C., the golden herb from the garden of Chinese medicinal plants [J]., 2016, 61(18): 1391-1398.
[4] Wang J, Wang L, Lou G H,.: A comprehensive review of its traditional uses, botany, phytochemistry, pharmacology and toxicology [J]., 2019, 57(1): 193-225.
[5] 张永欣, 朱童, 杨丹, 等. 黄连须根提取物生物碱类成分及抑菌活性研究[J]. 世界中医药, 2021, 16(17): 2556-2561.
[6] 雷艳丽, 孙磊, 隋宏, 等. 黄芩苷-小檗碱复合物的形成规律 [J]. 中成药, 2018, 40(3): 577-582.
[7] 房康, 吴高荣, 王辉, 等. 黄连解毒汤自沉淀化学成分及其抗PC12细胞损伤研究 [J]. 中草药, 2017, 48(18): 3714-3719.
[8] Yi L, Xu X. Study on the precipitation reaction between baicalin and berberine by HPLC [J]., 2004, 810(1): 165-168.
[9] 崔凯, 马洁洁. 构造、构型、构象三个概念的教学探讨 [J]. 广东化工, 2012, 39(6): 247, 178.
[10] Ren L, Liu Y X, Lv D,. Facile synthesis of the naturally cytotoxic triterpenoid saponin- glycoside B-II and its conformer [J]., 2013, 18(12): 15193-15206.
[11] 杨仕平, 黄继光, 徐汉虹, 等. 鱼藤酮的晶体结构及生物活性 [J]. 上海师范大学学报: 自然科学版, 2003, 32(3): 47-51.
[12] Galeotti F, Pisco M, Cusano A. Self-assembly on optical fibers: A powerful nanofabrication tool for next generation “lab-on-fiber” optrodes [J]., 2018, 10(48): 22673-22700.
[13] 高玉霞, 胡君, 巨勇. 基于天然小分子化合物的超分子自组装 [J]. 化学学报, 2016, 74(4): 312-329.
[14] Webber M J, Appel E A, Meijer E W,. Supramolecular biomaterials [J]., 2016, 15(1): 13-26.
[15] 陈瑞, 陈志鹏. 利用超分子组装理论探讨麻杏石甘汤抗病毒机制研究的新策略 [J]. 南京中医药大学学报, 2021, 37(1): 136-139.
[16] Li T, Wang P L, Guo W B,. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application [J]., 2019, 13(6): 6770-6781.
[17] 裴月湖, 娄红祥. 天然药物化学 [M]. 第7版. 北京: 人民卫生出版社, 2016: 57.
[18] Wang J R, Tanaka T, Zhang H,. Formation and conformation of baicalin-berberine and wogonoside- berberine complexes [J]., 2012, 60(6): 706-711.
[19] Liu J, Li W, Zhu X Y,. Surfactin effectively inhibitsadhesion and biofilm formation on surfaces [J]., 2019, 103(11): 4565-4574.
[20] 张小兵, 李敏. 基于横向分子间氢键的棒-线型分子自组装研究进展 [J]. 有机化学, 2009, 29(4): 528-535.
[21] Hu J, Wu Z S, Yan J J,. A promising approach for understanding the mechanism of Traditional Chinese Medicine by the aggregation morphology [J]., 2009, 123(2): 267-274.
[22] 杨玉琴, 李菲菲, 陈珊, 等. 基于甘草酸增溶原理探讨中药芫花与甘草配伍增毒机制 [J]. 药学学报, 2021, 56(9): 2561-2566.
[23] Zhi K K, Wang J C, Zhao H T,. Self-assembled small molecule natural product gel for drug delivery: A breakthrough in new application of small molecule natural products [J]., 2020, 10(5): 913-927.
[24] Tian X H, Wang P L, Li T,. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination [J]., 2020, 10(9): 1784-1795.
[25] 李文, 王志家, 刘小靖, 等. 基于弱键化学探究甘草-黄连药对水煎煮过程中甘草蛋白与黄连素相互作用机制 [J]. 药学学报, 2021, 56(8): 2119-2126.
[26] Huang X M, Wang P L, Li T,. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant[J]., 2020, 12(1): 227-237.
[27] Wang P L, Guo W B, Huang G R,. Berberine-based heterogeneous linear supramolecules neutralized the acute nephrotoxicity of aristolochic acid by the self-assembly strategy [J]., 2021, 13(28): 32729-32742.
Exploring scientific connotation of compatibility theory of traditional Chinese medicine based on “structure-conformation-morphology-activity” conduction relationship of berberine-flavonoid supramolecules induced by weak bonds
LIU Xiao-jing, LI Tong, YUAN Zhi-hua, PI Wen-min, GUO Wen-bo, WANG Zhi-jia, LEI Hai-min, WANG Peng-long
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100102, China
In this paper, two different supramolecules, baicalin-berberine (BA-BBR NG) and wogonoside-berberine (WOG-BBR NF), were studied on the basis of previous studies. The scientific connotation of the compatibility of traditional Chinese medicine “expelling the pathogenic factor without harming the healthy” was discussed from the correlation of “structure- conformation-morphology-activity” by weak bond chemistry.Based on the different conformations of two supramolecular glucuronic acid groups (A form and N form), combined with 2D-NMR analysis and minimum energy conformation research, Laser scanning confocal microscope (LSCM) and Field emission scanning electron microscope (FESEM) were used to characterize the supramolecular. The effect of the difference of structure and conformation on the supramolecular morphology was discussed from the difference between macroscopic and microscopic phenomena. At the same time, the difference of supramolecular activity was evaluated by microbroth dilution method, plate marking method, bacterial morphology observation and biofilm scavenging experiment.The morphology of BA-BBR NG varies with the concentration. When the concentration was greater than the gel concentration (> 10 mmol/L), it was observed that the spherical supramolecules gradually form “pearl chain” supramolecules, while WOG-BBR NF was a non-crosslinked rigid nanofiber at all concentrations. The optimal configurations of BA and WOG were N form and A form, respectively, but when they self-assembled with BBR by weak bonding force, the optimal configurations were reversed. In addition,antibacterial studies showed that the inhibitory effects of the two supramolecules on,andwere significantly different from those of berberine, and the supramolecular antibacterial activities were "selective".Compared with monomer components, this study revealed the uniqueness of supramolecular material base of traditional Chinese medicine compatibility. The different structure and conformation of monomer components would lead to the formation of different supramolecular morphology induced by weak bonds, and then affected the biological activity.
baicalin; wogonoside; berberine; conformation; activity; supramolecules; weak bond chemistry
R284
A
0253 - 2670(2022)22 - 7001 - 09
10.7501/j.issn.0253-2670.2022.22.003
2022-04-25
国家自然科学基金资助项目(82073974);国家自然科学基金资助项目(82274072);北京中医药大学重点攻关项目(2020-JYB-ZDGG-044);北京市自然科学基金面上项目(7202116);北京市科技新星计划(Z201100006820026);中华中医药学会青年人才托举工程项目(CACM-2018-QNRC2-B08);中央高校基金科研业务项目(2022-XJ-KYQD-008);中央高校基金科研业务项目(BUCM-2019-JCRC002);国家级高层次青年人才支持计划
刘小靖(1996—),女,硕士研究生。 Email: liuxiaojing1996@126.com
王鹏龙,男,教授,博士生导师,研究方向为基于弱键化学探究中药物质基础与复方配伍机制。Tel: (010)53912100 E-mail: wpl581@126.com
雷海民,男,研究员,研究方向为中药先导化合物发现与开发。Tel: (010)53912100 E-mail: hm_lei@126.com
[责任编辑 王文倩]

