立足基础,体现能力,注重创新
——以元素推断题为例
赖小海
(江西省新余市第四中学)
元素推断题是高考必考内容,试题往往以元素及其化合物的结构和性质为突破口进行元素推断,然后综合考查元素周期律、常见物质的性质、化学键等.试题题型主要为选择题,以中等难度为主.考查的核心素养以宏观辨识与微观探析为主.其主要的考点有:
1)比较气态氢化物的稳定性;
2)比较原子或离子半径的大小;
3)比较物质的熔、沸点高低;
4)比较元素的金属性或非金属性的强弱;
5)比较物质的氧化性或还原性的强弱;
6)比较最高价氧化物对应的水化物的酸性或碱性的强弱;
7)确定物质所含的化学键或化合物类型;
8)判断元素所形成的物质所具有的物理或化学性质;
9)物质的热重分析.
元素推断题一般以元素周期表和周期律为基础,对元素及其化合物的性质、结构进行综合推断和应用,立足基础,体现能力,同时注重试题的创新,常见的题型有以下几种.
1 以结构、性质、位置为切入点的元素推断题
描述式元素推断题主要是以元素及其化合物的一些特殊的性质、结构、位置为切入点进行元素推断,再根据元素周期表和周期律及元素化合物知识对物质的性质做出判断,侧重考查学生对知识的分析、应用能力.由此类试题命题切入点可以得到的启示是“构、位、性”三者都可以成为推断元素的突破口,它们相互依存,也都可以成为相互考查的条件或结论.常见的信息有:
1)短周期主族元素Z 的最高价氧化物对应的水化物是三元酸,则Z是P;
2)向短周期主族元素R 的盐溶液中滴加盐酸,先产生白色沉淀,后沉淀溶解,则R 是Al;
3)短周期主族元素X 的最外层电子数与次外层电子数相等,则X 为Be;
4)短周期主族元素X 的最外层电子数是次外层电子数的2倍,则X 为C;
5)短周期主族元素X 的最外层电子数是次外层电子数的3倍,则X 为O;
6)X 为地壳中含量最多的元素,则X 为O;
7)X 是形成化合物最多的元素,则X 为C;
8)W 是良好的半导体材料,可以用于计算机芯片或者太阳能电池,则W 为Si;
9)W 与X 可以形成原子个数之比为1∶1 和2∶1的2 种化合物,则W 与X 为H 和O 或者Na和O;
10)W 为二元液态化合物,则W 为H2O;
11)Y 的最外层电子数为次外层的一半,则Y 为Li或Si;
12)X 为地壳中含量最多的金属元素,则X为Al;
13)Q 的简单氢化物和其最高价含氧酸可以化合成盐,说明Q 为非金属元素,氢化物显碱性,则Q为N;
14)灼烧X 的单质时可以观察到黄色的火焰,则X 为Na;
15)A 是短周期主族元素中原子半径最大的元素,则A 为Na;
16)A 是果实的催熟剂、植物生长的调节剂,则A为C2H4;
17)A 是一种黏稠的油状液体,则A 为H2SO4;
18)A 是碱性气体,则A 为NH3;
19)A 可用于雕刻玻璃,则A 为HF;
20)A 元素最高价氧化物既可以与强酸反应,又可以与强碱反应,则A 为Al;
21)A 的产量是衡量一个国家石油工业发展水平的重要标志,则A 为C2H4;
22)A 的产量是衡量一个国家工业发展水平的重要标志,则A 为H2SO4;
23)A 是一种黄绿色的气体,则A 为Cl2;
24)A 是一种红棕色的气体,则A 为NO2;
25)A 是一种红棕色的固体,可作红色油漆的原料,则A 为Fe2O3;
26)A 可用于切割和焊接金属,则A 为C2H2;
27)A 是形成酸雨的主要气体之一,且常用于葡萄酒中,作抗氧化剂,则A 为SO2;
28)A 的单质通常可作制冷剂,则A 为N;
29)A 的氢化物通常可作制冷剂,则A 为N;
30)A 形成的固态氧化物可用于人工降雨,则A为CO2;
31)A 与B形成的淡黄色固体可用作漂白剂,也可用于制作防毒面具,则A、B为Na、O;
32)A 与B形成的单质发生反应,产生苍白色火焰,则A、B为H、Cl;
33)A 的一种核素可用于鉴定文物的年代,则A为C;
34)A 单质是应用最广泛、用量最大的金属材料,则A 为Fe;
35)A 与B 形成的化合物可用于刻制印刷电路板,则A、B为Fe、Cl;
36)A 元素是无机非金属材料的主角,则A 为Si;
37)A 与B形成的化合物用于制作光导纤维,则A、B为Si、O;
38)A、B、C3种短周期元素的最高价氧化物对应的水化物之间能两两反应,则A、B、C 为Na、Al、S(Cl).
例1(2022年全国甲卷)Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19.Q 与X、Y、Z位于不同周期,X、Y 相邻,Y 原子最外层电子数是Q 原子内层电子数的2倍.下列说法正确的是( ).
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y
解析Y 原子最外层电子数为Q 原子内层电子数的2倍,说明Q 最少有2层,根据题意可知3层不行,则Q 为第二周期元素,Y 的最外层电子数为4.Q、X、Y、Z 为原子序数依次增大的短周期主族元素,Q 与X、Y、Z不在同一周期,则X、Y、Z位于第三周期,故Y 为Si.又由于X、Y 相邻,则X 为Al.Q、X、Y、Z的最外层电子数之和为19,则Q、Z的最外层电子数之和为19-3-4=12,且主族元素的最外层电子数最多为7,若Q 的最外层电子数为7,为F 元素,则Z的最外层电子数为5,为P元素;若Q 的最外层电子数为6,为O 元素,则Z的最外层电子数为6,为S元素;若Q 的最外层电子数为5,为N 元素,Z的最外层电子数为7,为Cl元素.综上所述,Q 为N 或O 或F,X 为Al,Y 为Si,Z为Cl或S或P.据此分析各选项,X为Al,Q 为N 或O 或F,根据同一周期,从左到右元素的非金属性依次增强,同一主族,从上到下元素的非金属性依次减弱,故非金属性:Q>X,选项A 错误.X 为Al,属于金属晶体,Y 为Si,属于原子晶体,故单质熔点:Y>X,选项B错误.Q 为N 或O 或F,其简单氢化物为NH3或H2O 或HF,Z为Cl或S或P,其简单氢化物为HCl或H2S或PH3,由于前者物质中存在氢键,后者物质中不存在氢键,故沸点:Q>Z,选项C错误.元素的非金属性越强,最高价含氧酸的酸性越强,P、S、Cl的非金属性均强于Si,因此最高价含氧酸的酸性:Z>Y,选项D 正确,故答案为D.
2 以片段信息为切入点的元素推断题
片段式元素推断题主要是利用片段信息确定元素在周期表中的大概位置,再结合元素的其他性质进行元素推断,有时无法确定,还需要分情况讨论.
例2(2022年广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图1所示.戊的最高价氧化物对应的水化物为强酸.下列说法不正确的是( ).
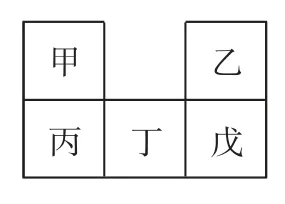
图1
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
解析甲~戊是短周期元素,根据元素在周期表中的相对位置可知:甲、乙位于第二周期,丙、丁、戊位于第三周期.戊的最高价氧化物对应的水化物为强酸,则戊可能是S或Cl.若戊为Cl,则甲为N、乙为F、丙为P、丁为S;若戊为S,则甲为C、乙为O、丙为Si、丁为P.根据同一周期,从左到右原子半径依次减小,同一主族,从上到下原子半径依次增大,则原子半径:丁>戊>乙,选项A 正确.根据同一周期,从左到右元素的非金属性逐渐增强,则非金属性:戊>丁>丙,选项B正确.甲的氢化物可能为氨气或甲烷、乙烷等,若是氨气,则遇氯化氢一定有白烟产生;若是甲烷、乙烷等,则遇氯化氢不反应,选项C 错误.丙的最高价氧化物对应的水化物可能是硅酸或磷酸,都一定能与强碱反应,选项D 正确,故答案为C.
3 以物质结构为切入点的元素推断题
结构式元素推断题主要是利用物质的结构确定大多数元素,再结合元素的性质推断其他元素.对于共价化合物,若元素的共价键数目小于或等于4,则主族元素的最外层电子数=8—共价键数目(配位键除外),若是H 元素,则最外层电子数=2—共价键数目;若元素的共价键数目大于4,则主族元素的最外层电子数=共价键数目.对于离子化合物,阴离子与共价化合物的推断原理基本相同,但要考虑得电子的数目,一般情况下,几价阳离子,则最外层就有几个电子.
例3(2022 年湖南卷)科学家合成了一种新的共价化合物(结构如图2所示),X、Y、Z、W 为原子序数依次增大的短周期元素,W 的原子序数等于X 与Y 的原子序数之和.下列说法错误的是( ).
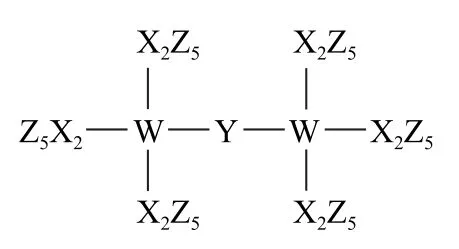
图2
A.原子半径:X>Y>Z
B.非金属性:Y>X>W
C.Z的单质具有较强的还原性
D.原子序数为82的元素与W 位于同一主族
解析由共价化合物的结构可知:X、W 形成4个共价键,Y 形成2 个共价键,Z 形成1 个共价键,所以X、W 最外层有4个电子,Y 最外层有6个电子,Z最外层有1个或7个电子.又由于X、Y、Z、W 是原子序数依次增大的短周期元素,W 的原子序数等于X 与Y 的原子序数之和,则X 为C、Y 为O、Z为F、W为Si.同一周期,从左到右原子半径依次减小,则原子半径大小为X>Y>Z,选项A 正确.同一周期,从左到右元素的非金属性依次增强,同一主族,从上到下元素的非金属性依次减弱,则X、Y、W 的非金属性强弱顺序为Y>X>W,选项B正确.氟是非金属性最强的元素,其单质具有很强的氧化性,选项C 错误.根据每一周期所容纳的元素的种类(2、8、8、18、18、32、32)可推测:原子序数为82的元素是铅,与硅都位于第ⅣA族,选项D 正确,故答案为C.
4 以框图信息为切入点的元素推断题
框图式元素推断题是以方框的形式标出物质之间发生的变化,依据物质之间的相互转化关系进行元素推断的试题.框图推断题的特点是结构紧凑、文字表述少、包含信息多、综合性强、思维能力要求高,具有很高的区分度和选拔功能.它既能考查学生对基础知识的掌握情况,又能考查学生灵活运用知识的能力,更能考查学生的逻辑推理能力,难度通常较大.框图题推断主要是利用物质之间的转化关系及物质的性质作为元素推断的切入点,再与元素周期表、元素周期律的应用有机融合.
例4(2016 年全国Ⅰ卷)短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH 为2,s通常是难溶于水的混合物.上述物质的转化关系如图3所示.下列说法正确的是( ).
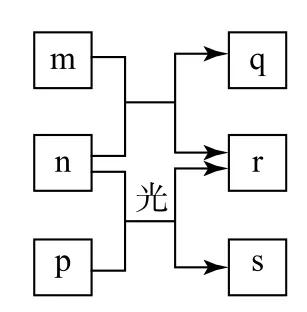
图3
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y 的氢化物常温常压下为液态
D.X 的最高价氧化物的水化物为强酸
解析n是元素Z的单质,通常为黄绿色气体,则n为Cl2,Z为Cl.m、p、r是由这些元素组成的二元化合物,且氯气与p 在光照条件下生成r与s.0.01mol·L-1r溶液的pH 为2,则r为一元强酸HCl,s通常是难溶于水的混合物,则p为CH4.氯气与m 反应生成HCl与q,q的水溶液具有漂白性,则m 为H2O,q为HClO.短周期元素W、X、Y、Z的原子序数依次增加,则W 为H,X 为C,Y 为O.所有元素中H 原子半径最小,同一周期,从左到右原子半径依次减小,故原子半径W(H)<Y(O)<X(C),选项A错误.氯的氧化物(如ClO2)中氧元素显负价,则氧元素的非金属性比氯的强;高氯酸为强酸,碳酸为弱酸,则氯元素的非金属性比碳的强,故非金属性Y(O)>Z(Cl)>X(C),选项B 错误.O 元素的氢化物为H2O或H2O2,常温下均为液态,选项C 正确.X 的最高价氧化物的水化物为碳酸,是弱酸,选项D 错误.故答案为C.
5 以图表信息为切入点的元素推断题
图表题在高考试题中出现的频率很高.图表是题干信息的重要载体,要求考生能提取图形、图表中相关信息,解答相关问题,对考生的读图能力要求较高,能很好地考查考生接受、吸收、整合化学信息的能力.解题时首先要读懂图像、图表信息,分清横、纵坐标所表示的物理量.对于隐藏于图表中的元素推断题,首先要运用图表信息,如原子半径、化合价、最外层电子数、金属性与非金属性的周期性变化、温度与质量分数的变化等作为切入点推断出所对应的元素,然后再判断选项的正误.
例5(2022 年全国乙卷)化合物(YW4X5Z8·4W2Z)可用于电讯器材、高级玻璃的制造.W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21.YZ2分子的总电子数为奇数,常温下为气体.该化合物的热重曲线如图4所示,在200 ℃以下热分解时无刺激性气体逸出.下列叙述正确的是( ).
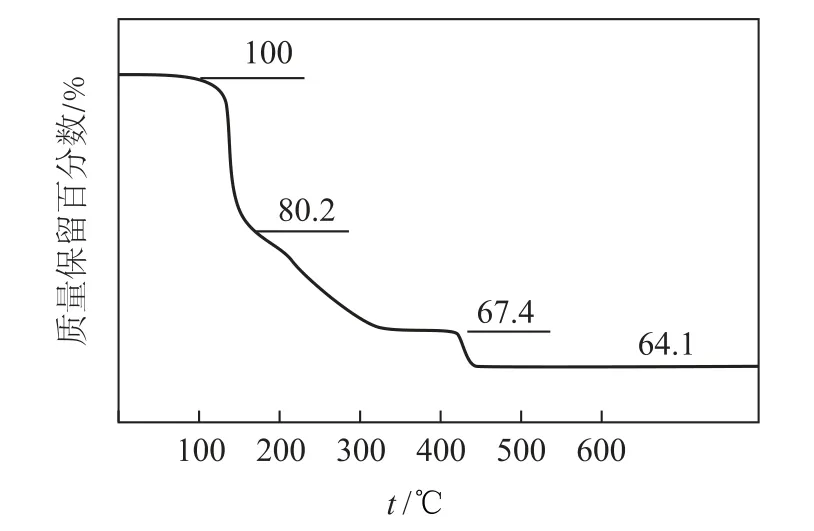
图4
A.W、X、Y、Z的单质常温下均为气体
B.最高价氧化物对应的水化物的酸性:Y<X
C.100~200 ℃阶段热分解失去4个W2Z
D.500 ℃热分解后生成固体化合物X2Z3
解析化合物(YW4X5Z8·4W2Z)在200 ℃以下热分解时无刺激性气体逸出,则说明失去的是水,即W 为H,Z 为O.YZ2常温下为气体,可能是CO2、NO2、SO2,但分子的总电子数为奇数,则Y 为N.W、X、Y、Z 为短周期元素,原子序数依次增加,且加和为21,则X 为B.X(B)的单质常温下为固体,选项A 错误.根据非金属性越强,其最高价氧化物的水化物酸性越强,则最高价氧化物的水化物酸性:X(H3BO3)<Y(HNO3),选项B错误.根据题干“200 ℃以下热分解时无刺激性气体逸出”,说明失去的是水,若100~200 ℃阶段热分解失去4个H2O,残留固体的质量分数为100%≈73.6%<80.2%,说明假设错误,应该是失去4个H2O 中的部分结晶水,选项C 错误.若化合物(NH4B5O8·4H2O)在500 ℃热分解后生成固体化合物X2Z3(B2O3),根据硼元素守恒,有关系式:2NH4B5O8·4H2O~5B2O3,则化合物B2O3的质量分数为64.1%,说明假设正确,选项D 正确.故答案为D.
例6(2021年天津卷)元素X、Y、Z、Q、R 的原子序数依次增大且小于20,其原子半径和最外层电子数之间的关系如图5所示.下列判断正确的是( ).
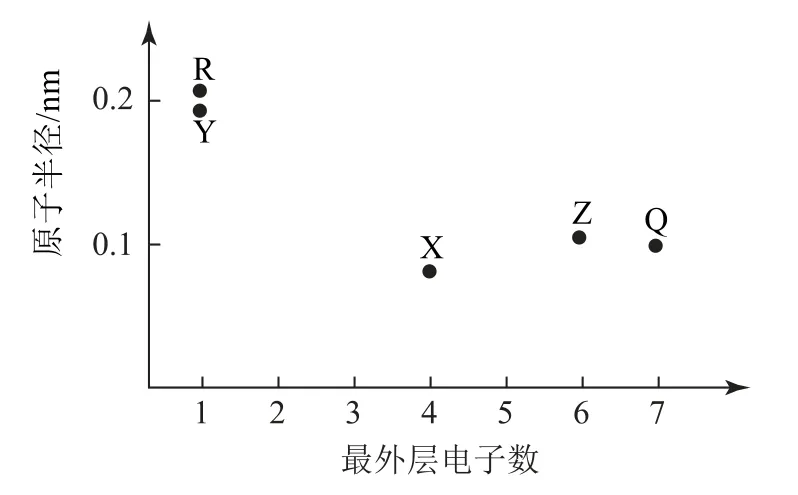
图5
A.X 的电负性比Q 的大
B.Q 的简单离子半径比R 的大
C.Z的简单气态氢化物的热稳定性比Q 的强
D.Y 的最高价氧化物对应的水化物的碱性比R的强
解析由图像可知:Y、R 位于第ⅠA 族,X 位于第ⅣA 族,Z位于第ⅥA 族,Q 位于第ⅦA 族.又由于X、Y、Z、Q、R 的原子序数依次增大且小于20,根据“最外层电子数和原子半径的关系”可知:X 为C、Y 为Na、Z为S、Q 为Cl、R 为K.X 的非金属性比Q的小,所以X 的电负性比Q 的小,选项A 错误.根据核外电子排布相同,核电荷数越大,离子半径越小,故Q 的简单离子(Cl-)半径比R(K+)的大,选项B 正确.同一周期,从左到右元素的非金属性依次增强,即非金属性Z(S)<Q(Cl),而元素的非金属性越强,则气态氢化物越稳定,故Z的简单气态氢化物的热稳定性比Q 的弱,选项C错误.同一主族,从上到下元素的金属性依次增强,则金属性Y(Na)<R(K),而元素的金属性越强,最高价氧化物对应水化物的碱性越强,则Y 的最高价氧化物对应的水化物的碱性比R 的弱,选项D 错误.故答案为B.
6 以核反应为切入点的元素推断题
核反应是指原子核与原子核,或者原子核与各种粒子(如质子、中子、光子、高能电子)之间相互作用引起的各种变化.在反应前后总质子数、电荷数、质量数、能量、动量都不变,所以与核反应相关的元素推断题主要是以核反应中的质子守恒和质量数守恒为切入点,同时利用元素其他性质进行推断.
例7(2020年新课标Ⅰ卷)1934年约里奥-居里夫妇在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素,开创了人造放射性核素的先河:.其中元素X、Y 的最外层电子数之和为8.下列叙述正确的是( ).
A.X的相对原子质量为26
B.X、Y 均可形成三氯化物
C.X 的原子半径小于Y 的
D.Y 仅有一种含氧酸
解析在原子轰击实验中,原子满足质子守恒和质量数守恒,故有关系W+4=30+1,则W=27.由题意可知,X 为金属元素,且Y 的质子数比X 大2,则X 与Y 位于同一周期,且Y 位于X 右侧.又因为元素X、Y 的最外层电子数之和为8,设X 最外层电子数为a,则Y 的最外层电子数为a+2,故有a+a+2=8,解得a=3,因此X 为Al,Y 为的质量数为27,则其相对原子质量为27,选项A 错误.Al元素可形成AlCl3,P元素可形成PCl3,选项B正确.Al与P原子位于同一周期,根据“同一周期,从左到右原子半径逐渐减小”,故原子半径Al>P,选项C错误.P的含氧酸有H3PO4、H3PO3、H3PO2、HPO3等,选项D错误.故答案为B.
总之,有关元素推断题的命题角度是多方面的,考生可以根据元素及物质的性质、物质结构、物质之间的转化关系、元素的位置、核反应、图表信息来推断.元素推断题可以打破模块之间的界定,体现高考试题中知识点间的综合性,考生在备考时,要重点掌握利用“位、构、性”关系综合考查元素及其化合物性质的相关内容.从近几年的高考题中可以发现,题干给出的已知条件,不再是单纯的原子结构特征,而是添加了元素化合物的结构和性质、图表、数据等信息,并以此为切入点进行元素推断,因此在平时的学习中要夯实基础知识,同时要注意知识的灵活运用.
(完)

