人参皂苷Rb3通过抗氧化应激对HT22细胞氧糖剥夺-复糖复氧损伤的保护作用
罗 苑,陈 普,段小花,李付惠,冯光泉,常 征,高明菊,詹云静,李建平,王朝勇
(1.文山学院三七医药学院,云南 文山 663099;2.云南中医药大学民族医药学院 云南省傣医药与彝医药重点实验室,云南 昆明 650500)
脑卒中(Cerebral stroke)又称中风,是一类由于脑血管中的血流和氧气含量改变所导致大脑损伤的疾病,已成为全球致残和致死的主要原因之一[1]。其中缺血性脑卒中(Ischemic stroke,IS)占所有卒中病例的近80%[2]。对于脑缺血性中风,尽早恢复脑组织的供血供氧是有效手段之一,在临床的一线治疗方法为静脉注射阿替普酶(tPA),由于治疗时间窗有限(脑卒中后4.5 h内使用),只有3.0%~8.5%的脑卒中患者能接受该治疗[3]。此外,溶栓再灌注的过程也会导致继发性损伤,产生严重的脑功能衰竭,临床称为脑缺血-再灌注损伤(Cerebral ischemia reperfusion injury,CIRI)[4]。而脑血流中断和再灌注会使脑细胞产生快速级联反应损伤,最终导致细胞凋亡或坏死[5]。因此溶栓药物使用受到严格控制,而有效的神经保护药物可以预防病理级联反应,提高溶栓治疗效果,是挽救缺血半暗带,治疗IS的关键。然而,神经保护药物在临床中并未得到预期的疗效,其原因包括研究药物的治疗靶点单一,且研究模型未设计缺血再灌注的病理进程[6]。因此,探索抗脑缺血再灌注损伤的神经保护药物是十分迫切和重要的。
中医药在治疗靶点方面具有突出优势,三七[Panaxnotoginseng(Burkill)F.H.Chen]为五加科人参属植物三七的干燥根和根茎,具有散瘀止血、消肿定痛的功效。《本草纲目》记载,三七茎叶“治折伤、跌扑出血,敷之即止,青肿经夜即散,余功同根”。现代研究发现,三七叶皂苷在血液系统、心血管系统、神经系统和代谢系统等方面的作用与三七皂苷相似[7]。其中人参皂苷Rb3(C53H90O22)是三七叶中特有的人参皂苷成分,在2015年版《中华人民共和国药典》第一部中规定三七叶总皂苷含量以人参皂苷Rb3计,不得少于10%。研究发现,人参皂苷Rb3对脑缺血和脑线粒体损伤具有保护作用[8-10]。文献记载和临床研究都提示,人参皂苷Rb3对于治疗CIRI可能具有一定优势。目前,人参皂苷Rb3对CIRI的研究主要局限于脑保护作用,且主要针对体内动物模型,其保护作用机制尚不明确。由于氧化应激是CIRI的基本病理机制,本试验通过小鼠海马神经元HT22细胞建立氧糖剥夺-复氧(Oxygen-glucose deprivation/reperfusion,OGD/R)体外脑缺血再灌注模型,研究人参皂苷Rb3对脑缺血神经细胞损伤的保护作用及机制,以期为开发三七茎叶新的应用途径,以及CIRI治疗机制和靶点提供试验依据。
1 材料与方法
1.1 材料
1.1.1 细胞 HT22细胞株(上海酶研生物科技有限公司,本实验室保存)来源于小鼠海马神经元细胞系,是常用的神经细胞株。
1.1.2 药品与试剂 人参皂苷Rb3(万佳标物河南标准物质研发中心,纯度≥99.86%);依达拉奉Edaravone(EDA,北京索莱宝科技有限公司);二甲基亚砜(DMSO)、连二亚硫酸钠(Na2S2O4)(上海麦克林生化科技有限公司);噻唑蓝(Methyl thiazoly tertrazolium,MTT)(上海索桥生物科技有限公司);杜氏改良培养基(Dulbecco's modified eagle medium,DMEM)、胎牛血清(Fetal bovine serum,FBS)、0.25%胰蛋白酶(上海逍鹏生物科技有限公司);RIPA裂解液强(P0013B)、乳酸脱氢酶(Lactate dehydrogenase,LDH)细胞毒性检测试剂盒(C0016)、活性氧(Reactive oxygen species,ROS)检测试剂盒(S0033S)、BCA蛋白浓度测定试剂盒(P0012)(上海碧云天生物技术有限公司);一氧化氮(Nitric oxide,NO)测定试剂盒(A012-1)、丙二醛(Malondialdehyde,MDA)测试盒(A003-1)、超氧化物歧化酶(Superoxide dismutase,SOD)测定试剂盒(A001-3)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)测试盒(A005-1)、小鼠细胞色素C(Cytochrome C,Cyt-C)酶联免疫检测试剂盒(H190-1-1)(南京建成生物工程研究所有限公司)。
1.1.3 主要仪器 倒置生物显微镜(徕卡仪器有限公司,DMi1);全波长扫描式多功能酶标仪(赛默飞世尔科技公司,Varioskan5250040);微孔板恒温振荡器(杭州米欧仪器有限公司,ST60-4)。
1.2 方法
1.2.1 细胞培养与分组 细胞培养选用DMEM高糖培养基加1%双抗和10%FBS,在37 ℃、5%CO2培养箱中孵育,换液传代至细胞数量、形态稳定,在细胞对数生长期使用0.25%胰酶进行消化,并用计数板计数,按9×104个/mL的浓度接种到96孔板、6孔板、75 cm2培养瓶中用于后续试验。将细胞随机分为6个组:对照组(Control group)、模型组(OGD/R group)、阳性组(EDA group)和Rb3组(Rb3 group)。
1.2.2 细胞OGD/R模型的建立 Na2S2O4是一种氧清除剂,可有效清除细胞培养基质中的氧,且不会损伤细胞膜。因此,本试验选用Na2S2O4来建立神经细胞OGD/R模型,模拟CIRI的病理过程。EDA是一种有效的自由基清除剂,分子量小,易于通过血脑屏障,并且研究证实其对脑缺血有一定的保护作用[11],因此本试验选用100 μmol/L EDA作为阳性对照。对照组细胞不做任何处理;模型组细胞用含10 mmol/L Na2S2O4合并无糖DMEM培养基进行氧糖剥夺培养2 h,继而恢复为无血清高糖DMEM培养2 h做复糖复氧处理,以建立体外OGD/R模型;阳性组和Rb3组从氧糖剥夺前24 h开始即加入相应终浓度的药物,一直持续到复糖复氧结束,随后用倒置生物显微镜观察各组细胞的形态变化。
1.2.3 MTT检测细胞存活率 首先,确定Rb3的安全浓度范围。用DMEM完全培养基将Rb3母液稀释成5、10、20、40、80、160、320、640 μmol/L和1 280 μmol/L,与细胞共孵育24 h,避光加入20 μL 5 mg/mL的MTT溶液,37 ℃培养箱孵育4 h,吸出上清,每孔分别加入150 μL DMSO,置于微孔板恒温振荡器振荡10 min,使用酶标仪于490 nm波长处测定各孔OD值以检测细胞存活率。选择合适浓度的Rb3(1.25、2.5、5、10、20 μmol/L和40 μmol/L)进行OGD/R试验,各组细胞在复糖复氧2 h后,用MTT法检测细胞存活率,最终确定Rb3的最佳浓度,并按此浓度进行后续试验。
1.2.4 LDH检测细胞死亡率 细胞接种条件、分组不变,使用96孔板操作。复糖复氧2 h后更换无血清培养基,200 μL/孔,按照LDH细胞毒性检测试剂盒说明书进行具体操作,检测细胞死亡率。
1.2.5 荧光探针DCFH-DA检测ROS 细胞接种条件、分组不变,使用6孔板操作。复糖复氧2 h后采用原位装载探针法检测ROS,按照ROS检测试剂盒说明书进行具体操作。
1.2.6 NO、MDA、SOD、GSH-Px的检测 细胞接种条件、分组不变,使用75 cm2培养瓶操作。复糖复氧2 h后,收集培养上清液,按照NO测定试剂盒说明书进行具体操作,测定NO释放水平。随后在培养瓶中加入0.25%胰蛋白酶消化3 min,用5 mL无血清培养基终止消化。收集细胞至15 mL离心管,3 000 r/min离心5 min,弃上清,加入200 μL裂解液(冰上裂解30 min),裂解完全后4 ℃、10 000 r/min离心10 min。吸出上清,使用BCA蛋白浓度测定试剂盒测定各组细胞蛋白浓度,根据相应试剂盒说明书进行具体操作,测定MDA、SOD、GSH-Px的含量。
1.2.7 Cyt-C的检测 细胞接种条件、分组不变,使用75 cm2培养瓶操作。取裂解后的细胞上清液,按照小鼠Cyt-C酶联免疫检测试剂盒说明书进行具体操作,检测细胞内Cyt-C含量。
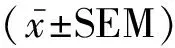
2 结果
2.1 HT22细胞形态学观察 对照组细胞形态完整呈三角形,有两极或多极突起,胞体较大,细胞膜完整光滑,并且连接成网络状;经OGD/R处理24 h后,模型组细胞数量明显减少,大部分细胞失去突起,呈圆形;但Rb3预处理可以明显改善这一情况,见图1。

图1 各组HT22细胞形态(400×)
2.2 Rb3对HT22细胞安全性的测定 以不同浓度的Rb3处理HT22细胞24 h,检测Rb3对细胞增殖活力的影响。与对照组相比,Rb3给药浓度在5~160 μmol/L时,细胞存活率会随着给药浓度的升高而增加,但差异无统计学意义(P>0.05);Rb3给药浓度达到320 μmol/L后,细胞存活率明显下降并产生毒性作用,且随着给药浓度的升高细胞存活率逐渐降低,差异极显著(P<0.01),见图2。
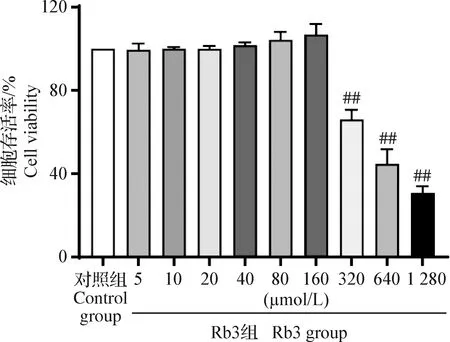
图2 Rb3对HT22细胞增殖活力的影响
2.3 Rb3对OGD/R损伤HT22细胞的细胞存活率和死亡率的影响 MTT结果显示,与对照组相比,模型组细胞存活率明显下降,达到半数致死,差异极显著(P<0.01);与模型组相比,Rb3组细胞存活率增加,当Rb3给药浓度在2.5~10 μmol/L时细胞存活率的增长呈现剂量依赖性,在20~40 μmol/L时细胞存活率逐渐下降,得出Rb3最佳有效浓度为2.5、5 μmol/L和10 μmol/L,并以这些浓度进行后续试验。LDH释放是检测细胞膜完整性的重要指标,被广泛应用于细胞死亡率检测。LDH检测结果显示,与模型组相比,Rb3 10 μmol/L给药及阳性药EDA明显抑制了LDH释放量,使细胞的死亡率降低(P<0.05或P<0.01);而Rb3 2.5 μmol/L和5 μmol/L给药细胞死亡率有降低趋势,但差异不具有统计学意义(P>0.05),见图3。
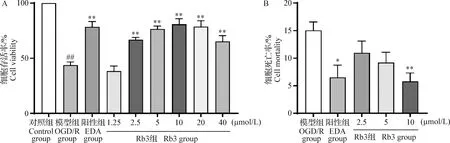
图3 Rb3对OGD/R损伤HT22细胞的细胞存活率(A)和死亡率(B)的影响
2.4 Rb3对OGD/R损伤HT22细胞的氧化水平的影响 结果显示,与对照组相比,模型组NO、ROS和MDA的含量明显升高,差异极显著(P<0.01);与模型组相比,Rb3以及阳性药物EDA能明显降低NO、ROS和MDA的含量,且Rb3作用呈现剂量依赖性,Rb3 10 μmol/L给药时差异极显著(P<0.01),见图4。
图4 Rb3对OGD/R损伤HT22细胞的NO释放水平(A)、ROS荧光水平(B)和MDA含量(C)的影响
2.5 Rb3对OGD/R损伤HT22细胞抗氧化水平的影响 结果显示,与对照组相比,模型组SOD、GSH-Px的含量明显受到抑制,差异极显著(P<0.01);与模型组相比,阳性组能极显著提高细胞中SOD的含量(P<0.01),显著提高细胞中GSH-Px的含量(P<0.05);与模型组相比,Rb3 5 μmol/L组和10 μmol/L组的SOD含量明显升高,差异极显著(P<0.01),Rb3 2.5 μmol/L组的SOD含量有升高趋势,但差异不具有统计学意义(P>0.05),同时,Rb3组GSH-Px的含量明显升高,并呈剂量依赖性,差异极显著(P<0.01),见图5。
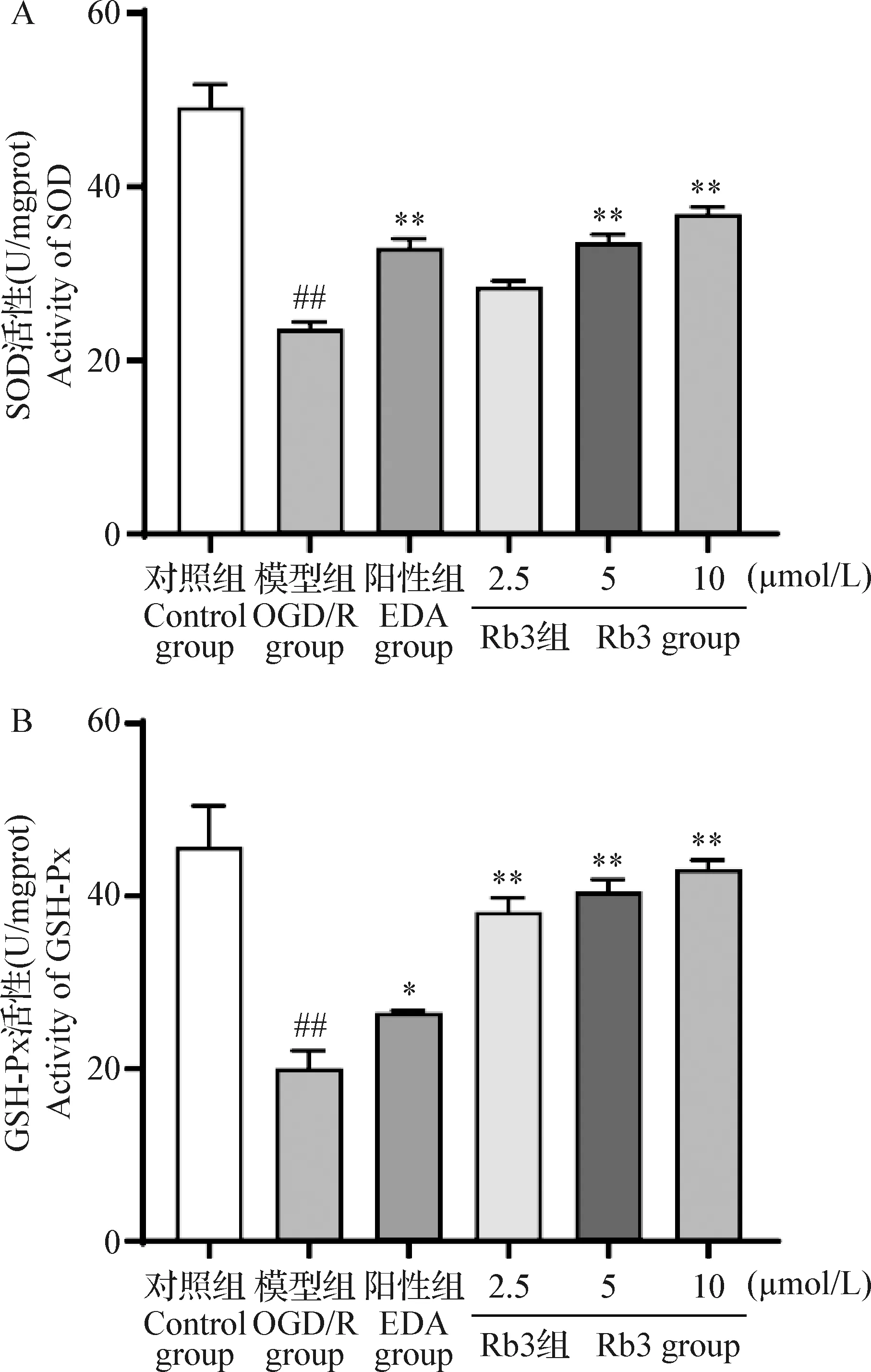
图5 Rb3对OGD/R损伤HT22细胞抗氧化酶SOD(A)和GSH-Px(B)水平的影响
2.6 Rb3对OGD/R损伤HT22细胞凋亡关键蛋白Cyt-C浓度水平的影响 结果显示,与对照组相比,模型组Cyt-C的含量明显升高,差异极显著(P<0.01);与模型组相比,Rb3组和阳性组均能显著抑制细胞中Cyt-C的释放,差异极显著(P<0.01),且Rb3 5 μmol/L效果最佳,见图6。
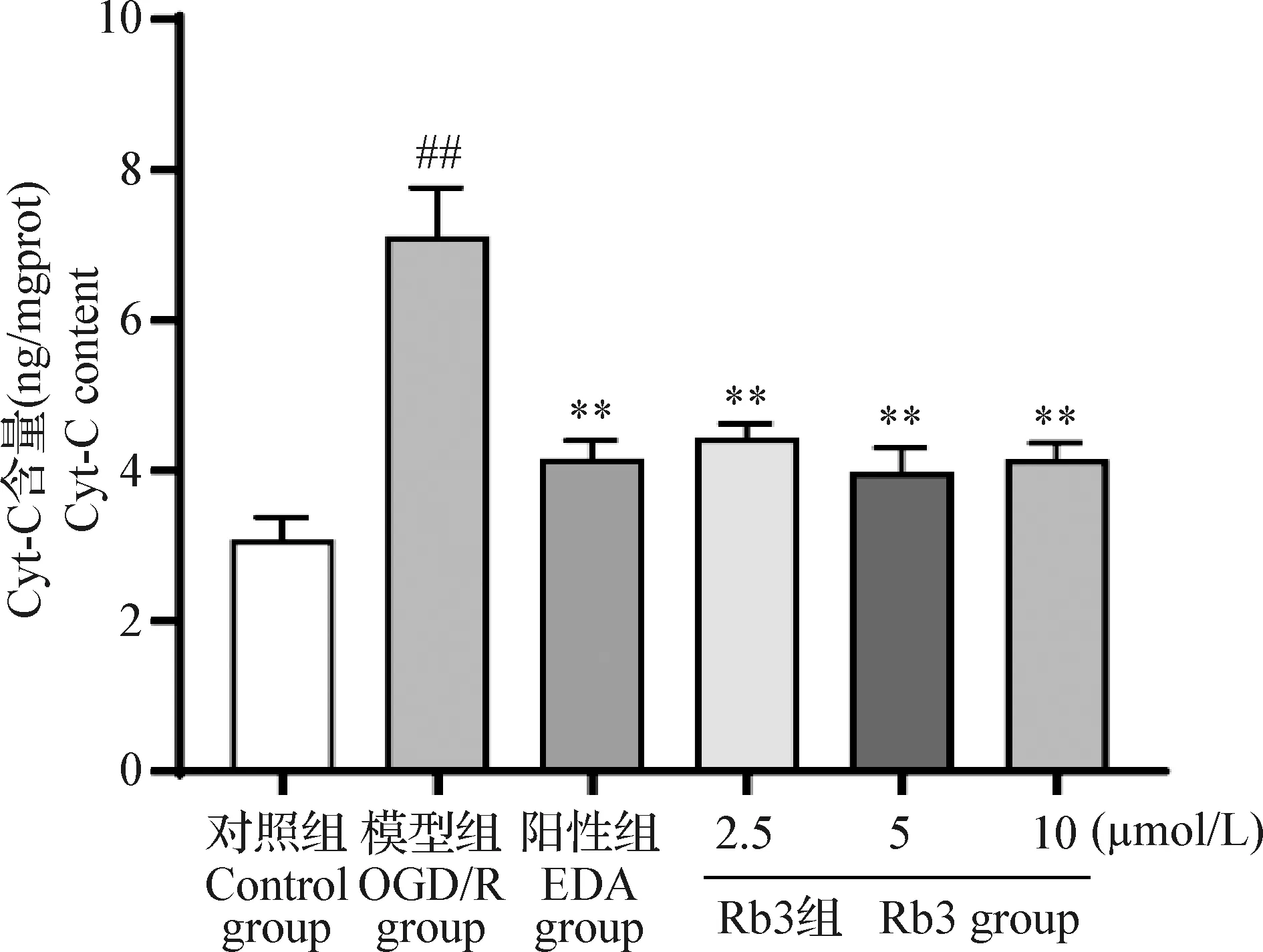
图6 Rb3对OGD/R损伤HT22细胞凋亡关键蛋白Cyt-C浓度的影响
3 讨论
脑缺血和再灌注引起的线粒体损伤导致ROS大量的爆发,机体对于超氧化物清除能力降低以及超氧化物积累的增加[12],引起脂质过氧化作用,这是缺血性脑卒中的病理级联反应中的重要环节之一[13]。由于海马椎体神经元HT22是海马区的主要成分,对缺血缺氧最敏感,是临床上神经系统疾病最易受累的部位[14]。在试验研究中HT22常用于探讨抗CIRI及抗调亡的神经保护机制[15]。因此,本试验从氧化应激这一病理环节出发,采用HT22建立体外模型,模拟机体缺血-再灌注损伤的过程。
本试验结果显示,在光学显微镜下观察到OGD/R可导致HT22细胞出现皱缩、聚集现象,胞质凝缩为圆形,细胞突触消失;而对照组细胞呈梭形且相互连接成网络,与之前的报道一致[16];但Rb3预处理可以减轻OGD/R诱导的神经细胞的病理改变,增加细胞活力并减少细胞死亡率,起到神经保护作用,且作用效果呈浓度依赖性。目前研究发现,再灌注期间所带入的氧生成了大量的ROS,由于细胞不能及时清除,导致了ROS攻击生物膜产生脂质过氧化物MDA,从而引起细胞毒性反应[12]。此外,再灌注后ROS也可促进诱导型一氧化氮合酶生成,由此产生的NO在ROS的催化作用下生成过氧亚硝酸盐(ONOO-),也会导致脂质过氧化,进一步诱导细胞凋亡从而加重再灌注损伤[17]。因此,检测ROS和NO可以反映细胞氧化应激的程度和神经细胞损伤程度。但GSH-Px与SOD同是生物体内主要的抗氧化酶,具有极强的还原作用,负责清除过氧化物,调节氧化平衡,可发挥抗CIRI作用[18]。
综上所述,本试验结果显示,Rb3组均能抑制OGD/R模型中ROS、NO水平的释放,并且通过调节提高细胞的抗氧化酶SOD、GSH活性以及减少氧化产物MDA的含量水平,减少自由基的产生,阻止进一步的细胞死亡,从而抵抗氧化应激造成的细胞损伤,发挥保护作用。
细胞凋亡是I/R脑损伤的最终和主要决定因素,抑制细胞凋亡是缺血性脑卒中治疗的关键步骤[19]。近年来,人参皂苷Rb3对缺氧缺血性损伤的神经保护作用已得到证实[20-21]。Zhu等[16]报道人参皂苷Rb3通过抑制细胞内Ca2+升高、细胞Caspase活性和凋亡,对OGD诱导的PC12细胞缺血损伤有明显的保护作用。Jiang等[22]研究发现,人参皂苷Rb3通过抑制NMDA和AMPA受体,可有效减少OGD期间细胞内Ca2+浓度的升高,起到抗凋亡的作用。而在激活细胞凋亡的途径中,目前研究显示,线粒体Cyt-C作为内源性途径,在凋亡过程中发挥主要作用[23]。脑缺血再灌注后线粒体内Ca2+水平的增加会触发ROS的过度产生,并传递凋亡信号,使Cyt-C等促凋亡蛋白从线粒体释放到细胞质,然后Cyt-C与凋亡蛋白酶活化因子-1(Apaf-1)结合,进一步激活效应因子Caspase-3,诱发凋亡的发生,最终致神经元死亡[24]。而本试验结果显示,Rb3可以明显抑制Cyt-C的释放。综上,Rb3能够对抗OGD/R诱导的缺血再灌注损伤,可能通过增加抗氧化酶活性和减少氧化产物来减轻氧化应激损伤,并且抑制Cyt-C的释放以减少内源性凋亡,从而提高细胞存活率,共同发挥神经保护作用。本试验结果提示人参皂苷Rb3对治疗CIRI有良好的前景,但具体机制有待进一步探究,其机制可能与抗氧化应激有关。

