稳定表达Cas9蛋白的BHK-21单克隆细胞系的建立与鉴定
葛丽娟,权 冉,陈俊贞,袁圆圆,付 强,李泽宇,史慧君
(新疆农业大学动物医学学院,新疆 乌鲁木齐 830052)
成簇规律间隔短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)最早由Ishino等于1987年在大肠杆菌中发现[1]。CRISPR是存在于细菌和古细菌细胞中抵御外源DNA侵入的适应性免疫反应系统[2]。这些生物基因组中的CRISPR位点可以表达与入侵病毒的基因组序列匹配的小分子RNA。当微生物感染了这些病毒中的一种时,CRISPR RNA能够通过互补序列与病毒基因组结合并表达CRISPR相关酶(Cas酶)[3]。这类核酸酶切割病毒DNA以防止其功能完成,而由CRISPR序列组成的CRISPR/CAS系统是细菌中重要的获得性免疫系统[4]。
目前,在自然界中发现的CRISPR/CAS系统分为三类:Ⅰ类、Ⅱ类和Ⅲ类[5-6],CRISPR/Cas9系统属于II类,其利用与靶序列互补的向导RNA来引导Cas9酶用于DNA的定点切割,能够对哺乳动物细胞基因组进行精准修饰,被广泛用于功能基因的筛选[7]。近年来,CRISPR/Cas9基因编辑技术发展迅速,在药物研发、基因功能、基因治疗以及病毒宿主相互作用的关键分子筛选等方面取得了重大进展[8-12],已经被广泛地应用到动物领域。多个研究团队通过CRISPR/Cas9敲除文库(Genome CRISPR knockout libraries,GeCKO)进行大规模的遗传筛选,如参与人类免疫缺陷病毒复制阶段的宿主蛋白[13],利用功能性缺失型策略筛选获得影响猪乙型脑炎病毒感染的功能基因[14]。筛选研究的第1步是构建慢病毒载体,用慢病毒包装sgRNA文库,并以较低的病毒感染复数转导至表达Cas9的细胞系,从而构建全基因组敲除细胞文库[15]。因此,构建稳定表达Cas9的细胞系是建立基于CRISPR/Cas9技术的基因敲除细胞文库必不可少的。本研究利用慢病毒转导系统构建了稳定表达Cas9蛋白的BHK-21-Cas9单克隆细胞系,可用于转导CRISPR/Cas9敲除文库,建立基因敲除细胞文库,为筛选影响病毒感染和复制的功能基因提供研究依据。
1 材料与方法
1.1 质粒和细胞 pSPAX2(12260)、pMD2.G(12259)、pLenti-GFP(17448)、lentiCas9-Blast(52962)和lentiGuide-Puro(52963)质粒,均购自北京中原有限公司。人胚肾细胞(HEK-293T)和乳仓鼠肾细胞(BHK-21),均购自中国科学院典型培养物保藏委员会细胞库,置于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养,生长培养基为高糖DMEM添加10%胎牛血清。
1.2 试剂和仪器 聚凝胺(Polybrene,TR-1003),购自上海西格玛奥德里奇贸易有限公司;聚乙烯亚胺(Polyethylenimine,PEI)(49553-93-7),购自美国Polysciences公司;PBS(10010023)和0.25% Trypsin-EDTA(25200056),均购自美国英杰生命技术有限公司;BCA蛋白浓度试剂盒(P0010S)、Western及IP细胞裂解液(P0013)和BeyoECL Moon化学发光试剂盒(P0018FS),均购自上海碧云天生物技术有限公司;BsmB I-v2(#E1602),购自纽英伦生物技术(北京)有限公司;Blasticidin-S(B139600),购自上海阿拉丁生化科技股份有限公司;高糖DMEM(06-1055-57-1)和胎牛血清(04-001-1),均购自以色列Biological Industries(BioInd)公司;Stbl3感受态细胞,购自福因德科技(武汉)有限公司;重组Anti-CRISPR-Cas9抗体(ab189380),购自艾博抗(上海)贸易有限公司;HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)抗体和GAPDH Antibody 10494-1-AP抗体,均购自艾克索生物科技股份有限公司。低温高速离心机、二氧化碳细胞培养箱、移液器,均购自德国艾本德股份公司;倒置荧光显微镜(Nikon TE2000U),购自尼康映像仪器销售(中国)有限公司;NanoDrop 2000C超微量分光光度计,购自赛默飞世尔科技公司;YJ-875医用净化工作台,购自苏州净化设备公司。
1.3 BHK-21-Cas9单克隆细胞系的构建及鉴定
1.3.1 慢病毒的制备 取对数生长期的HEK-293T细胞接种于直径为100 mm培养皿培养,于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养,细胞密度达到80%~90%时,将质粒lentiCas9-Blast以及对照质粒pLenti-GFP分别与辅助质粒pSPAX2、pMD2.G按质量2∶2∶1的比例共转染至HEK-293T中,加入质粒总质量5倍的PEI(浓度为1 mg/mL)促进转染,置于培养箱中培养3 h后更换为含10% FBS的高糖DMEM培养液,继续培养48 h后收集上清液,用0.45 μm微孔滤膜过滤,获得表达Cas9蛋白的慢病毒(试验组)以及表达GFP绿色荧光蛋白的慢病毒(对照组),置于-80 ℃保存备用。利用对照组pLenti-GFP在显微镜下观察的绿色荧光表达情况,估算试验组慢病毒的包装效率。
1.3.2 慢病毒感染及阳性细胞初筛 取对数生长期的BHK-21细胞接种于直径为60 mm培养皿,按照慢病毒原液∶完全培养基=1∶1的比例悬浮感染细胞,加入终浓度为8 μg/mL的聚凝胺溶液,轻轻混匀。培养24 h后更换为正常培养液,继续培养48 h后使用25 μg/mL的Blasticidin S进行药物压力筛选,连续筛选数天后待野生型BHK-21细胞全部死亡时,将试验组细胞培养液更换为加入了低浓度抗生素(初始浓度的1/3)的含10% FBS的高糖DMEM培养液继续培养,直至细胞不再死亡且生长状态良好。
1.3.3 有限稀释法培养单克隆细胞 将长满单层的细胞消化成单个悬浮状态后,使用血细胞计数板计数,调整细胞密度为8~10个/mL,接种于96孔板,每孔加100 μL含15% FBS的高糖DMEM培养液,接种时不断吹打混匀细胞悬液,避免细胞沉淀而造成接种不匀。待细胞贴壁,观察并标记单细胞孔。待单细胞孔中形成细胞集落,消化为单个悬浮细胞后转移至48孔板中扩大培养。
1.3.4 细胞系的Western blot鉴定 稳定表达Cas9蛋白的多克隆细胞系和单克隆细胞系通过Western blot方法检测Cas9蛋白的表达进行鉴定。将细胞培养基尽量吸弃干净,用预冷的PBS清洗2遍,弃去PBS后用含1 mmol/L PMSF的蛋白裂解液裂解细胞,冰上裂解后4 ℃ 12 000 r/min离心10 min,提取上清总蛋白;根据BCA法测定总蛋白浓度,取50 μg总蛋白加入蛋白上样缓冲液,置于金属浴100 ℃ 5 min使蛋白变性;经SDS-PAGE电泳分离后转移至PVDF膜;5%脱脂奶粉室温封闭1 h;分别以Anti-CRISPR-Cas9抗体(1∶2 000稀释)和GAPDH Antibody 10494-1-AP抗体(1∶5 000稀释)为一抗,4 ℃摇床孵育过夜;TBST清洗后使用HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)抗体(1∶5 000稀释)为二抗室温孵育1 h;TBST清洗后用ECL全自动化学发光成像分析系统检测目的蛋白的表达。
1.4 BHK-21-Cas9单克隆细胞系的Cas9核酸酶功能鉴定
1.4.1 gRNA的设计与合成 根据紧密连接蛋白(Occludin,OCLN)的基因序列,利用在线向导RNA(Short guide RNA,sgRNA)设计网站设计针对OCLN基因的sgRNA:上游5′-CACCGAGGATCCGAATCACTCCCGG-3′,下游5′-AAACCCGGGAGTGATTCGGATCCTC-3′。将合成好的gRNA经过磷酸化、退火后形成双链DNA。
1.4.2 载体构建 将lentiGuide-Puro空质粒载体用限制性内切酶BsmB I酶切后进行琼脂糖凝胶电泳,回收酶切产物。通过T4连接酶将退火磷酸化后的gRNA产物与酶切回收产物连接,4 ℃过夜后得到连接产物。通过热击法将连接产物加入Stbl3感受态细胞中进行转化,将加入连接产物的感受态细胞均匀混入不含抗生素的LB培养基中,37 ℃、200 r/min摇菌1 h后,1 000 r/min离心2 min,弃上清,保留100 μL培养基,轻柔混匀后涂布于含氨苄青霉素抗性的平板中筛选。16 h后挑取单克隆至含氨苄青霉素抗性的200 μL液体培养基中,37 ℃、200 r/min摇菌1.5 h后,进行PCR鉴定,鉴定正确的菌种摇菌16 h后,取700 μL用于进一步测序鉴定,其余菌液提取质粒后冻存。
1.4.3 重组慢病毒的包装 利用PEI转染试剂将重组慢病毒质粒lentiGuide-Puro-OCLN sgRNA 与辅助质粒pSPAX2和pMD2.G共转染至HEK-293T中,操作方法同1.3.1,将收集的慢病毒原液悬浮感染部分稳定表达Cas9的BHK-21单克隆细胞,操作方法同1.3.2。感染48 h后,使用Puromycin(终浓度为4 μg/mL)进行抗性筛选3 d。
1.4.4 BHK-21-Cas9单克隆细胞系的Cas9核酸酶功能鉴定 抗性筛选后继续培养,待细胞融合度达到90%后,取部分细胞提取蛋白,使用Western blot检测OCLN蛋白敲除情况,以未感染lentiGuide-Puro-OCLN sgRNA慢病毒为对照,操作方法同1.3.4。OCLN蛋白表达量越低,表明Cas9活性越好。
2 结果
2.1 BHK-21-Cas9单克隆细胞系的构建及鉴定
2.1.1 构建BHK-21-Cas9多克隆细胞系 质粒lentiCas9-Blast以及对照质粒pLenti-GFP分别与辅助质粒转染HEK-293T细胞48 h后,对照质粒pLenti-GFP细胞内出现明显的绿色荧光(图1A~1C)。慢病毒感染BHK-21细胞48 h后,对照质粒pLenti-GFP细胞内出现明显的绿色荧光(图1D~1F)。通过pLenti-GFP慢病毒作为荧光阳性对照,荧光细胞密度达90%以上,表明慢病毒感染性较好。
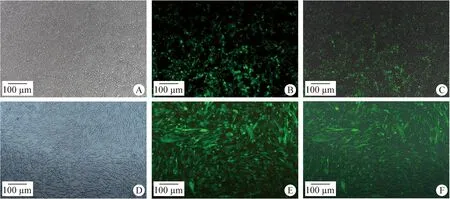
图1 pLenti-GFP质粒转染HEK-293T细胞及感染BHK-21细胞
2.1.2 细胞系的Western blot鉴定 经Western blot鉴定Cas9蛋白表达,阳性细胞传至5代后,再次鉴定Cas9蛋白的表达。结果显示,BHK-21-Cas9细胞系在184 kDa出现目的条带,表明Cas9蛋白在BHK-21细胞中稳定表达(图2)。将上述阳性细胞经有限稀释的方法得到18株状态良好的单克隆细胞系(编号1~18)和野生型BHK-21细胞,进行3次Western blot重复鉴定,使用Image J软件进行条带灰度值分析,结果显示,17株单克隆细胞表达Cas9蛋白,其中编号1、2、15、16、18五株细胞系Cas9的表达量高(图3、图4)。
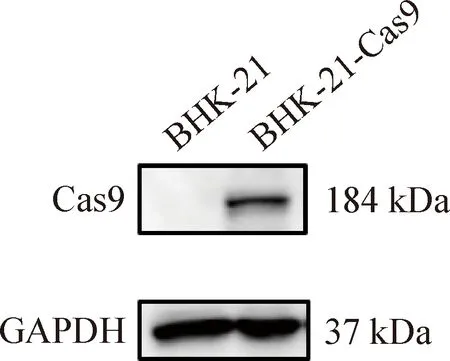
图2 BHK-21-Cas9阳性细胞的Western blot鉴定
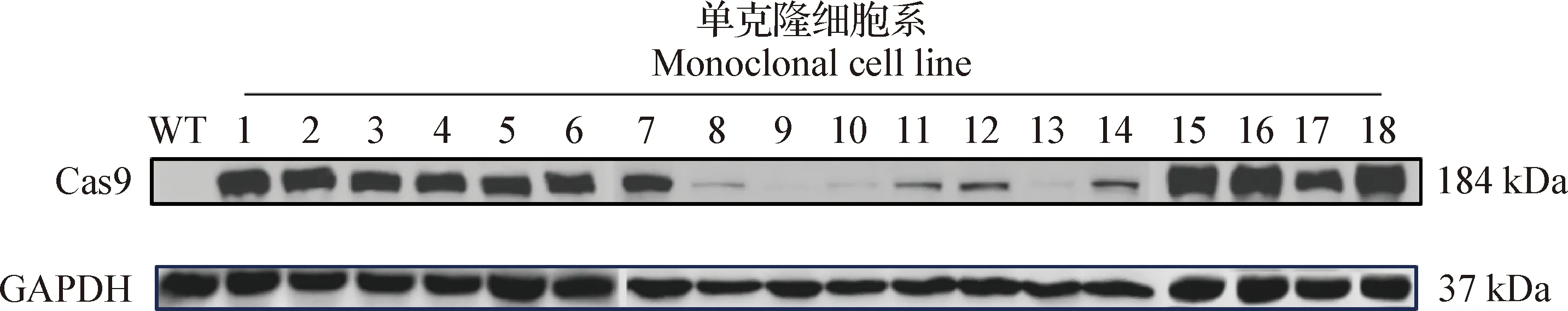
图3 BHK-21-Cas9单克隆细胞系的Western blot鉴定
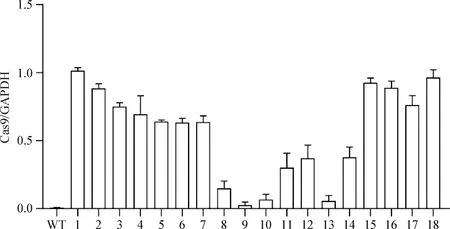
图4 Western blot条带灰度分析
2.2 BHK-21-Cas9单克隆细胞系的Cas9核酸酶功能鉴定
2.2.1 重组慢病毒质粒的构建 将引物连接至用BsmB I酶切后的lentiGuide-Puro空质粒载体,使用Snapgene构建的图谱见图5。
图5 LentiGuide-Puro-OCLN图谱
2.2.2 BHK-21-Cas9单克隆细胞系的Cas9核酸酶功能鉴定 选取了4株2.1.2中鉴定的Cas9表达量较高的BHK-21单克隆细胞系进行Cas9核酸酶编辑功能鉴定,进行3次重复试验,结果显示,编号15和16两株BHK-21-Cas9单克隆细胞系的Cas9编辑效果较好(图6)。
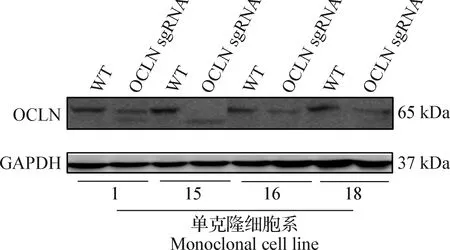
图6 BHK-21-Cas9单克隆细胞系的Cas9核酸酶功能鉴定
3 讨论
如何防治病毒感染和传播是近些年来一直被关注的热点问题。病毒以单链或双链螺旋形式,以RNA或DNA的形式携带其遗传信息。病毒作为一种严格的细胞内寄生微生物,依靠宿主细胞代谢系统完成其生命周期[16]。为了成功传播,病毒必须借助宿主细胞中特定的蛋白质来实现,病毒复制和传播的核心是病毒—宿主蛋白相互作用的形成[17]。大量研究证实,可以通过改变与病毒存活密切相关的宿主蛋白的表达水平,进而来实现调节病毒复制的目的[18]。因此,寻找与病毒复制相关的功能基因并揭示其作用机制将有助于阐明病毒的感染机制。
近年来,开发了几种新的基因组编辑技术。其中,锌指核酸酶(Zincfinger nucleases,ZFNs)、转录激活因子样效应物核酸酶(Transcription activator-like effector nucleases,TALENs)和CRISPR/Cas9 RNA引导的核酸内切酶系统是使用最为广泛的。每种技术都使用限制性内切酶在同源结合蛋白或RNA的指导下在靶点引入DNA双链断裂。ZFNs和TALENs需要对每个新靶位点使用大DNA片段(500~1 500 bp)重新编码蛋白质,而CRISPR/Cas9可以通过改变20 bp原型间隔区轻松适应任何基因组序列RNA,可以通过将该核苷酸序列亚克隆到gRNA质粒骨架中来完成,Cas9蛋白成分保持不变。与ZFNs和TALENs相比,CRISPR/Cas9的易用性是一个显著优势,尤其是在生成大量载体以靶向众多位点[19]甚至全基因组文库[20-22]。CRISPR/Cas9的另一个潜在优势是多路复用的能力,即并行使用多个gRNA来同时靶向同一细胞中的多个位点[23],这使得一次突变多个基因或在基因组区域中设计精确缺失变得简单。
LentiCRISPRv2/lentiGuide-Puro是用于CRISPR/Cas9基因编辑的第3代慢病毒载体[24]。LentiCRISPRv2包含2个重要的元件:hspCas9和嵌合的前导RNA,LentiCRISPRv2是一种用于传递CRISPR成分的单一病毒载体。lentiGuide-Puro只有sgRNA,没有Cas9元件,必须与lentiCas9-Blast结合使用。lentiCRISPRv2从第1代lentiCRISPRv1升级而来,其产毒效率(病毒滴度)约是第1代的10倍。lentilGuide-Puro的产毒效率则更高,大约是lentiCRISPRv2的10倍,但用lentilGuide-Puro转染的细胞系需要预先整合Cas蛋白。为了得到更高的效率,本研究选择了lentiGuide-Puro作为传递载体。
CRISPR/Cas9在向导RNA的引导下利用Cas9蛋白对某个特定的基因位点进行切割,出现DNA的双链的切口[25]。这个切口促使细胞产生自我修复,主要有2种形式:非同源性末端接合和同源重组,通过这2种形式可以实现内源基因的定向敲除或靶向插入外源基因[26]。当细菌中有同源臂时,可以实现高效的同源重组。这种机制也为本研究提供了使用同源重组检测体内CRISPR/Cas9系统的思路。在检测Cas9核酸酶编辑功能时,根据紧密连接蛋白OCLN基因序列,设计针对OCLN基因的sgRNA,构建lentiGuide-Puro-OCLN sgRNA重组质粒,将lentiGuide-Puro-OCLN sgRNA重组载体通过转染试剂转染BHK-21-Cas9单克隆细胞系,阳性筛选后,以未感染lentiGuide-Puro-OCLN sgRNA慢病毒为对照,OCLN蛋白表达量越低,表明Cas9编辑效果越好。
本研究利用慢病毒转导系统构建了稳定表达Cas9蛋白的BHK-21-Cas9单克隆细胞系,可以用于CRISPR/Cas9敲除文库的转导,建立基因敲除细胞文库,为筛选影响病毒感染和复制的功能基因提供了科学依据。

