牛源性肺炎克雷伯菌噬菌体的分离鉴定及生物学特性分析
梁冰纯,赵文鹏,石玉祥,朱春燕,韩 博,高 健
(1.中国农业大学动物医学院,北京 海淀 100193;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056038;3.上海市农产品质量安全中心,上海 青浦 201708)
肺炎克雷伯菌(Klebsiellapneumoniae)是引起奶牛乳房炎的常见环境性病原菌。肺炎克雷伯菌乳房炎通常症状严重,难以治疗,给奶牛养殖业造成巨大经济损失[1]。目前主要使用抗菌药治疗这类乳房炎,然而,肺炎克雷伯菌对抗菌药(如四环素)耐药率较高的问题不容忽视[2]。因此,寻找合适的抗菌药替代物治疗此类乳房炎是未来发展的趋势。噬菌体是感染细菌、真菌和藻类等微生物的病毒,分为溶源性噬菌体和裂解性噬菌体,其来源广泛、无耐药、无残留、特异性强,对病原微生物以外的细胞无影响,并且已应用于食品加工、动植物养殖、医疗保健和生态环境等多个领域[3-6]。相关研究已经证实,噬菌体对金黄色葡萄球菌乳房炎有较好的治疗效果[7],因此,噬菌体有望成为治疗奶牛乳房炎的抗菌药替代品。但是,由于噬菌体特异性强,且大多数噬菌体感染细菌的裂解范围较窄,因此有必要研发出由具有较宽裂解范围的噬菌体产品,如噬菌体鸡尾酒和工程噬菌体[8]。本试验旨在针对乳房炎源性肺炎克雷伯菌,从污水样品中诱导分离噬菌体,并对其进行生物学特性分析,为奶牛乳房炎治疗中噬菌体产品的研发提供科学依据。
1 材料与方法
1.1 试剂及耗材 LB营养琼脂、LB肉汤、脑心浸液(BHI),均购自北京奥博星生物技术有限公司;SM缓冲液(主要由硫酸镁、氯化钠、明胶等组成),购自北京酷来搏科技有限公司;细菌基因组DNA提取试剂盒,购自北京天根生化科技有限公司;2×EasyTaq PCR Super Mix、DNA Marker、离心管、细胞冻存管和平皿,均购自北京华佰泰生物科技有限公司;琼脂糖粉,购自北京索莱宝生物技术有限公司。
1.2 样品采集 从河北省某规模化奶牛场不同圈舍中的粪尿蓄积池采集48份污水样品,用于分离噬菌体。
1.3 肺炎克雷伯菌菌株 在本实验室经鉴定、保存的肺炎克雷伯菌[9]中,选择1株(HLJ-3)作为宿主菌,用于诱导分离噬菌体;另选择来源于21个规模化奶牛场的44株肺炎克雷伯菌,与HLJ-3菌株一起,用于裂解谱的测定。所有菌株均冻存于-80 ℃,备用。
1.4 噬菌体分离及纯化 将冻存的肺炎克雷伯菌(HLJ-3)接种于LB琼脂平板,37 ℃下培养24 h。挑取单个菌落接种于BHI液体培养基,37 ℃、220 r/min振荡过夜培养。将污水样品10 000 r/min离心10 min,经0.22 μm微孔滤器过滤上清液。分别各取200 μL滤液和新鲜菌液加至3 mL LB液体培养基中,37 ℃、220 r/min振荡培养15 h。选择较为清澈的培养基,4 ℃、10 000 r/min离心10 min,用0.22 μm滤膜过滤上清液,将滤液置于4 ℃保存。用SM液稀释噬菌体原液,分别取40 μL不同稀释梯度噬菌体原液与适量菌液,加入适量LB半固体培养基充分混合,铺双层板并置于37 ℃恒温箱培养2~4 h。挑取大小一致的噬菌斑并加入适量菌液接种于适量LB液体培养基中37 ℃振荡过夜培养。将培养液10 000 r/min离心5 min,经0.22 μm微孔滤器过滤上清液,重复3次,即得到纯化噬菌体原液,4 ℃保存。采用双层琼脂平板法观察噬菌斑。
1.5 噬菌体超微结构观察 吸取纯化后的噬菌体悬液20 μL(浓度为109PFU/mL)加至电镜专用铜网上,室温下静置2 min。用2%醋酸铀染色1 min,干燥后,通过透射电子显微镜观察噬菌体超微结构。
1.6 噬菌体滴度测定 用SM溶液梯度稀释纯化的噬菌体原液。分别从不同梯度噬菌体稀释液和新鲜肺炎克雷伯菌液中各吸取40 μL液体,并加至5 mL LB半固体培养基中充分混合,快速倒于LB固体培养基平皿中,置于37 ℃恒温箱中培养 2~4 h,统计噬菌斑数量,计算噬菌体滴度。
噬菌体滴度(PFU/mL)=噬菌斑数×稀释倍数×10
1.7 噬菌体最佳感染复数(MOI)测定 将噬菌体纯化液和对数生长期的肺炎克雷伯菌液按噬菌体滴度(PFU/mL)/细菌浓度(CFU/mL)为 0.01、0.1、1、10 和 100充分混合,37 ℃孵育5 min,8 000 r/min离心5 min,弃上清留沉淀。重悬沉淀,置于适量LB液体培养基中37 ℃、220 r/min振荡培养2 h,再12 000 r/min离心1 min,保存上清液。之后按1.6的方法测定噬菌体滴度,滴度最高者即为该株噬菌体MOI。
1.8 噬菌体裂解谱检测 按1.6的方法,分别从45株对数生长期肺炎克雷伯菌中吸取100 μL菌液铺设双层平板,静置2~5 min,再取5 μL噬菌体悬液滴于双层平板上,置于37 ℃恒温箱中过夜培养,观察有无噬菌斑形成。
1.9 噬菌体一步生长曲线测定 在最佳MOI条件下,分别各吸取40 μL噬菌体纯化液和对数生长期肺炎克雷伯菌液于20 mL LB液体培养基中充分混合,37 ℃孵育5 min,12 000 r/min离心1 min,弃上清并重悬沉淀,重复该步骤2~3次。将最后1次得到的沉淀置于20 mL LB液体培养基中,220 r/min振荡培养2 h,每隔10 min取样1次。收集所得到的样品,12 000 r/min离心5 min,保存上清液并按1.6的方法测定噬菌体滴度。以感染时间为横坐标,噬菌体滴度为纵坐标,绘制一步生长曲线,并判断噬菌体的潜伏期和裂解期。
1.10 噬菌体酸碱稳定性和热稳定性测定 取100 μL噬菌体纯化液分别加至900 μL不同pH的PBS中(pH 2.0~12.0),37 ℃孵育2 h。将不同pH的培养液按1.6的方法测定噬菌体滴度,并绘制噬菌体酸碱稳定性曲线。将同一噬菌体纯化液平均分为5份,分别在30、40、50、60 ℃和70 ℃的水浴锅内孵育90 min,每隔10 min取样1次,将取得的样品按1.6的方法,根据不同温度和时间点噬菌斑的数量计算噬菌体滴度,并绘制噬菌体热稳定性曲线。
2 结果
2.1 肺炎克雷伯菌噬菌体的分离及纯化 对分离得到的噬菌体进行富集纯化培养,获得1株肺炎克雷伯菌噬菌体,命名为SJT-2。由图1可知,该株噬菌体可形成1~2 mm的边缘整齐、大小一致且透明度高的噬菌斑。
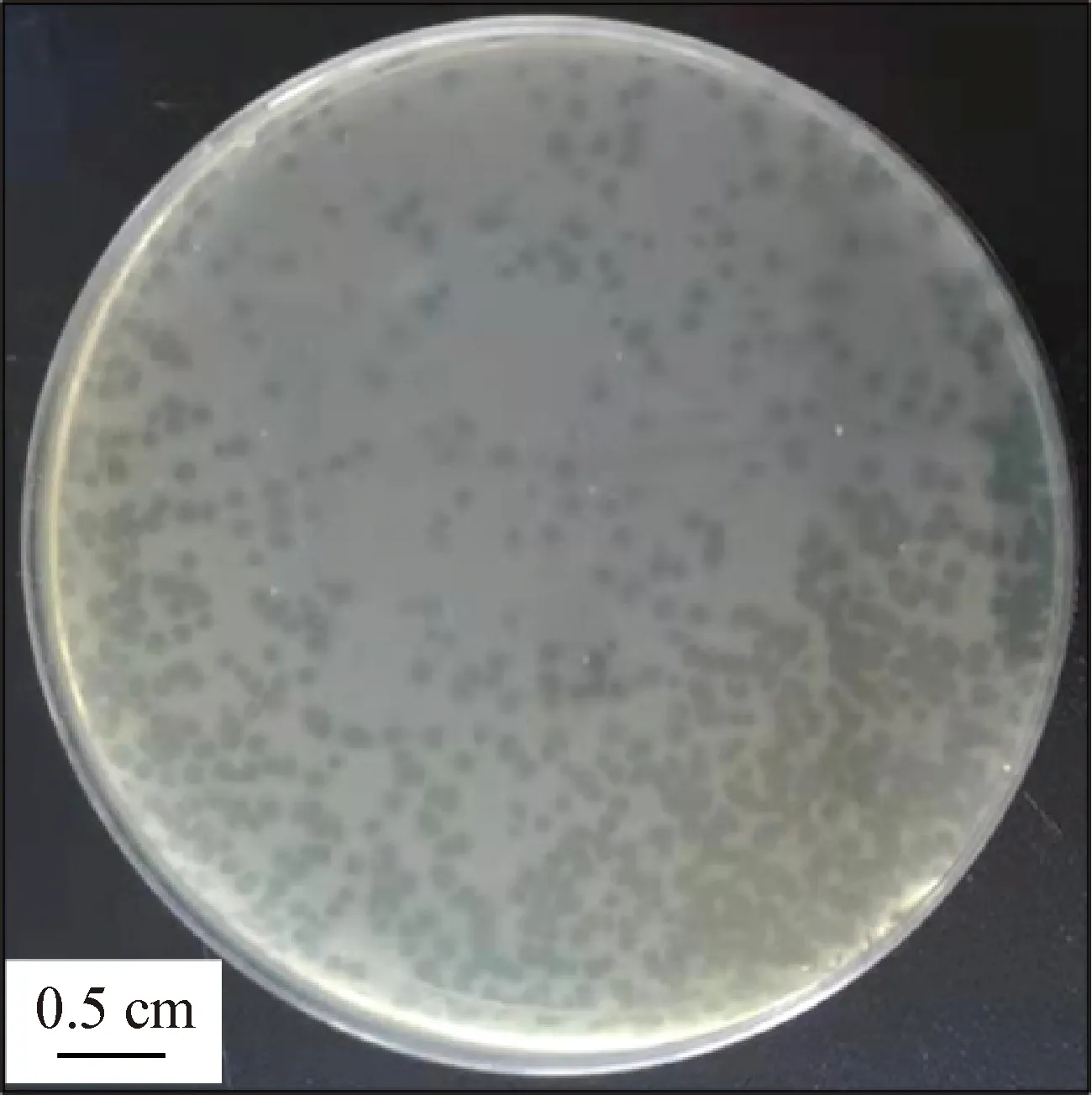
图1 噬菌体SJT-2的噬菌斑形态
2.2 噬菌体SJT-2超微结构观察 由图2可知,SJT-2主要由头、颈以及尾部结构组成;其头部呈现出多面体形态,长约100 nm,尾部长约116 nm,且有明显的尾丝。
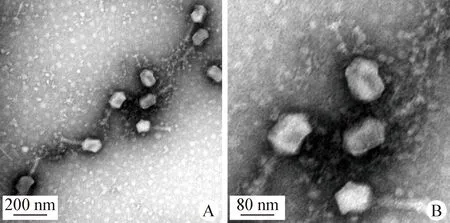
图2 噬菌体SJT-2超微结构
2.3 噬菌体SJT-2 MOI测定 由图3可知,MOI=0.1为SJT-2最佳感染复数,此时噬菌体具有最高滴度。

图3 噬菌体SJT-2最佳感染复数
2.4 噬菌体SJT-2裂解谱检测 在45株不同的肺炎克雷伯菌中,SJT-2能够裂解其中的33株,裂解率为73.3%。
2.5 噬菌体SJT-2一步生长曲线测定 由图4可知,SJT-2感染宿主菌在不同时间呈现不同滴度,其中,在0~20 min时为噬菌体潜伏期,噬菌体数量并无明显变化;在20~50 min时为噬菌体爆发期,噬菌体数量急剧上升;在50~120 min时为噬菌体稳定期,噬菌体数量并无显著变化。
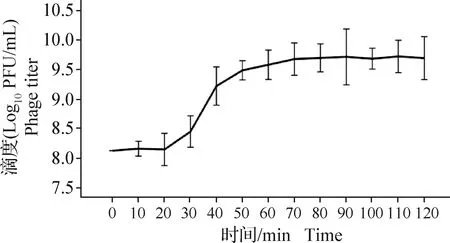
图4 噬菌体SJT-2一步生长曲线
2.6 噬菌体SJT-2酸碱稳定性测定 由图5可知,SJT-2在不同酸碱度中的活性存在显著差异。其中,pH为2.0时,SJT-2丧失活性;pH为3.0~4.0时,SJT-2具有一定活性;pH为4.0~8.0时,SJT-2滴度呈上升趋势,活性逐步增强;pH为8.0时,SJT-2滴度最高,活性最强;pH为9.0~12.0时,SJT-2滴度呈下降趋势,活性逐步减弱。

图5 噬菌体SJT-2酸碱稳定性
2.7 噬菌体SJT-2热稳定性测定 由图6可知,在过高或过低的培养温度下,SJT-2的活性存在较大差异。其中,在30 ℃时,SJT-2滴度并无明显变化;随着培养温度的升高和作用时间的延长,SJT-2滴度呈下降趋势。在70 ℃时,SJT-2滴度急剧下降,到作用20 min时SJT-2基本丧失活性。

图6 噬菌体SJT-2热稳定性
3 讨论
噬菌体在自然环境中普遍存在,由于其特异性较强,需要通过相应的宿主菌分离对应的噬菌体。本试验以奶牛场污水样品为底物,通过具有较强耐药性的临床乳房炎源性肺炎克雷伯菌分离获得1株裂解性噬菌体,命名为SJT-2。该株噬菌体可在LB半固体培养基中形成1~2 mm完全透明的噬菌斑。透射电镜观察发现,该株噬菌体由头、颈以及尾部构成,头部形态规则,呈多面体结构;尾部较长,初步判断为长尾科噬菌体。该株噬菌体与已报道的肺炎克雷伯菌噬菌体KpJH46Φ2和ST258具有不同形态[10-11],说明从不同环境条件中可以得到不同的噬菌体。
通常,裂解性噬菌体首先识别宿主菌表面受体并结合,向宿主菌体内注入核酸,利用细菌内遗传物质进行自身的复制与增殖,最后通过裂解酶和穿孔素释放子代噬菌体。其中噬菌体增殖特点表现为“一步生长”[12],与细菌二分裂式指数生长增殖形式具有明显差异[13]。噬菌体活性受温度、酸碱度、紫外线以及其他有害因子的影响较大,因此会根据治疗需求采用不同的给药方式,保证噬菌体制剂的功效[14]。本试验发现,SJT-2潜伏期较短、裂解能力较强,耐高温,耐碱不耐酸。其中,在50~60 ℃培养90 min后SJT-2仍具有一定活性,在70 ℃下培养20 min后SJT-2完全失活;在pH为8.0时SJT-2具有最高滴度。
综上所述,本试验通过奶牛乳房炎源性肺炎克雷伯菌获得的噬菌体SJT-2裂解谱较宽、裂菌能力较强,且具有耐高温、耐碱的生物学特性,适合作为研发临床治疗产品的基础株。

