薏苡仁水提液对试验性结肠炎小鼠的保护机制
张 涛,周期律,余儒洋,钟 佳,刘钟杰,胡宇声
(1.北京农学院动物科学技术学院,北京 昌平 102206;2.中国农业大学动物医学院,北京 海淀 100193)
非特异性结肠炎是小动物临床的常见疾病,属于炎性肠病的范畴。非特异性结肠炎以反复发作的消化道症状为特征,极易引发贫血、感染和营养不良等症状,严重影响动物的寿命和生存质量。现有的研究认为,肠黏膜固有层中免疫细胞数量异常是导致非特异性结肠炎发病的重要原因之一[1]。肠道固有层中的免疫细胞是维持机体免疫力的基础,当固有层内免疫细胞数量异常时,会引发局部免疫抑制或亢进,进而诱发结肠组织炎症反应[2]。现有针对非特异性结肠炎的治疗以抗炎药为主,但副作用较为明显。在中兽医视角下,非特异性结肠炎动物的临床表现往往体现出湿邪致病的特征,故中兽医以祛湿健脾为主的疗法在临床中疗效较好。薏苡仁作为健脾化湿药,是治疗非特异性结肠炎的常用中药。含有薏苡仁的方剂或其成分的药物在临床观察和实验室研究中均被证实可缓解结肠炎症状[3-4]。然而,针对薏苡仁单一药物对结肠炎作用的研究目前少见报道,其发挥相应作用的机制亦尚不明确。
葡聚糖硫酸钠(Dextran sulfate sodium,DSS)溶液中带负电荷的硫酸基对肠上皮细胞具有毒性,可导致实验动物出现与非特异性结肠炎相似的临床表现和病理变化,因而自由饮用DSS溶液所诱导的试验性结肠炎模型已成为最常用的研究非特异性结肠炎的动物模型之一[5]。本试验通过DSS自由饮用方式制备小鼠试验性结肠炎模型,以疾病活动指数(Disease activity index,DAI)、血清氧化指标和结肠组织病理学评分评估薏苡仁水提液(Coix seed decoction,CSD)对结肠炎小鼠的保护作用,并通过结肠黏膜中T细胞亚群和固有免疫细胞数量的变化,探究CSD可能的作用机制。
1 材料与方法
1.1 实验动物 8周龄昆明小鼠,雌性,体重(35±2)g,清洁级,购自斯贝福(北京)生物技术有限公司。
1.2 主要试剂 超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒,购自上海碧云天生物科技有限公司;丙二醛(Malondialdehyde,MDA)检测试剂盒,购自北京索莱宝科技有限公司;粪便潜血检测试剂盒,购自广东珠海贝索有限公司;CD3 FITC、CD8a PE、CD45 PerCP-cy5.5、CD4 APC、CD11b PE、LY-6G PE-Cy7、F4-80 APC、CD11c FITC、CD45 PerCP-Cy5.5抗体,均购自BioLegend(美国);DSS,购自北京Coolaber科技有限公司;薏苡仁,购自北京同仁堂药店。
1.3 主要仪器 流式细胞仪(LSRII型,Becton,Dickinson and Company,美国);低速离心机(京立离心机有限公司,中国)。
1.4 薏苡仁水提液的制备 取8 g薏苡仁于室温条件下在双蒸水中经过浸泡、熬制、定容、加压过滤等步骤,获得的200 mL澄清液体即为4%(w/v)CSD,将4% CSD使用3倍体积无菌双蒸水稀释,即获得1%(w/v)CSD。将制备完成的水提液分装存储于-80 ℃冰箱中,并于使用前水浴复温至40 ℃。
1.5 试验分组及处理 将32只小鼠随机分为4个组:空白对照(CON)组,模型(DSS)组,高、低浓度薏苡仁水提液(HCSD、LCSD)组。小鼠以组为单位,始终饲养于温度(25±2)℃,相对湿度55%±10%,昼夜节律为12 h-12 h的环境中。本试验所涉及的动物试验均获得中国农业大学实验动物福利委员会批准(AW15012020-3)。动物试验共进行20 d,前10天为预保护期,HCSD组小鼠每日灌胃4% CSD 1 mL/(50 g·bw),LCSD组小鼠每日灌胃1% CSD 1 mL/(50 g·bw),CON组和DSS组小鼠每日灌胃生理盐水1 mL/(50 g·bw),各组小鼠在预保护期饮用水均为纯净水;后10天为造模期,在维持预保护期用药方式的基础上,分别在第11、12、15、16、19天和第20天更换DSS组、LCSD组和HCSD组小鼠饮用水为5%(w/v)DSS,对小鼠进行试验性结肠炎造模,第13、14、17天和第18天为间歇期,更换此3组小鼠饮用水为纯净水,CON组小鼠在造模期饮用水均为纯净水。在第13、17天和第21天进行DAI评分,从粪便黏稠度、粪便潜血、体重变化3个方面进行评分,总得分即3项评分总和,评分细则见表1。在第21天眼球采血收集小鼠血清后,处死小鼠。每组随机挑选4只小鼠于结肠中段取3 cm左右结肠组织,冲洗后保存于预冷的 PBS 溶液中,另4只小鼠将肠段冲洗后保存于4%多聚甲醛中,备用。

表1 DAI评分细则
1.6 组织病理学评分 将1.5中所取肠段分别经脱水、包埋、切片、脱蜡、苏木精-伊红(Hematoxylin-eosin,H.E.)染色等步骤完成切片制作,并于显微镜下观察,组织病理学评分由实验人员从炎性细胞浸润程度、皱襞萎缩程度、水肿程度3个方面进行盲法评价,每个指标按严重程度分别划分为0~3分。
1.7 血清氧化指标含量的测定 按照试剂盒说明书分别检测收集血清中SOD活力和MDA含量。
1.8 流式染色检测 将1.5中所取结肠组织经剪碎、消化、洗涤、离心、过滤、重悬等步骤后,保存在4 ℃环境中,使用CD3 FITC、CD8a PE、CD4 APC、CD11b PE、Ly-6G PE-Cy7、F4-80 PerCP-Cy5.5、CD11c FITC、CD45 BV421抗体分别对细胞悬液进行染色,并使用流式细胞仪进行细胞分析。
1.9 数据处理 所有数据均在SPSS 20.0软件进行统计学处理,结果以平均值±标准差表示,并采用单因素方差分析(One-way ANOVA)检验,P<0.05时统计学上有显著性差异。
2 结果
2.1 CSD对结肠炎小鼠DAI的影响 由图1可知,与CON组相比,DSS组、LCSD组和HCSD组小鼠在造模过程中DAI均出现显著上升(P<0.05);与DSS组相比,LCSD组小鼠第17天DAI评分未出现显著变化(P>0.05),其余时间点LCSD组和HCSD组小鼠DAI评分均出现显著下降(P<0.05)。
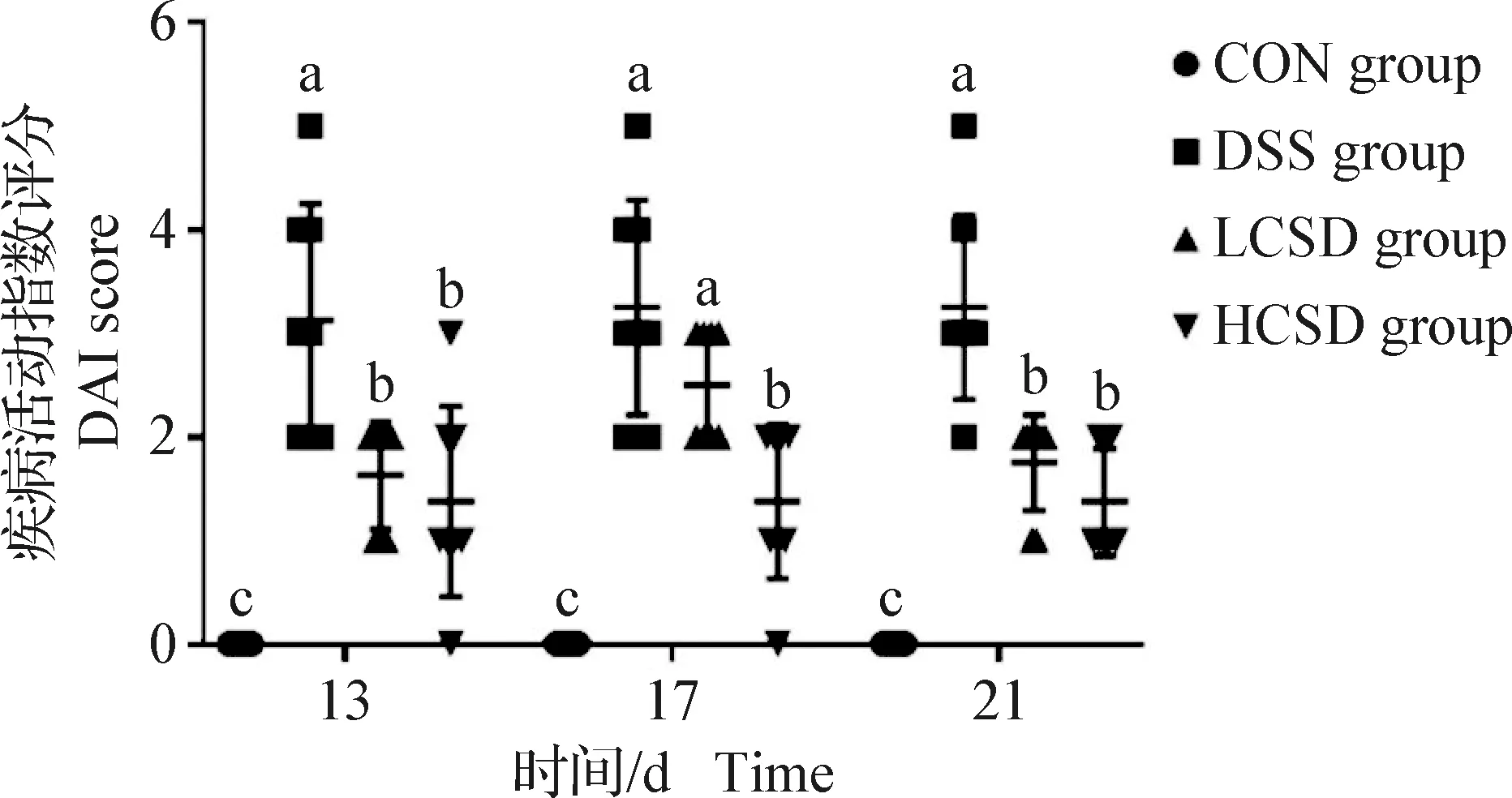
图1 CSD对结肠炎小鼠DAI的影响(n=8)
2.2 CSD对结肠炎小鼠结肠组织病理学评分的影响 由图2可知,与CON组相比,DSS组小鼠结肠组织学形态出现明显改变,组织疏松水肿,皱襞萎缩,淋巴细胞浸润,血管充血,上皮细胞脱落;而HCSD组和LCSD组受到CSD保护后结肠组织学形态明显改善。对各组H.E.染色切片进行组织病理学评分,发现与CON组相比,DSS组小鼠结肠组织病理学评分显著增加(P<0.05);与DSS组相比,HCSD组和LCSD组结肠组织病理学评分显著降低(P<0.05)。
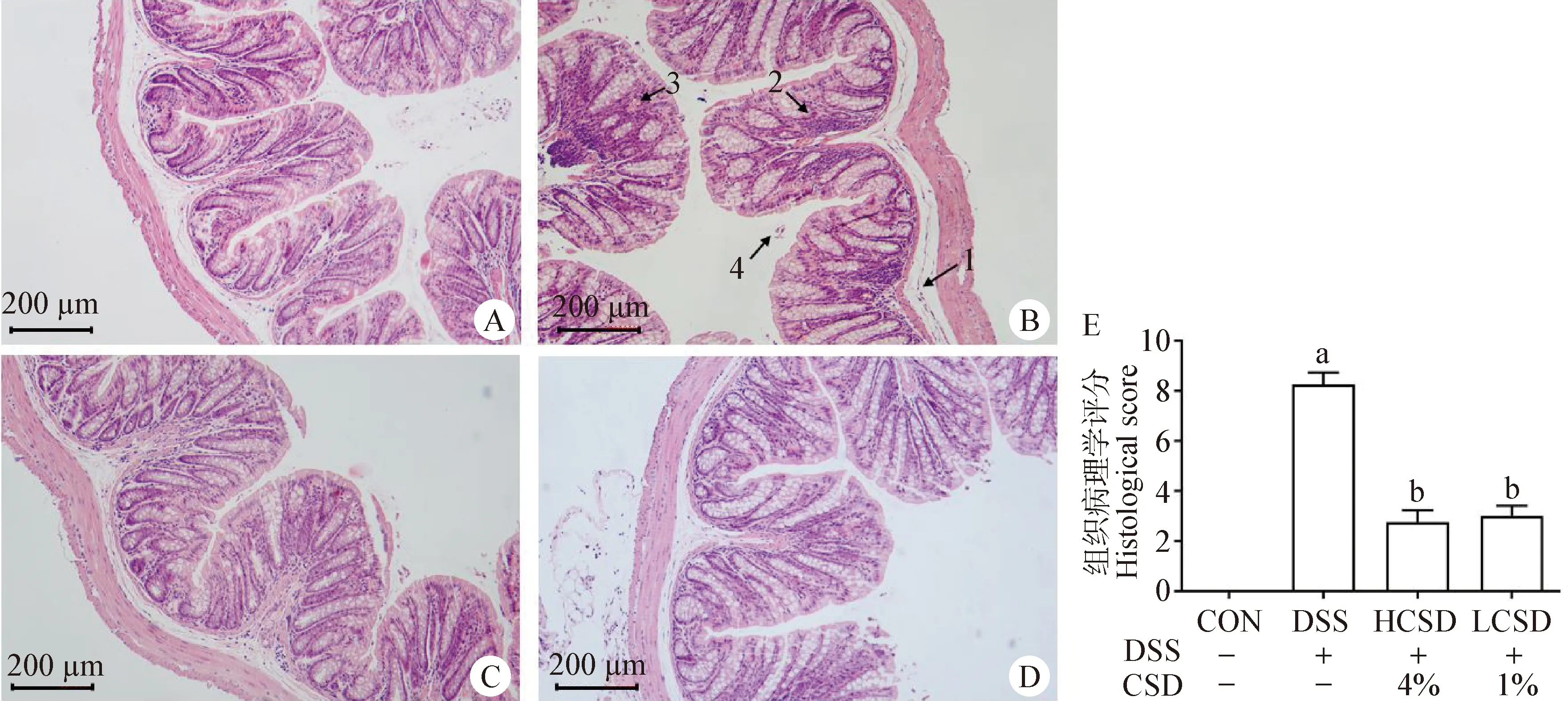
图2 CSD对结肠炎小鼠结肠组织病理学评分的影响(n=4)
2.3 CSD对结肠炎小鼠机体氧化损伤的影响 由图3可知,与CON组相比,DSS组小鼠血清中SOD活力显著下降(P<0.05),MDA含量显著上升(P<0.05),而与DSS组和CON组相比,LCSD组和HCSD组小鼠血清中SOD活力显著上升(P<0.05),MDA含量则显著下降(P<0.05)。
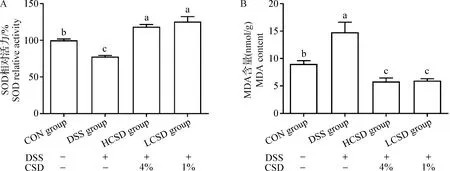
图3 CSD对结肠炎小鼠血清氧化指标的影响(n=8)
2.4 CSD对结肠炎小鼠结肠组织中T淋巴细胞亚群分布的影响 由图4可知,与CON组相比,DSS组结肠组织中CD4+T淋巴细胞占比没有显著性差异(P>0.05);而与CON组和DSS组相比,LCSD组和HCSD组结肠组织中CD4+T淋巴细胞占比显著增高(P<0.05);各组之间CD8+T淋巴细胞占比无显著性差异(P>0.05)。
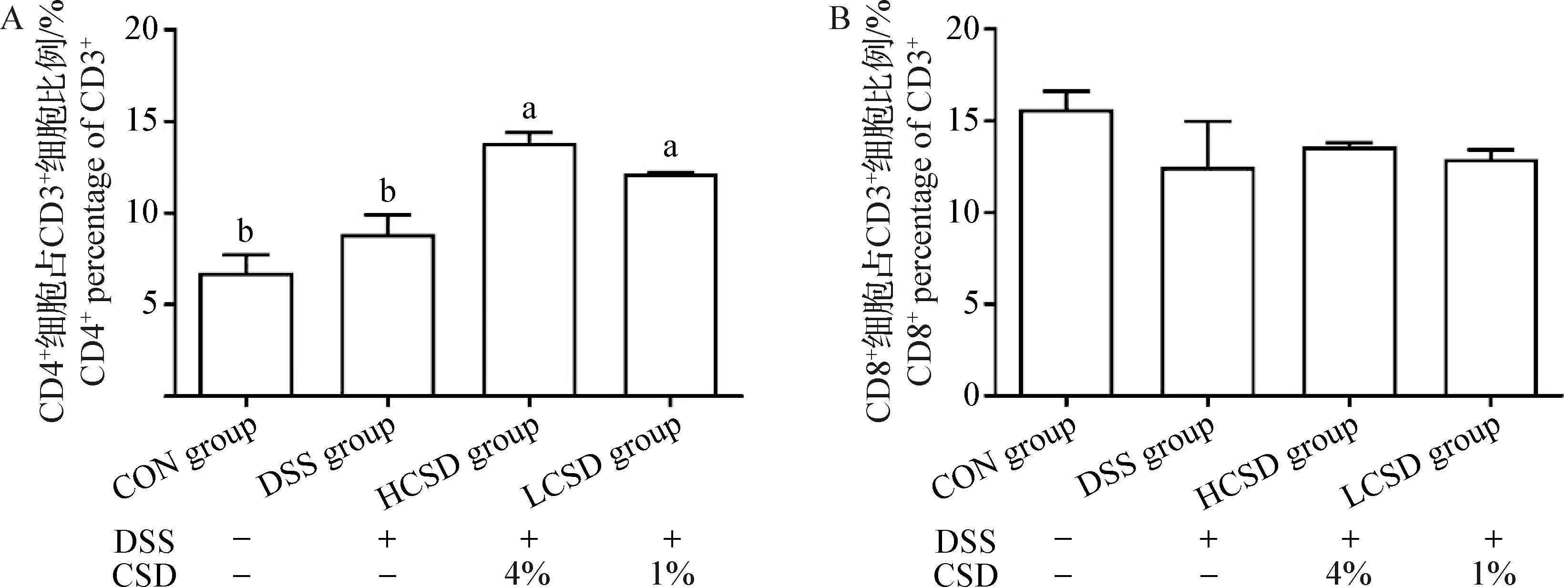
图4 CSD对结肠炎小鼠结肠组织中T淋巴细胞亚群分布的影响(n=4)
2.5 CSD对结肠炎小鼠结肠组织中免疫细胞的影响 由图5可知,与CON组相比,DSS组小鼠结肠组织中树突状细胞、巨噬细胞和中性粒细胞的含量均显著降低(P<0.05);与DSS组相比,LCSD组和HCSD组小鼠结肠组织中树突状细胞、巨噬细胞和中性粒细胞的含量均显著升高(P<0.05),而与CON组无显著性差异(P>0.05)。
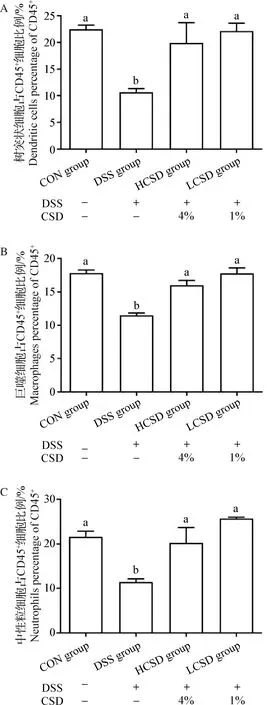
图5 CSD对结肠炎小鼠结肠组织中固有免疫细胞的影响(n=4)
3 讨论
在本试验中,造模组小鼠的DAI和组织病理学评分结果表明试验性结肠炎造模成功,结肠组织形态变化与之前的报道相一致[6]。DAI结果亦表明,CSD对试验性结肠炎小鼠的腹泻、体重减轻、粪便隐血等典型症状具有缓解作用。为进一步明确CSD对试验性结肠炎发挥保护作用的机制,本试验分析了与结肠炎症密切相关的氧化应激指标[7]。机体抗氧化与促氧化之间失衡且倾向于促氧化就会导致氧化应激,随之而来的氧化损伤被认为是炎症损伤机体的重要原因之一[8]。SOD是动物机体内广泛存在的一类抗氧化酶,能够催化超氧化阴离子降解,从而起到减轻氧化损伤的作用[7]。MDA则是脂质过氧化的重要产物,能够引起蛋白质、核酸等大分子的交联,其含量能直接反映氧化损伤的程度[7]。本试验发现试验性结肠炎小鼠血清内SOD活力降低、MDA含量升高,而CSD可以抑制该现象的出现,表明试验性结肠炎造成了小鼠全身性的氧化应激,但CSD可显著增强小鼠机体的抗氧化能力。文献报道显示,薏苡仁作为一种常见谷物,含有丰富的不饱和脂肪酸[9]。而不饱和脂肪酸中的双键具有强大的还原性,可还原组织中的ROS以达到抗氧化的目的[10]。同时,薏苡仁内含有的薏苡素、薏苡仁酯也已被证实具有显著的抗氧化能力[11]。综上所述,CSD对试验性结肠炎小鼠具有保护作用,该作用与CSD的抗氧化能力有一定关系。
免疫反应本质上是机体清除异物,修复自身组织的过程,对机体是有益的。当免疫反应失调时会导致组织过度损伤。因此,如何利用药物保证机体免疫反应处于正常有序的状态是治疗的关键之一[12]。临床研究表明,非特异性结肠炎的发病与肠道免疫紊乱尤其是T淋巴细胞亚群分布变化有密切联系[13]。在慢性结肠炎病例中,患者结肠组织内CD4+T淋巴细胞和CD8+T淋巴细胞的表达量相比正常人均出现下降[14]。作为一类可以同时调控先天性免疫和获得性免疫的细胞,组织内成熟的T淋巴细胞含量降低提示组织出现免疫功能障碍,进而破坏组织稳态并造成炎症的发生[14]。因此本试验使用流式细胞术分析小鼠结肠组织内T淋巴细胞亚群分布,结果显示,DSS组小鼠CD4+、CD8+T淋巴细胞表达量与CON组无显著性差异,但结肠组织病理学检查发现,DSS组小鼠结肠黏膜有大量淋巴细胞浸润。分析其原因,可能是DSS组小鼠在造模过程中虽然出现炎性反应引发了淋巴细胞募集过程,但组织内的T淋巴细胞并未被激活分化并发挥作用。但在本试验中,LCSD组和HCSD组小鼠结肠组织内CD4+T淋巴细胞含量显著上升,证明CSD可促进T淋巴细胞成熟,从而增强小鼠结肠免疫功能。在炎症反应过程中,由于炎性因子的分泌以及组织固有免疫细胞的介导,T淋巴细胞被募集并激活分化,从而调控机体免疫反应并抵抗外界病原入侵[14]。然而在本试验中DSS组小鼠在造模过程中T淋巴细胞并未分化,暗示DSS组小鼠可能存在免疫抑制过程,本课题组将进一步探索其中的机理。
在组织炎性反应过程中,树突状细胞、巨噬细胞、中性粒细胞是具有重要作用的固有免疫细胞,其数量可以直接反映固有免疫力的强弱[15]。树突状细胞是常见的抗原呈递细胞,其对T淋巴细胞具有显著的激活作用。在本试验中,DSS组小鼠结肠组织内成熟的T淋巴细胞含量降低可能与树突状细胞比例显著下降有关,同时也证实DSS组小鼠结肠组织内存在免疫抑制过程。而CSD维持了树突状细胞含量,从而保证了T淋巴细胞激活。巨噬细胞具有强大的分泌作用,近期研究证实,巨噬细胞除常规促炎作用外,也具有强大的抑炎作用,可以显著降低组织甚至机体的氧化水平[16]。另外,巨噬细胞的吞噬作用也可以协助组织清除病原,从而恢复组织稳态。由此可以推测,DSS组小鼠结肠组织内巨噬细胞含量显著降低,从而不能很好的清除抗原、恢复稳态,而持续存在的病原可能是刺激结肠炎症进一步加重并导致全身性氧化应激的关键。但是CSD可维持小鼠正常巨噬细胞功能,从而保证免疫系统的正常工作,并发挥保护作用。
综上所述,本试验结果表明薏苡仁水提液可以缓解小鼠试验性结肠炎症状,该作用可能与其调节T淋巴细胞分布、维持固有免疫细胞数量、增强机体抗氧化作用有关。

