基于老年营养风险指数构建老年射血分数保留型心力衰竭患者的预后模型
张铭炀 王佐翔 顾怡钰 蒋廷波
江苏省苏州大学附属第一医院心血管内科,江苏苏州 215000
心力衰竭(heart failure,HF)是一种临床综合征,其特征是存在心脏结构和/或功能的异常,引起静息和/或负荷时心输出量减少和/或心内压力增高,从而导致的呼吸困难等典型症状,也可伴有颈静脉压升高、肺部啰音等体征。目前按照左室射血分数(left ventricular ejection fraction,LVEF)的不同,其可分为射血分数保留的HF(heart failure with preserved ejection fraction,HFpEF)、射血分数降低的HF(heart failure with reduced ejection fraction,HFrEF)和射血分数中间值的HF(heart failure with mildly reduced ejection fraction,HFmrEF)三种[1]。在发达国家,HF 患病率为1.5%~2.0%,随着年龄增加,超过70 岁人群患病率≥10%,并且HFpEF患者生存率与另外两型HF 比较并无显著差异[2-3]。HF患者由于胃肠道淤血、营养吸收障碍及全身炎症反应等,部分患者存在营养不良。患者的营养状况失衡,又会进一步加重HF 患者的症状及病死率[4]。但国内目前鲜有运用营养状况对老年HFpEF 患者的预后进行的研究,故本研究旨运用老年营养风险指数(geriatric nutritional risk index,GNRI),探究营养状况在评价老年HFpEF 患者预后中的价值,并建立了一个预测HFpEF 患者预后的列线图模型。
1 对象与方法
1.1 研究对象
回顾性收集2018 年1 月至2020 年1 月就诊于苏州大学附属第一医院的HFpEF 患者共135 例为研究对象。纳入标准:①年龄≥65 岁;②符合《中国心力衰竭诊断和治疗指南2018》[1]中定义的HFpEF;③经规范化治疗后按医嘱随访。排除标准:①严重肝肾功能不全;②严重心脏瓣膜病、先天性心脏病等器质性心脏病;③急性心肌梗死、心肌炎、脑血管意外、恶性肿瘤;④数据缺失和失访。
1.2 研究方法
收集患者的基本信息,既往病史,实验室相关检查等。计算患者GNRI,公式为GNRI=1.489×白蛋白(g/L)+[41.7×(实际体重/理想体重)][5];如果实际体重大于理想体重,则比值按1 计算。其中理想体重根据Lorenz 公式得出,即:理想体重(男)=身高-100-[(身高-150)/4];理想体重(女)=身高-100-[(身高-150)/2.5][5]。主要不良心血管事件(major adverse cardiovas cular events,MACE)包括:全因死亡、心源性休克、非致死性心肌梗死、HF 再住院等。对所有患者进行12 个月的随访,记录随访期间内是否发生MACE。将随访期间内发生MACE 事件的患者定义为病例组,没有发生MACE 的患者定义为对照组。
1.3 统计学方法
采用SPSS 26.0 软件对所得数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验。不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,采用Mann-Whitney U 检验。计数资料以例数或百分比表示,采用χ2检验。运用多因素logistic 回归分析患者随访期间内发生MACE 事件的独立危险因素。使用R 语言(4.1.2)构建列线图预测模型Nomogram,使用Bootstrap 法行内部验证。使用ROC 曲线下面积(area under the curve,AUC)判断模型对于MACE 事件的预测准确度。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组基线数据比较
本研究共纳入135 例HFpEF 患者,其中发生MACE事件共44 例,占比32.59%。基线数据结果提示病例组患者的年龄,美国纽约心脏病学会(New York Heart Association,NYHA)分级≥Ⅲ级、合并糖尿病的比例,肌酐、高敏肌钙蛋白T、N 末端脑钠肽前体、肺动脉压力高于对照组,差异有统计学意义(P <0.05);而血红蛋白、白蛋白、GNRI 低于对照组,差异有统计学意义(P <0.05)。两组性别、合并冠心病比例,左心房内径、谷丙转氨酶比较,差异无统计学意义(P >0.05)。见表1。

表1 两组基线数据比较
2.2 随访期间内发生MACE 的独立危险因素及预测价值
将单因素分析中差异有统计学意义(P <0.05)的相关指标进行相关性分析,发现白蛋白和GNRI 存在共线性,其方差膨胀因子分别为10.507 和11.607,且白蛋白AUC(0.697)小于GNRI(0.747)(Z=2.012,P=0.044),故不纳入白蛋白进入多因素logistic 回归分析中。结果显示,NYHA 分级≥Ⅲ级、合并糖尿病比例是老年HFpEF 患者1 年内发生MACE 的危险因素(OR >1,P <0.05);GNRI 升高是其保护因素(OR <1,P <0.05)。见表2。计算GNRI 的ROC 曲线下面积为0.747(95%CI:0.654~0.839)。
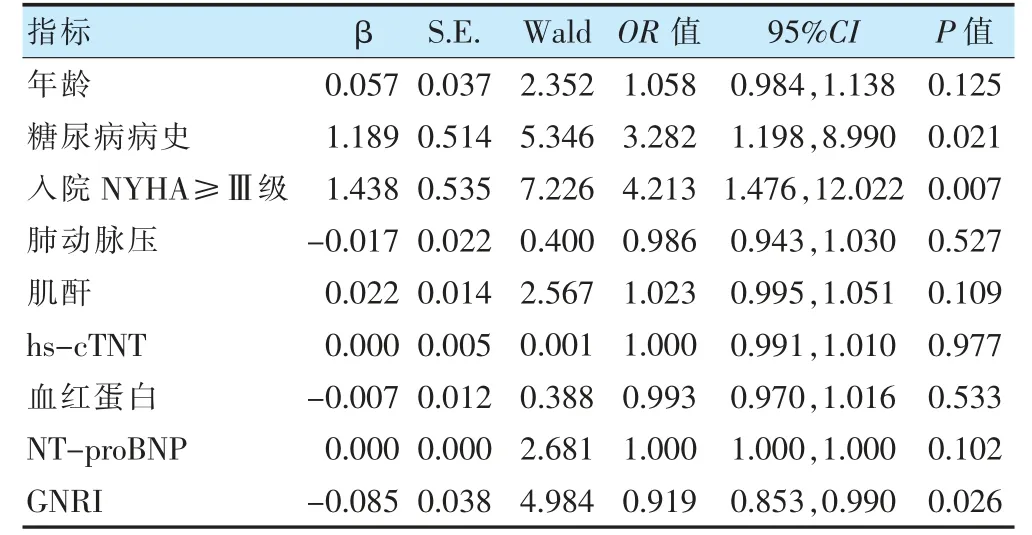
表2 1 年内发生MACE 相关危险因素的多因素logistic 回归分析
2.3 列线图模型的构建及预测性能评估
在logistic 回归基础上,使用R 语言构建老年HFpEF 患者出院后1 年内发生MACE 的Nomogram模型见图1。绘制Calibration 曲线对模型进行内部验证见图2。经过Hosmer-Lemeshow 检验,计算模型的C 指数为0.816,经过Bootstrap 随机抽样验证后的C 指数为0.796,其χ2=3.379,P=0.185,拟合结果良好。该模型的AUC 为0.816(95%CI:0.734~0.897,P <0.01)。将Nomogram 模型与GNRI 两者的ROC 曲线进行比较,通过Z 检验得出Z=2.034,P=0.042。证实Nomogram 模型的预测能力优于GNRI 评分,见图3。
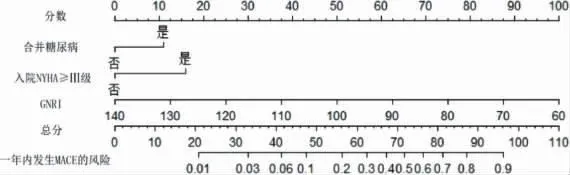
图1 预测老年HFpEF 患者1 年内发生MACE 风险的列线图模型
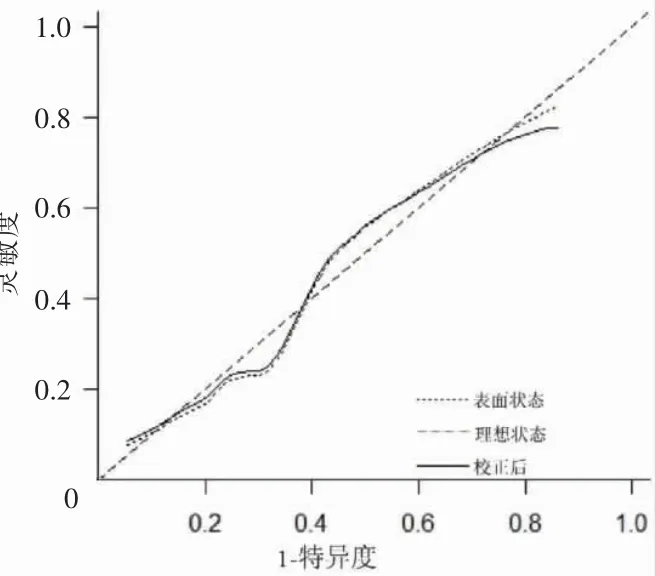
图2 模型校准图形
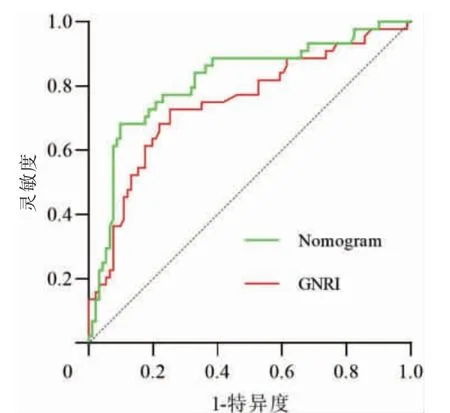
图3 GNRI 和Nomogram 的ROC 曲线
3 讨论
目前认为HFpEF 涉及心、肺、骨骼肌、血管和炎症等方面,本病预后与多种因素相关[6]。既往已有研究提示营养不良是HFpEF 患者不良预后的独立危险因素[7]。
现评估患者营养状况的方式有微型营养评定、营养不良通用筛查工具等。但其存在着使用复杂、需要老年人群的密切配合且存在一定的主观性,运用受限[8]。而Bouillanne 等[9]通过白蛋白及体重指数客观计算得出GNRI,且发现能预测住院老年患者的死亡率。Rasheedy 等[10]证实GNRI 评估营养状况的特异度优于微型营养评定等指标,其目前已运用于HF 患者预后评估中[11]。在对TOPCAT 实验中的1 677 例患者进行的研究中,Minamisawa 等[12]发现,与高GNRI 的HfpEF比较,低GNRI 者心血管死亡和全因死亡风险显著增加。
本研究亦发现,高水平GNRI 是老年HFpEF 患者1 年内发生MACE 的独立保护因素。①营养不良会使得体内炎症因子增加[13],炎症反应将降低一氧化氮的利用度、减弱环磷酸鸟苷的反应,加速心肌细胞的萎缩和纤维化,造成舒张功能障碍[14-15]。②营养不良患者体内蛋白水平低,血管内胶体渗透压降低,水钠潴留重,造成心脏容量负荷过重,造成心脏结构性改变[16]。③营养不良患者肠道功能受损,造成肠道菌群移位[17],肠道菌群的代谢产物如短链脂肪酸、吲哚及其衍生物等可作为“信使”激活各种途径作用于脑细胞,影响宿主食欲和内分泌调节,导致生长激素、胰岛素样生长因子减少[18-19]。老年HFpEF 患者随着疾病的进展将会逐渐影响到自身的营养状况,甚至出现心脏恶病质可能[20]。
HFpEF 患者的心腔尺寸更小,心室壁更厚,壁应力更低[21],当HFpEF 患者心室负荷已达较高水平时,出现了呼吸困难的症状,心室受刺激分泌的脑钠肽水平仍较低,即患者NYHA 分级更能体现HF 的严重程度。糖尿病患者长期处于高糖状态,触发心肌血管氧化应激[22],增加活性氧水平,降低内皮一氧化氮的生物利用度,导致内皮驱动的血管舒张功能受损[23]。高糖亦会增加间质蛋白的糖基化,其产物进一步造成心肌纤维化的增加,导致心室僵硬和心室舒张功能受损[24]。
本研究存在一定程度的局限性,一方面本研究是单中心的回顾性研究,患者数量较少,可能由于样本量不足产生偏倚;另一方面本研究可能存在未考虑在内的混杂因素,会对研究结果产生影响。
综上所述,本研究基于GNRI 建立的列线图模型使用简便[25],且能够有效预测老年HFpEF 患者1 年内发生MACE 的概率,具有一定的临床应用价值。