导向深度学习的化合物性质实验教学
杨欢 贝伟浩 蓝仁敏


【摘要】本文以教学碳酸氢钠自偶电离为例,论述导向深度学习的化合物性质实验教学设计的方法,通过分析教学主题内容及教学现状,找寻教学创新点,合理定位评价目标,根据真实学情整合学科知识,从而解决学生提出的问题,驱动学生开展深度学习。
【关键词】深度学习 实验课堂 碳酸氢钠 自偶电离 高中化学教学
【中图分类号】G63 【文献标识码】A
【文章编号】0450-9889(2022)26-0120-05
深度学习是促进学生能力发展、提升学生核心素养的重要方式和可靠路径。胡久华教授等人在《指向“深度学习”的化学教学实践改进》一文中指出,化学学科的深度学习需要在教师引领下,学生围绕具有挑战性的学习主题,开展以化学实验为主的多种探究活动,从宏微结合、变化守恒的视角,运用证据推理与模型认知的思维方式,解决综合复杂问题,获得结构化的化学核心知识,建立运用化学学科思想解决问题的思路方法,培养学生的创新精神和实践能力,促进学生核心素养的发展。笔者以教学碳酸氢钠自偶电离为例,论述通过化学实验促进学生深度学习的途径。
一、教学主题内容及教学现状分析
(一)教学主题内容
碳酸氢钠自偶电离一课是人教版高中化学选择性必修1《化学反应原理》第三章《水溶液中的离子反应与平衡》的单元复习课。学生在学完《溶液中的离子平衡》一章后,对溶液中的三大平衡有了初步的认识,但利用相关知识分析和解决实际问题的能力仍有待加强。
碳酸氢钠是人教版高中化学必修第一册第二章《海水中的重要元素——钠和氯》第一节“钠及其化合物”中的教学内容。教材只简单介绍了碳酸氢钠与酸反应、受热分解这两个化学性质,并未涉及碳酸氢根在溶液中的电离水解等知识。而利用碳酸氢盐沉淀金属离子是工业生产中的常用方法,显然学生仅掌握课本上讲述的碳酸氢钠的性质无法深入理解这一反应的原理。
本节课通过整合水溶液中的离子平衡与碳酸氢盐知识,帮助学生学习用平衡原理研究物质性质的方法,同时深入理解碳酸氢盐的化学性质。
(二)研究现状
用碳酸氢盐沉淀金属离子是工业生产常用的方法,如利用碳酸氢铵沉锰、沉铈等,这一方法也是高考考查热点。但碳酸氢盐可以与金属离子反应这一知识在教材中并未出现。在目前的教学中,大多教师遇到此类试题往往会就题论题,导致学生对反应原理的理解流于表面,不能举一反三。有教师设计了相关教学尝试解决这一问题,如利用碳酸氢钠与氯化钙发生反应,检验沉淀和上层清液的成分书写反应方程式,但并没有对反应原理进行深入解释;有教师通过探究碳酸氢钠与氯化钙反应生成的沉淀,并通过计算分析生成相应产物的可能性,理论上可行但实际上计算对学生而言难度较大,并且采用这种方式对反应原理也缺乏深入解释。此外,在生物光合作用实验中,会利用碳酸氢钠溶液作为二氧化碳的缓冲剂,教师和学生都对这一原理表示不解。由于反应释放和吸收二氧化碳的量较少,传统实验很难直观观察到二氧化碳释放和吸收的过程。为分析二氧化碳缓冲溶液的缓冲原理,有教师设计了数字化解析实验,借助这一实验,可以将碳酸氢钠吸收和释放二氧化碳的过程具象化。
二、教学思想与创新点
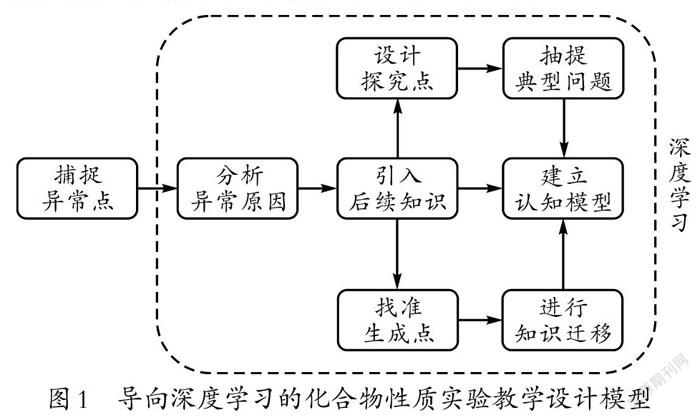
化学实验是化学探究的载体。贝伟浩老师曾提出由“探究点”“品质点”“异常点”“生成点”构成的化学课堂“四要素设计模式”。从这一模型出发,以碳酸氢钠与氯化钙的反应会产生不同现象这一与学生预期不符的异常点为引子引入课程,能够激发学生的学习兴趣。寻找生物学实验中的化学知识,并将其作为条件变换的探究点,抽象出化学学科本原性的典型实验问题并据此设计课程,能够促进学生深度学习。基于此,笔者构建了导向深度学习的化合物性质实验教学设计模型(如图1所示)。
三、教学目标
通过解读课程标准的内容要求、学业要求,结合学情,笔者制订如下教学目标。
(一)利用平衡移动的知识,分析碳酸氢钠与氯化钙的反应,以及碳酸氢钠溶液作為二氧化碳缓冲剂的反应原理,用方程式表示反应过程,培养“宏观辨识与微观探析”“变化观念与平衡思想”的化学学科核心素养。
(二)设计实验,探究碳酸氢钠与氯化钙反应的产物,证实碳酸氢钠溶液能够吸收或释放二氧化碳气体,并能作为二氧化碳缓冲剂使用,从而培养学生“科学探究与创新意识”的化学学科核心素养。
(三)根据反应原理,建构水溶液中碳酸氢钠自偶电离的反应模型,培养“证据推理与模型认知”的化学学科核心素养。
四、评价目标
通过解读课程标准的内容要求、学业要求,结合学情,笔者制订了如下评价目标。
(一)通过观察学生分析与解释实验现象的情况,诊断并发展学生宏微结合、证据推理、变化平衡的认知能力。
(二)通过观察学生讨论、设计实验的课堂表现,诊断并发展学生科学探究的能力。
(三)通过对实验及平衡原理的归纳总结,推导出碳酸氢根自偶电离的模型,诊断并发展学生证据推理的能力。
五、教学流程
笔者共设计了四个教学环节,具体内容如表1所示。
六、教学实录
(一)实验引入
师:可以利用氯化钙溶液鉴别碳酸钠与碳酸氢钠溶液吗?为什么?
生1:可以。因为氯化钙与碳酸钠可以反应生成碳酸钙沉淀,而氯化钙与碳酸氢钠不反应,所以可以利用是否产生白色沉淀来区分碳酸钠与碳酸氢钠溶液。
师:真的是这样吗?请利用桌面上老师所给药品与器材进行分组实验。分别向氯化钙溶液中滴入碳酸钠与碳酸氢钠溶液,然后汇报实验结果。
(学生活动:学生分组实验,并汇报实验结果。)
学生小组1:我们向氯化钙溶液中滴加碳酸钠溶液,发现生成了白色沉淀。
学生小组2:我们向氯化钙溶液中滴加碳酸氢钠溶液,无明显现象。
学生小组3:我们的结果跟上一个小组不一样。向氯化钙溶液中滴加碳酸氢钠溶液后,也有白色沉淀生成。
学生小组4:我们的结果跟前面两个小组都不一样。向氯化钙溶液中滴加碳酸氢钠溶液后,除了有白色沉淀生成,还有气体生成。
(a)学生小组2 (b)学生小组3 (c)学生小组4
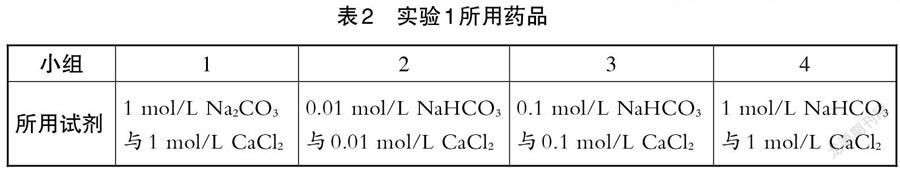
师:同样是碳酸氢钠溶液与氯化钙溶液反应,为什么三个小组的实验现象各不相同?
(学生对比之后发现,四个小组中有三个小组所用的溶液浓度不同。四个小组所用药品信息如表2所示。)
师:为什么溶液浓度不同,实验现象会有区别?
由此引入第二环节的内容。
(二)理论分析与实验验证
师:请根据实验结果,利用平衡移动原理,分析产生沉淀和气体的原因。
生1:碳酸氢根在水溶液中会电离生成氢离子与碳酸根,碳酸根与钙离子结合生成碳酸钙,观察到生成白色沉淀;氢离子与另一个碳酸氢根结合,生成碳酸,碳酸进一步分解生成二氧化碳和水,观察到有气体生成。沉淀和气体的生成又能促使碳酸氢根的电离平衡正移,反应从而持续进行。
师:为什么碳酸氢钠溶液浓度不同时会生成不同的实验现象呢?
生2:反应物的浓度较小时,电离产生的碳酸根与钙离子的离子浓度的乘积小于Ksp,所以观察不到沉淀。氢离子与碳酸氢根结合生成碳酸,碳酸再分解生成二氧化碳和水,只有当溶液中的二氧化碳达到饱和之后,才会有二氧化碳气体从溶液中逸出,所以只有反应物溶液浓度大的时候才能观察到有气体生成。
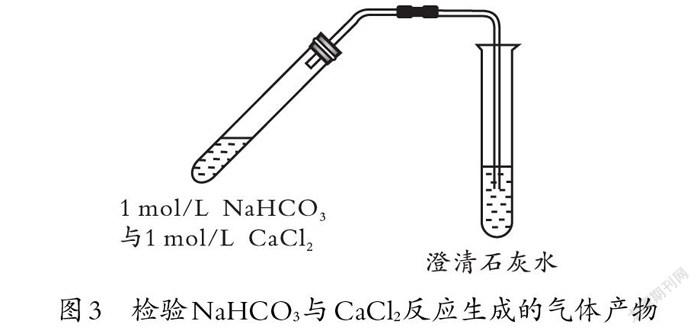
师:你能设计实验检验生成的气体确实是二氧化碳吗?
[学生活动:设计出实验2(如图3所示),用澄清石灰水检验生成的气体,却发现澄清石灰水没有变浑浊。学生分析原因并改进实验。]
生3:澄清石灰水没有变浑浊的原因可能是参与反应的溶液浓度不够大,生成的二氧化碳较少未进入澄清石灰水。可以尝试增大反应溶液的浓度,产生更多的二氧化碳。
(学生活动:改用饱和碳酸氢钠溶液和饱和氯化钙溶液进行实验3,能够明显观察到澄清石灰水变浑浊,从而证明产生的气体是二氧化碳,且实现现象不同是受反应物浓度影响。)
师:请根据以上实验现象,书写实验3的离子反应方程式。
(学生活动:书写方程式2HCO+Ca⇌HO+CO↑+CaCO↓)
师:这一反应过程,可以看作是碳酸氢根结合了另一个碳酸氢根电离产生的氢离子,钙离子的加入促进了这一平衡的正移。在没有钙离子存在时,这一反应也能发生吗?
(三)分析碳酸氢钠作为二氧化碳缓冲剂的原理并实验验证
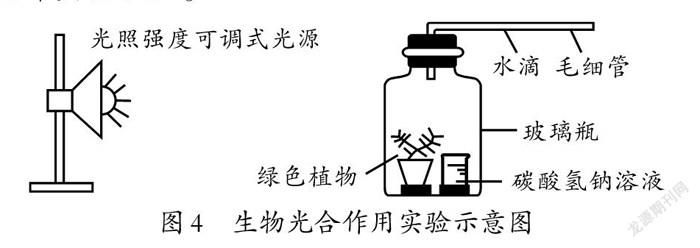
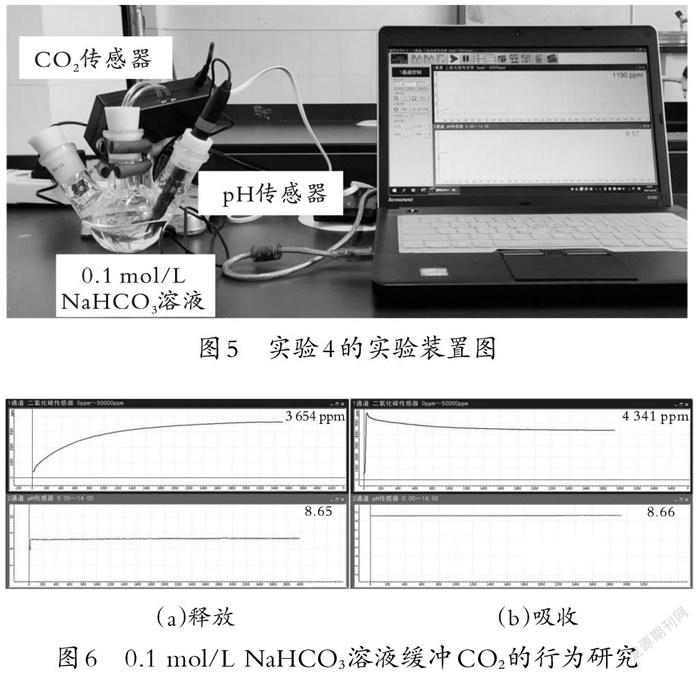
师:在生物学的光合作用实验中(如图4所示),常用碳酸氢钠溶液作为二氧化碳的缓冲剂。请分析碳酸氢钠溶液吸收或释放二氧化碳的反应原理,并设计实验验证。
生4:推测原理跟碳酸氢钠和氯化钙的反应类似,即碳酸氢根电离出的氢离子与另一个碳酸氢根结合,生成碳酸,碳酸再分解得到二氧化碳,即2HCO⇌HO+CO↑+CO。
生5:按照以上分析,碳酸氢钠溶液吸收二氧化碳可通过两个实验验证。一个实验是将二氧化碳通入碳酸氢钠溶液中,观察碳酸氢钠是否能够吸收二氧化碳气体,同时测量溶液的pH值是否降低;另一个实验是检验碳酸氢钠溶液是否能释放CO2气体,同时测定溶液的pH值是否升高。
师:利用数字化实验仪器,可以方便地测量气体含量和溶液pH值的细微变化。
(教师向学生介绍二氧化碳传感器和pH传感器,设计实验4,如图5所示,实验结果如图6所示。实验结果证明学生的推测正确。)
师:(小结)碳酸氢钠溶液中,存在碳酸氢根电离出的氢离子与另一个碳酸氢根结合,生成二氧化碳、水和碳酸根的过程。这一过程就是碳酸氢根自偶电离的过程,广泛存在于碳酸氢盐溶液中,该反应的K约为10-4,反应程度并不算小。向碳酸氢钠溶液中加入氯化钙溶液,生成碳酸钙沉淀,降低了碳酸氢根的浓度,使自偶电离平衡正移。其他外界条件的改变也会使平衡移动。
师:加热碳酸氢钠溶液会发生什么反应?为什么?
生6:会生成二氧化碳和碳酸钠。加热促使二氧化碳挥发,使自偶电离平衡正移。
(四)分析工业生产原理
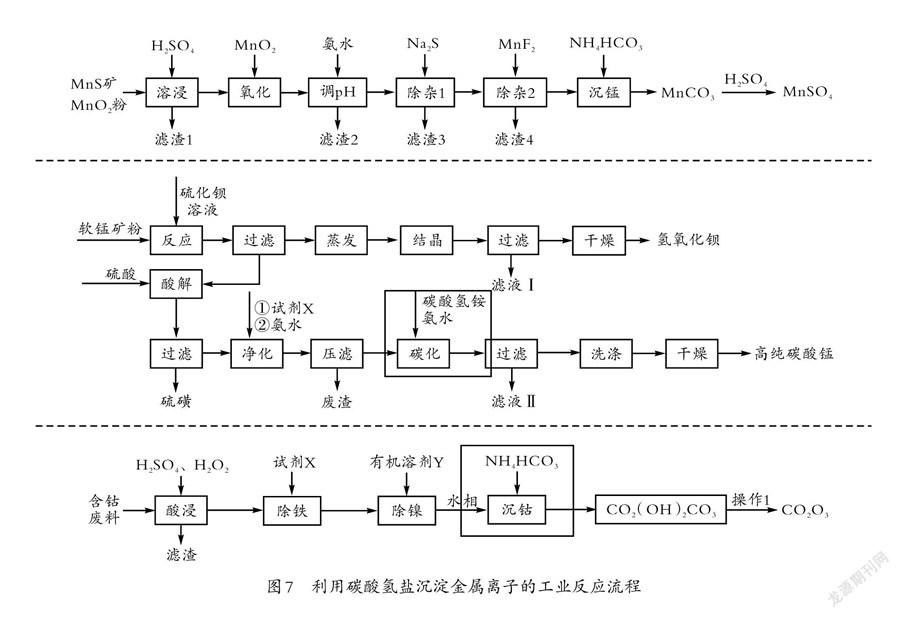
师:请分析工业流程中(如图7所示)相应步骤的反应原理,写出离子方程式。
(学生活动:书写相关步骤的离子方程式。)
学生基本都能正确写出沉锰的离子方程式:Mn+2HCO=MnCO↓+CO↑+HO以及碳化反应的方程式:Mn+HCO+NH·HO=MnCO↓+NH+HO,學生都能分析出发生了碳酸根与锰离子结合生成碳酸锰沉淀,以及氨水会与碳酸发生中和反应,但不太确定碳酸锰之外的另一产物;沉钴反应的方程式为2CO+4HCO=CO(OH)CO↓+3CO↑+HO,学生都能分析出有碳酸钴和二氧化碳生成,但是由于对碱式碳酸盐的形成原理不够明确,方程式的书写正确率不高。
七、教学效果与反思
溶液中的离子平衡问题复杂且抽象,学生不能很好地利用平衡移动原理分析溶液中离子平衡问题。教师可以根据这一真实学情,整合学科知识,结合物质性质与反应原理,解决学生的问题。
实际教学关注真实问题的解决,选取的两个情境都是学生在学习时真实遇到的,并且还与其他学科关联,能够很好地激发学生的学习兴趣。
教师通过设计巧妙的实验,将抽象的原理具象化,能够帮助学生自主建立自偶电离模型,而不是让学生被动地接受教师传递的信息。在本节课之前,学生不认为碳酸氢钠能够与氯化钙反应生成沉淀,导致不能很好地分析碳酸氢盐沉淀金属离子的问题;本节课后,学生能敏锐地识别可以利用碳酸氢根自偶电离模型解决的问题,说明他们较好地内化了相关内容。
此外,在有外加条件干扰时,学生书写方程式容易出现错误,说明他们利用平衡移动的知识解决实际问题的能力仍有待加强。教师后续可以通过引导学生解决更多的真实问题,从而提升他们解决实际问题的能力。
参考文献
[1]胡久华,罗滨,陈颖.指向“深度学习”的化学教学实践改进[J].课程·教材·教法,2017(3).
[2]郝纬.探究化工流程题中碳酸氢盐作沉淀剂的反应原理[J].高中数理化,2020(2).
[3]朱壮丽,邳宏伟,姜序敏,等.二氧化碳缓冲溶液缓冲原理的数字化解析实验[J].化学教育(中英文),2020(15).
[4]贝伟浩,蓝仁敏,张金恒.化学实验教学“四要素设计模式”研究[J].广西教育,2021(1).
(责编 刘小瑗)

