火棘果原花青素的提取优化与抗氧化活性研究
张星和 杨晓娜 邹章玉 左荣艳
(1.保山学院 资源环境学院;2.云南省高校怒江河谷生物质资源高值转化与利用重点实验室,云南 保山 678000)
火棘Pyracantha fortuneana(Maxim.)Li是一种蔷薇科苹果亚科火棘属植物,为常绿野生灌木[1]。据《中国植物志》记载,火棘属有10种,在我国主要分布有7种,云南地区多为火棘[2-3]。火棘果不仅资源丰富,具有很多的营养成分,而且药用价值高,为“药食同源”植物。《本草纲目》和《滇南本草》记录,火棘果性味甘酸,具有健脾消积、生津止渴、清热解毒、活血止血等作用,用来治积食、崩漏等[4-6]。目前对火棘果中黄酮类、多糖、维生素及色素等研究较多[7-14],而对其原花青素提取及抗氧化性报道相对较少[15-18]。鄢又玉[19]等以湖北恩施地区火棘果为原料,先做单因素实验,后利用中心组合和响应面法优化了火棘果原花青素的提取工艺,结果表明:提取温度,乙醇量以及酸量对原花青素的提取影响显著;随后将火棘果原花青素抗氧化能力与其总抗氧化能力比较,证明了原花青素所贡献的抗氧化能力在火棘果总抗氧化能力中占了很大比例。
原花青素(proanthocyanidins,PC)是以黄烷醇为基本结构的一类聚多酚化合物的总称,是目前世界上清除人体自由基最好的天然抗氧化剂之一,体内活性非常强[20-24]。人们对于原花青素作为抗氧化剂认可度非常高。高纯的原花青素一般为红棕色粉末,可溶于水和丙酮、甲醇等有机溶剂。其提取方法主要有溶剂提取法、酶提法、超声波辅助法、超临界CO2萃取和微波辅助法等[25-28]。微波辅助是一种具有很强化学效应和热效应的高频电磁波,能使目标分子相互摩擦碰撞,从而提高粉末温度并促进细胞破裂,使原花青素更好地渗出到提取液中,提高得率。关于微波辅助提取火棘果原花青素尚未见报道。本文采用了微波辅助法提取楚雄地区野生火棘果原花青素,用正交实验法优化提取工艺,并采用OH˙、DPPH˙、ABTS+、普鲁士蓝法、钼酸铵法、金属螯合能力6种方法测定火棘果原花青素的抗氧活性,补充和完善了火棘果原花青素抗氧化活性,为火棘果这一特色“药食同源”植物的开发和高值转化、利用提供参考。
1 材料与方法
1.1 材料和试剂
材料(野生火棘果):采自云南楚雄武定[成熟、饱满果实采摘→冲洗→晾晒→60℃烘干→粉碎→过筛(100目)→火棘果粉末备用]。
试剂:标准品,中国食品药品检定研究院,纯度99.2%;香草醛,天津市光复精细化工研究所,纯度99.0%;ABTS,酷尔化学,纯度98%;DPPH,阿拉丁试剂网,纯度≥97.0%;菲洛嗪水合物,酷尔化学,纯度97%;其余试剂均为分析纯。
1.2 仪器
M1-211A微波炉:广东美的厨房电器制造有限公司;721-可见分光光度计:上海菁华科技仪器有限公司;DFT-250A250克手提式高速万能粉碎机:温岭市林大机械有限公司;TDL-4型离心机:安亭仪器厂。
1.3 方法
1.3.1 原花青素提取工艺及最佳条件确定
取1 g火棘果粉末放入100 mL锥形瓶,倒入一定体积和浓度的乙醇溶液封口、浸泡,分别在不同微波时间、功率下进行提取数次,将提取液抽滤后离心,得到上清液,按含量测定方法于499 nm处测定其吸光度A,以纵坐标A求出横坐标x,即提取液中原花青素含量,从而计算原花青素的提取率。分别对乙醇浓度、水料比、微波时间和微波功率进行单因素试验。在单因素试验的基础上,设计L9(34)正交实验(如表1所示),探讨最佳提取条件。每个样品均做3个平行。

表1 正交试验因素与水平
1.3.2 原花青素含量测定及提取率计算
以儿茶素为标准品,无水乙醇为溶剂配制一系列浓度的溶液,再按香草醛-盐酸法显色:1.0 mL溶液+6 mL 4%香草醛-甲醇溶液+3 mL浓盐酸。30℃恒温水浴保温避光反应10 min,于499 nm测定吸光度A。以儿茶素浓度(mg/mL)为横坐标,A为纵坐标作图添加趋势线,得标准曲线y=18.522x+0.012 8,R²=0.999。说明在操作范围内浓度与吸光度呈线性,标准曲线可用。
用1.0 mL样品溶液代替标准品,同样的方法避光反应、显色后测定吸光度。将测定出的吸光度值代入标准曲线换算含量,按式(1)计算原花青素提取率:

式中c为提取液浓度mg/mL,V为提取液的体积mL,m为称取粉末质量g。
1.3.3 原花青素的鉴定及最大吸收波长确定
分别取1 mL提取液和标准品溶液按1.3.2水浴显色,用紫外可见分光光度计于320~700 nm波长范围内进行全波段扫描,比较二者的最大吸收波长。
1.3.4 抗氧化活性研究
1.3.4.1 OH·(羟基自由基)的清除能力测定
采用水杨酸法[29,30],先用无水乙醇配制相同浓度如7.5 mmol/L的FeSO4溶液、H2O2溶液、水杨酸溶液,等比例混合均匀,作为储备液。然后按1 mL原花青素提取液(或超纯水)+2 mL检测储备液(或超纯水)+超纯水=5 mL于526 nm波长处测定溶液体系的吸光度。根据三个不同的吸光度按式(2)计算OH·的清除率。

式中A1为提取液+储备液,A2为提取液+水,A0为储备液+水。
1.3.4.2 DPPH·(DPPH自由基)的清除能力测定
方法同(1),2 mL 0.2%mmol/L DPPH溶液为储备液在517 nm下测定吸光度。
1.3.4.3 ABTS+·的清除能力
参考HUANG W Y和刘玉革等[31,32]方法,由7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液混合反应12 h来提供ABTS+·。0.5 mL提取液+2 mL ABTS+·反应30 min在734 nm测定其吸光度A2。以乙醇溶液作对照测得A1。清除率计算见公式(3)。

1.3.4.4 铁离子的螯合能力测定
方法同(3),于562 nm波长处测定反应物的吸光度。螯合率(MCC)计算见公式(3)。
1.3.4.5 总抗氧化性的测定
钼酸铵法测定提取物的总抗氧化性。称取6.67 mL浓硫酸+2.13 g磷酸钠+0.99 g四水合钼酸铵+200.0 mL蒸馏水,充分溶解为钼酸铵工作液。0.3 mL提取液+3.0 mL钼酸铵溶液,90℃恒温水浴条件下加热1.5 h,静置,冷却,3 000 r/min离心15 min,钼酸铵溶液作空白,于695 nm处测定溶液中钼离子的吸光度。
1.3.4.6 原花青素还原能力的测定
1 mL提取液+1 mL0.2 mol/L磷酸盐缓冲溶液(pH=6.6)+1 mL 1%K3Fe(CN)6溶液50℃恒温水浴20 min,加入1 mL 10%三氯乙酸离心10 min。取2 mL上清液+3 mL去离子水+2 mL 0.1%FeCl3溶液于700 nm波长下测定吸光度。
2 结果与分析
2.1 确定提取物的吸收波长
根据1.3.3将标准品、提取物显色后进行全波长扫描,结果如图1所示。

图1 紫外吸收光谱
图(a)为标准品的光谱图,图(b)为提取物的光谱图,结果显示二者最大吸收波长均为499 nm,与文献报道500 nm基本一致。同时也表明微波辅助提取火棘果产物确实为原花青素。此后测定含量均在499 nm。
2.2 单因素试验
2.2.1 提取率受乙醇浓度的影响情况
分别用55%、65%、75%、85%、95%的乙醇溶液对火棘果粉末进行提取,结果如图2所示。

图2 乙醇浓度与提取率的关系
从图2看出,随着所用提取剂浓度的增加,火棘果原花青素提取率先逐渐增大,然后减小。当提取剂浓度达85%时,提取率为11.34 mg/g,为原花青素的最大溶出量;当浓度为55%~65%范围内提取率相对较低,可能由于水分含量相对较高,提取剂极性相对较大。根据极性溶剂利于极性相对较大物质的溶解而抑制细胞中原花青素溶出,导致提取率相对较低。此后随着乙醇浓度增加,结果与上述相反。综上所述,选取乙醇浓度75%、85%、95%为正交试验水平。
2.2.2 提取率受水料比的影响情况
分别按30、40、50、60、70 mL的乙醇溶液与1 g火棘果粉末比即水料比(mL/g)进行原花青素的提取,结果如图3所示。

图3 水料比与提取率的关系
从图3看出,随着乙醇溶液体积的不断增加,原花青素提取率先上升,当水液比在50 mL/g时,提取率为5.179 mg/g。当继续增加乙醇溶液的用量,提取率出现降低。可能是在溶剂体积小时火棘果粉末没有得到充分浸泡,且溶剂量较少溶剂仅能溶解有限的原花青素,使提取出的溶液容易达到饱和状态,从而抑制原花青素溶解于溶剂中,所以提取率偏低。当提取溶剂增加时,在溶剂浸泡下火棘果粉末能在短时间被微波破坏其细胞结构,使原花青素能被快速溶解到溶剂中。综上所述,选取40、50、60 mL/g水料比作为正交试验考察水平。
2.2.3 提取率受微波功率的影响情况
分别按140 W、280 W、420 W、560 W、700 W的功率进行提取,结果如图4所示。

图4 微波功率与提取率的关系
从图4看出,提取工艺中微波功率的不同会造成提取率的变化。当功率不断增加时,火棘果原花青素提取率先不断增加,然后逐渐降低。当功率为420 W时,原花青素提取率为5.02 mg/g达到最大值。可能是随微波功率增大,能量增大,有利于原花青素的扩散、溶出;当功率过大时,体系温度过高,导致原料可能发生化学变化,产生杂质过多。此外,高温会造成原花青素热降解,使提取率降低。综上所述,选取微波功率280 W、420 W、560 W为正交试验考察水平。
2.2.4 提取率受微波时间的影响情况
按照20 s、40 s、60 s、80 s、100 s微波加热进行原花青素的提取,结果见图5。

图5 微波时间与提取率的关系
从图5看出,微波时间影响火棘果原花青素的提取。随着时间增长,火棘果原花青素提取率先呈现不断增加趋势,然后逐渐减少。当提取时间为60 s时,提取率为4.62 mg/g达到最大值。可能短时提取不利于提取物从细胞中溶出,当微波60 s时,火棘果果肉细胞内外两部分有效成分浓度接近于达到平衡状态,故提取效果最佳。而继续延长提取时间又会使溶出的原花青素的理化性质发现改变,提取率再次下降。综上所述,选取提取时间40 s、60 s、80 s为正交试验考察水平。
2.3 正交试验结果与验证
正交试验结果见表2。
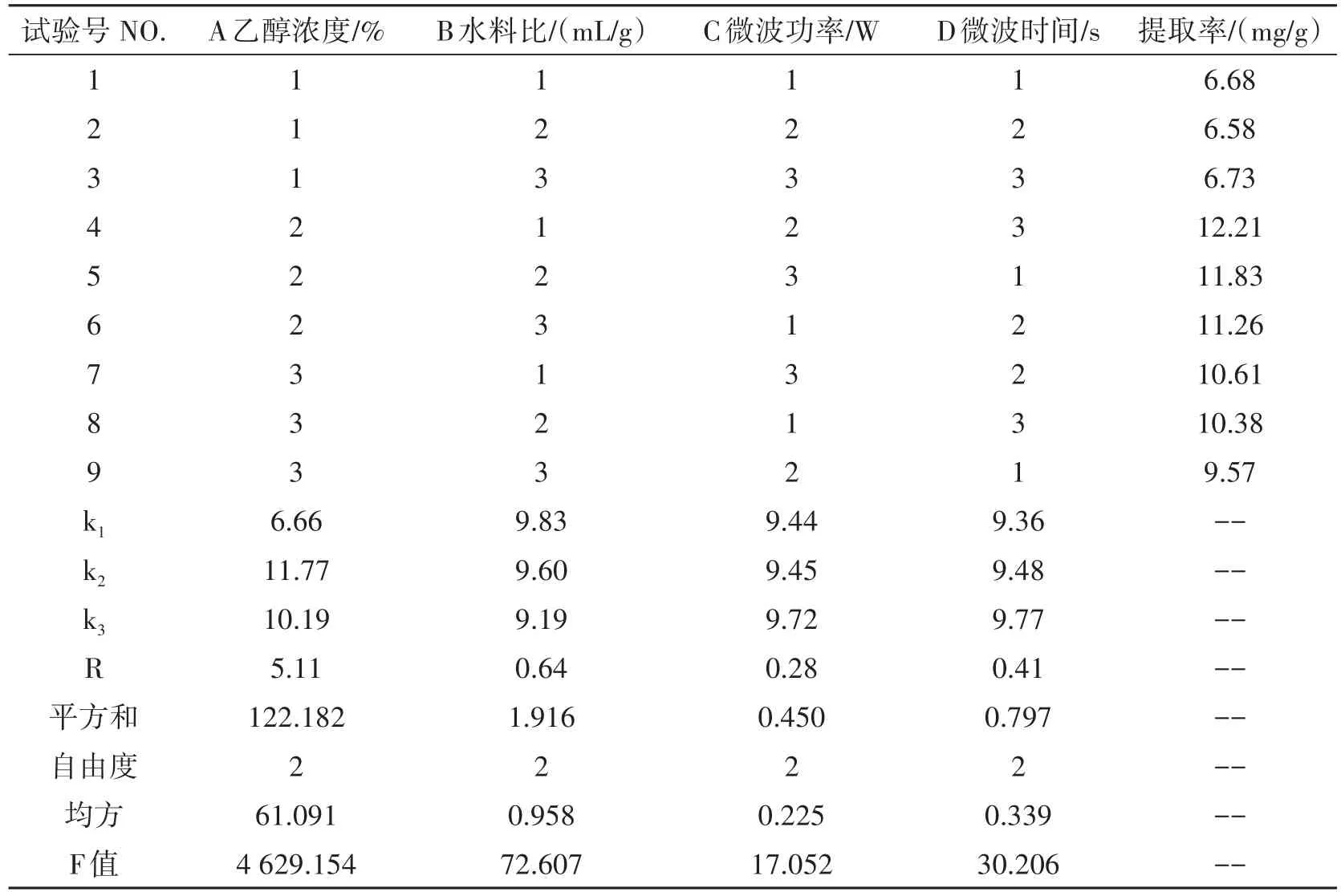
表2 提取工艺正交试验结果
通过R值比较各因素对火棘果提取物原花青素提取率的影响关系为A>B>D>C,即乙醇浓度>水料比>时间>功率。说明乙醇浓度对火棘果原花青素提取率的影响最大,水料比其次,提取率受时间和功率的影响相对较小。比较k值大小,得最佳提取组合为(A2B1C3D3):乙醇浓度85%、水料比40 mL/g、微波功率560 W、微波时间80 s。在最优条件下做三个平行试验,平均提取率为12.51 mg/g,提取率比表2最高提取率稍高。
2.4 抗氧化性结果
2.4.1 对OH·的清除能力
火棘果原花青素对OH·的清除结果见图6。

图6 原花青素提取物与OH·清除率的关系
从图6看出,火棘果提取物与OH·的清除存在某种量效关系,在57~172 μg/mL范围内OH·的清除率随火棘果原花青素浓度增加而逐渐增大。当原花青素浓度为172 μg/mL时,清除率为65.11%。表明:火棘果提取物原花青素对OH·具有一定的清除能力。
2.4.2 对DPPH·的清除能力
火棘果原花青素对DPPH·的清除结果见图7。

图7 原花青素提取物与DPPH·清除率的关系
从图7看出,火棘果原花青素在体外可使DPPH·被清除,当浓度为6~30 μg/mL时,其浓度与清除率近似于呈现正相关,且DPPH·清除率与火棘果原花青素质量浓度线性关系良好。当原花青素浓度达到30 μg/mL时,原花青素对DPPH·的清除率达到了68%。结果说明火棘果提取物原花青素可使三分之一以上的DPPH·被清除,清除能力一般。
2.4.3 对ABTS+·的清除能力
火棘果原花青素对ABTS+·的清除结果见图8。

图8 原花青素提取物与ABTS+·清除率的关系
从图8看出,当原花青素浓度为4.80~12.49 μg/mL时,ABTS+·的清除率随原花青素浓度增加而不断增加,而且增长速度相对较快,在浓度为12.49 μg/mL时,清除率高达94%。因此,火棘果原花青素对ABTS+·的清除能力非常强,适用于阳离子自由基丰富的体系。通过三种自由基清除试验可看出,火棘果提取的原花青素具有较强的清除自由基能力,具备了作为食品中天然抗氧化剂的可能。
2.4.4 对金属离子的螯合能力
火棘果原花青素对铁离子的螯合率结果见图9。

图9 原花青素提取物对金属螯合能力的影响
由图9可知,火棘果提取物原花青素浓度在91.8~150 μg/mL范围内,螯合率随原花青素浓度增加而不断增加,小于110 μg/mL时增长趋势相对较缓慢,在110~150 μg/mL范围内增长较快,浓度为153 μg/mL时,螯合率达到21.97%。可能由于提取物原花青素浓度增加,体系所含有效浓度增加,进而金属离子与原花青素碰撞、结合的几率增加,最终导致螯合率随浓度呈现一定的增长趋势。结果说明火棘果提取物原花青素拥有一定的螯合能力,但铁离子的鳌合作用较差,不大明显。
2.4.5 总抗氧化活性分析
可用测定绿色Mo5+磷酸盐的吸光度大小间接判断原花青素的总抗氧化性,结果如图10所示。

图10 原花青素提取物与抗氧化能力的关系
从图10看出,当原花青素浓度为74~223 μg/mL时,原花青素浓度与生成物质吸光度趋近于线性正相关,在浓度为223 μg/mL时,Mo5+磷酸盐吸光度达到0.782,再次表明火棘果提取物原花青素存在一定抗氧化活性,且对ABTS+·的清除最显著。
2.4.6 还原能力的分析
采用普鲁士蓝法表征原花青素的还原能力:铁氰化钾与火棘果提取物原花青素反应生成亚铁氰化铁。其生成量越多,颜色越明显,提取物还原能力也越强。结果见图11。
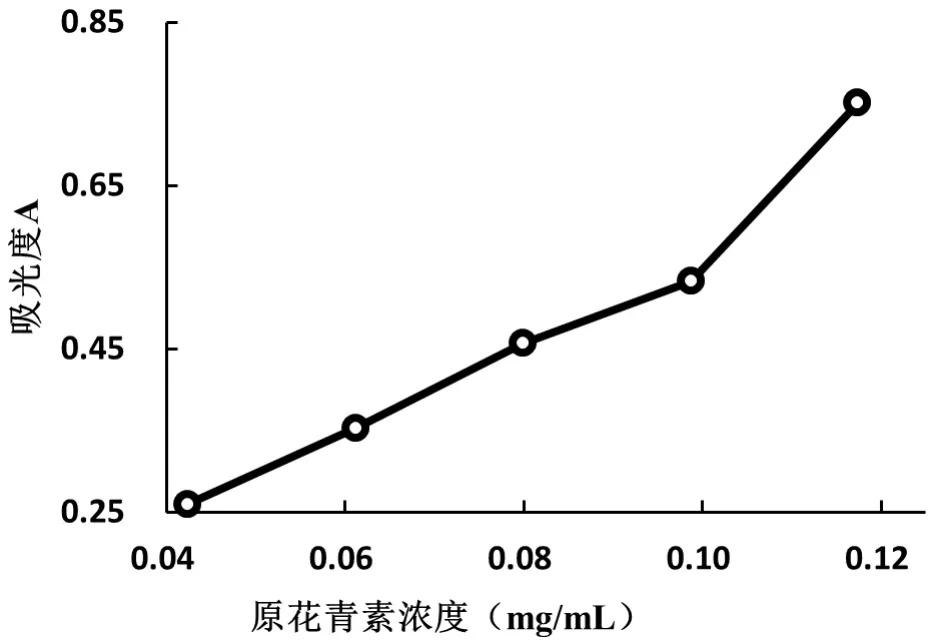
图11 原花青素提取物对还原能力的影响
从图11看出,当火棘果原花青素浓度在37~112 μg/mL时,吸光度随原花青素含量增加而呈现增大,并在原花青素浓度为112 μg/mL时,吸光度达到0.751。结果表明:火棘果原花青素浓度与普鲁士蓝生成量呈一定的量效关系,原花青素还原性与浓度有关。
3 结论与展望
以微波辅助法提取火棘果中原花青素,最佳提取条件为:微波时间80 s、功率560 W、水料比40(mL/g)、乙醇浓度85%,由此条件下得火棘果原花青素提取率为12.51 mg/g。然后采用6种常用抗氧化活性的检测方法:OH·、DPPH·、ABTS+·、金属螯合能力、普鲁士蓝法、钼酸铵法分别对火棘果原花青素提取物进行抗氧化性质研究。结果显示火棘果原花青素具有多种抗氧化活性,且与浓度呈正向量效关系。其中,火棘果原花青素对ABTS+·效果最明显,当原花青素浓度为12.49 μg/mL时,清除率达94%。为了更好地实现火棘果的高值转化与利用,后续可将原花青素纯化,然后作为抗氧化剂应用于某一具体的食品体系中,比较与常见抗氧剂如Vc和BHT性能的差异,从而使提取物更符合应用理念。

