GDF15在肾移植缺血-再灌注损伤中的作用及机制研究
朱杰夫 师朗 宋志霞 查宏楚 吴雄飞
肾移植是目前治疗终末期肾病的有效方法之一。随着公民对逝世器官捐献认知度的不断提高,肾移植数量逐年递增,而移植肾的急、慢性并发症可直接影响移植肾的存活,因此倍受关注。据统计,20%~40%的肾移植术后会出现移植肾功能延迟恢复(delayed graft function,DGF),显著增加了受者住院时间和住院费用,降低了移植肾的存活率[1-2]。以往认为急性排斥反应是导致DGF的主要原因,随着免疫抑制药的不断开发和临床应用,近十几年有了很大程度的改善,但是发生率仍较高。DGF的另一常见病因为肾脏缺血-再灌注损伤(ischemia-reperfusion injury,IRI),而这一过程又是器官移植无法避免的,且目前尚无有效的干预措施,因此积极探索IRI的发生机制是非常关键的科学问题[3-5]。
生长与分化因子(growth and differentiation factor,GDF)15是转化生长因子(transforming growth factor,TGF)-β超家族的一员[6-7],该超家族成员有助于细胞间信号传导并激活特异性受体以调节基因转录和细胞功能[8]。GDF15主要表达在肝脏和肾脏实质细胞以及巨噬细胞中,在肾脏中,GDF15主要表达于近端小管、Henle环和集合管[9]。已有研究证实,GDF15在缺血性疾病、肿瘤、炎症、心力衰竭等多种病理生理学过程中表达增加,并成为新药研发的新靶点[10-12]。例如,血清GDF15水平升高可预测手术或经皮冠状动脉介入治疗后急性肾损伤(acute kidney injury,AKI)的发生率[13-15],GDF15水平是造影剂肾病的独立预测因子[16],移植前GDF15水平可以预测移植后的不良事件[17]。因GDF15响应氧化应激和炎症反应而表达和分泌,有研究发现GDF15敲除小鼠对脂多糖(lipopolysaccharide,LPS)的反应性增加,其心脏和肾脏组织中单核细胞趋化蛋白(monocyte chemoattractant protein,MCP)-1、白细胞介素(interleukin,IL)-6和肿瘤坏死因子(tumor necrosis factor,TNF)-α的表达较野生型小鼠增加,证明了GDF15在脓毒症期间的保护作用,并提出了GDF15为炎症诱导的介导组织耐受性的蛋白[18-19]。然而在肾移植过程GDF15表达如何,是否发挥生物学作用,至今国外内均无报道。本文主要探讨小鼠肾移植IRI过程中GDF15表达的变化及其可能的作用机制。
1 材料与方法
1.1 实验动物
C57BL/6J雄性小鼠购于三峡大学实验动物中心。该动物研究方案经中华人民共和国卫生部机构审查委员会(伦理委员会)批准,并经三峡大学伦理委员会批准(202205010T2)。
1.2 模型建立与分组
CRISPR/Cas9系统敲除C57BL/6J小鼠GDF15基因(图1A),繁殖鼠通过聚合酶链反应鉴定野生型以及敲除鼠,并用GDF15蛋白质印迹法验证敲除效果(图1B),8~10周龄用于实验。(1)转录组学测序:野生型供体小鼠9只,野生型受体小鼠9只,分别于术后4、24、72 h后取3只受体小鼠的移植肾组织进行转录组学分析;(2)取材:野生型供体小鼠5只,GDF15敲除型供体小鼠5只,野生型受体小鼠10只,于术后72 h提取血清及肾组织样本;(3)生存率分析:野生型供体小鼠9只,GDF15敲除型供体小鼠9只,野生型受体小鼠18只,观察肾移植术后生存率。
小鼠肾移植手术详细描述在既往发表的文献[20],本次研究做了部分修改。麻醉供体小鼠,分离血管,获取少量血清用于肾功能检测,用4 ℃肝素化威斯康星大学保存液(University of Wisconsin solution,UW液)冲洗双肾,并在4 ℃ UW液中储存6 h。麻醉受体小鼠,切除双肾并移植左肾。移植物吻合时间固定在30 min,将输尿管固定到膀胱外壁来完成植入。获取供体小鼠血清和右肾作为假手术对照组。根据实验方案将小鼠分为野生型假手术组、野生型移植组、GDF15敲除假手术组、GDF15敲除移植组(图1C)。
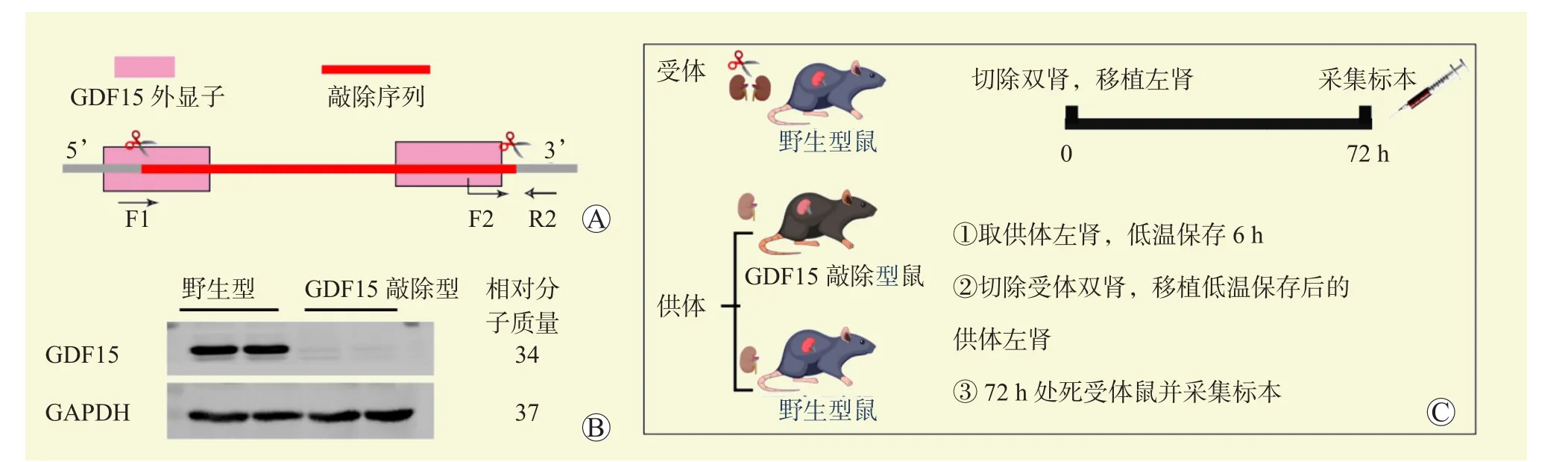
图1 模型建立方法与实验方案Figure 1 Model building method and experimental scheme
1.3 实验方法
1.3.1 转录组学测序 对各组肾组织进行转录组测序,检测各组GDF家族基因转录组学表达情况。
1.3.2 肾功能检测 使用7600p Hitachi全自动生化分析仪检测各组小鼠血清肌酐和血尿素氮水平。
1.3.3 酶联免疫吸附试验 采用酶联免疫吸附试验(enzyme-linked immune absorbent assay,ELISA)试剂盒(上海碧云天生物技术有限公司)检测各组小鼠肾组织IL-1β、IL-6和TNF-α表达水平。
1.3.4 蛋白质印迹法 将来自肾脏皮质和外髓质组织在含有蛋白酶抑制剂的缓冲液中裂解提取蛋白,取等量的蛋白质进行电泳。将电泳蛋白转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。封闭1 h后,加入稀释后的GDF15、核因子(nuclear factor,NF)-κB和Toll样受体4(Toll-like receptor 4,TLR4)一抗,4 ℃孵育过夜,洗涤后辣根过氧化物酶偶联的二抗孵育1 h。使用化学发光对印迹进行检测,并通过Image J软件进行分析。
1.3.5 免疫组织化学与免疫荧光染色 将肾组织用石蜡包埋,切成5 μm厚的切片进行免疫组织化学(免疫组化)和免疫荧光染色。肾组织石蜡切片脱蜡后水洗、抗原修复和封闭。
免疫组化:GDF15、肾损伤分子(kidney injury molecule,KIM)-1、髓过氧化物酶(myeloperoxidase,MPO)(指示中性粒细胞)、F4/80(指示巨噬细胞)一抗4 ℃孵育过夜,洗涤后辣根过氧化物酶或者碱性磷酸酶偶联的二抗孵育,3, 3’-二氨基联苯胺或者品红在显微镜控制下染色,用光学显微镜观察和获取图像,呈黄褐色或红色为阳性染色。
免疫荧光:TLR4、NF-κB一抗4 ℃孵育过夜,洗涤后荧光二抗孵育50 min,4’,6-二脒基-2-苯基吲哚染液孵育5 min,使用荧光淬灭剂封片。在显微镜下观察,Micro Publisher采集图像。
1.3.6 苏木素-伊红染色与肾小管损伤评分 5 μ m的石蜡切片经过二甲苯和酒精的逐步水化进行苏木素-伊红(hematoxylin-eosin,HE)染色,再依次脱水,浸泡二甲苯后,晾干切片,使用中性树胶封片,显微镜下观察并采集图片。肾小管损伤表现为肾小管坏死、溶解、扩张和管型形成。
肾小管损伤评分:视野内有0~25%损伤小管为1分;视野内有26%~50%损伤小管为2分;视野内有51% ~75%损伤小管为3分;视野内有>75%损伤小管为4分。所有的切片为随机检查外髓质和皮质部分,每张切片检测10个视野,取平均计算肾小管损伤评分,用显微镜拍摄具有代表性的照片。
1.4 统计学方法
采用GraphPad Prism 9.0进行统计学分析,符合正态分布的计量资料以均数±标准差表示,采用配对t检验进行组间两两比较,采用单因素方差分析进行多组间比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组肾组织GDF15表达及病理学结果
各组肾组织标本测序结果显示,与假手术组比较,GDF15是移植肾转录组学中上调最多的GDF家族基因(均为P<0.05,图2)。在肾移植术后4 h,肾脏中即可检测到GDF15蛋白高表达,且在72 h仍有持续(图3A)。免疫组化结果显示,GDF15在假手术组主要在近端小管细胞的细胞质表达,在移植组表达增加(图3B)。HE染色结果显示,移植组肾小管扩张、刷状缘缺失和管型损伤(图3C)。
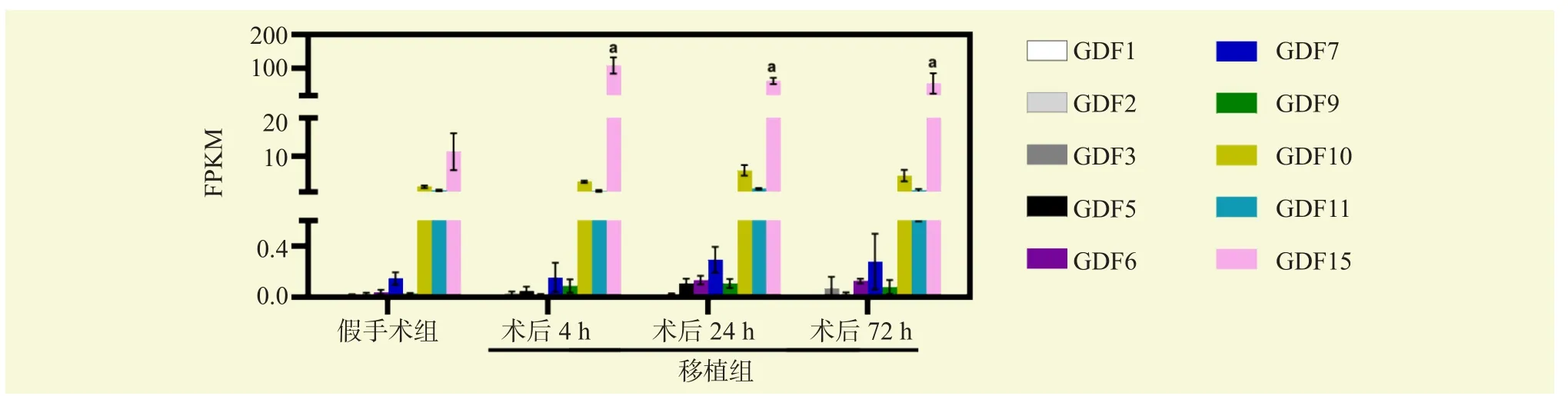
图2 GDF家族转录组学Figure 2 Transcriptome of GDF family
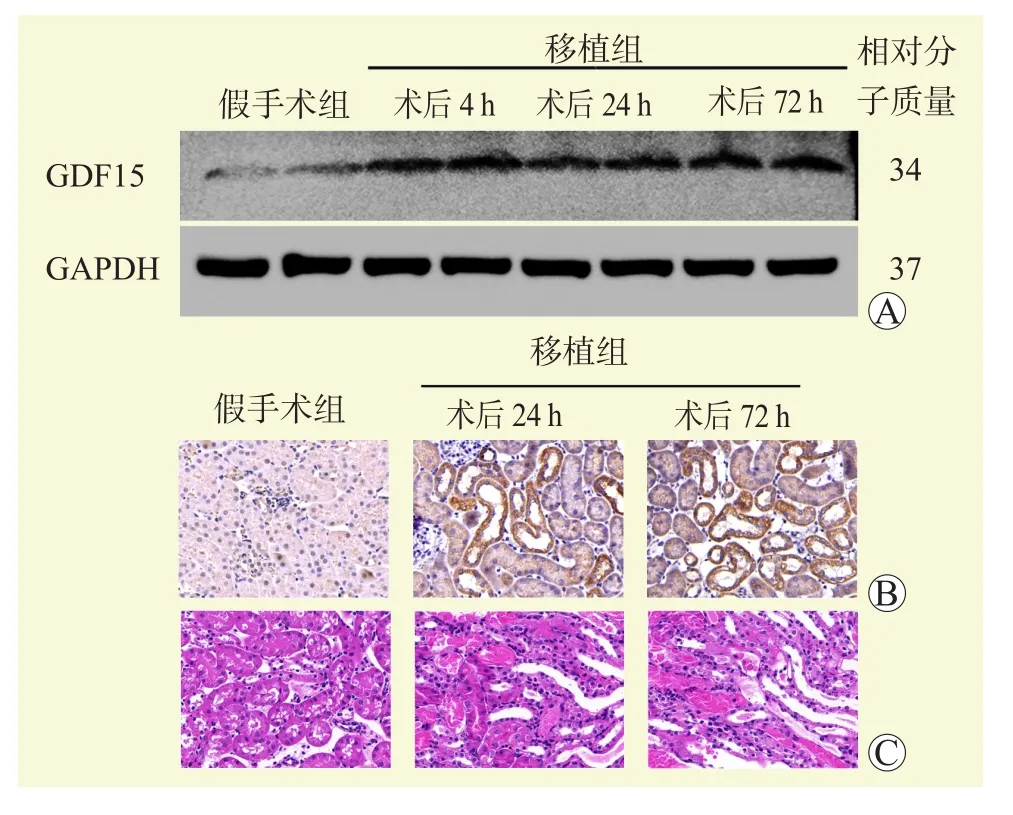
图3 各组小鼠肾组织GDF15蛋白的表达情况及病理学结果Figure 3 Expression of GDF15 protein and histopathological results of renal tissue in mice of each group
2.2 各组小鼠移植肾功能及术后病死率
与假手术组比较,移植组小鼠肾功能下降;与野生型移植组比较,GDF15敲除移植组小鼠血清肌酐、血尿素氮水平升高(均为P<0.05,图4A、B)。野生型移植组小鼠术后1周生存率为87.6%,GDF15敲除移植组术后1周生存率为41.8%(图4C)。

图4 各组小鼠术后肾功能及生存率Figure 4 Renal function and survival rate of mice in each group after operation
2.3 各组小鼠肾小管损伤情况
免疫组化结果显示,GDF15敲除移植组KIM-1表达更多(图5A)。HE染色结果显示,移植术后72 h,野生型移植组肾小管可见溶解或坏死,髓外和皮质中可见管型形成,而GDF15敲除移植组肾小管坏死及管型更加明显(图5B)。GDF15敲除移植组肾损伤评分更高(均为P<0.05,图5C)。
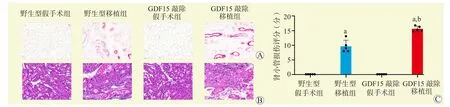
图5 各组小鼠肾小管损伤情况及肾小管损伤评分Figure 5 Renal tubular injury and renal tubule injury score of mice in each group
2.4 各组肾组织炎症细胞浸润及炎症因子表达
免疫组化结果显示,移植术后72 h,MPO和F4/80在移植肾中表达升高,且GDF15敲除移植组中炎症细胞浸润加重(图6A、B)。ELISA结果显示,与假手术组比较,移植组TNF-α、IL-1β和IL-6表达水平升高;与野生型移植组比较,GDF15敲除移植组TNF-α、IL-1β和IL-6表达水平升高(均为P<0.05,图 6C)。
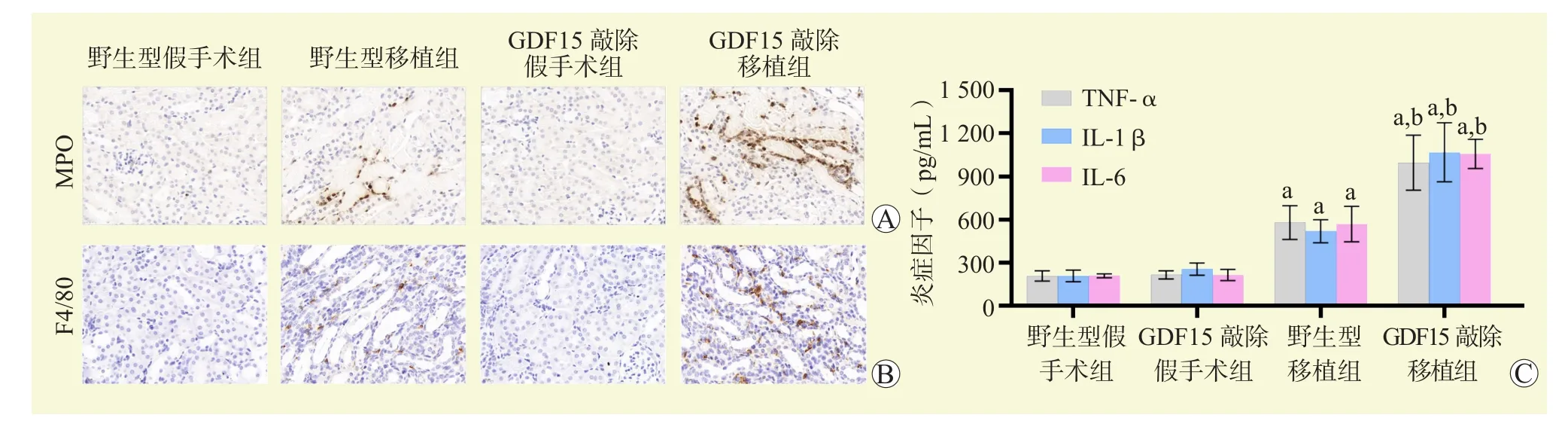
图6 各组肾组织炎症细胞浸润及炎症因子表达情况Figure 6 Inflammatory cell infiltration and expression of inflammatory factors in renal tissues of each group
2.5 各组肾组织TLR4、NF-κB表达情况
免疫荧光染色结果显示,移植组肾组织中TLR4、NF-κB表达较假手术组增多;GDF15敲除移植组肾组织中TLR4和NF-κB表达较野生型移植组增多(图7)。
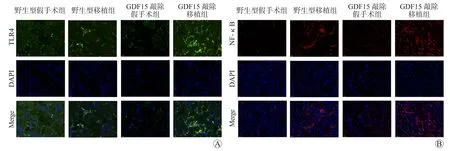
图7 各组肾组织TLR4、NF-κB表达情况(免疫荧光,×400)Figure 7 Expression of TLR4 and NF-κB in renal tissues of each group
3 讨 论
目前,世界范围内对于器官移植的需求大大超过了器官供给[4,21]。因此不得不放宽供者选择标准,如心脏死亡器官捐献供者,但其通常伴随着长时间的热缺血和冷缺血[4]。在这种情况下,供者缺血后近端肾小管细胞的损伤和破坏会引起急性肾小管坏死,继而激活炎症和免疫反应,导致肾功能进一步恶化和组织结构损伤[21-23]。肾脏IRI是导致DGF的重要危险因素,目前临床上尚无特效的药物用于预防或治疗IRI。GDF15在肾脏中主要表达于近端小管、Henle环和集合管,具有参与细胞间信号传导、激活特异性受体等功能[8-9]。GDF15是一种多效蛋白,在多种复杂疾病中发挥重要作用,其作为缺血性疾病的生物标志物已成为新药研发的新靶点[10-12],但GDF15对炎症的调控机制研究还不清楚。本研究利用肾移植IRI模型以及基因敲除手段,发现肾小管细胞GDF15在肾脏冷保存移植过程中被激活,且GDF15激活后可显著减轻肾移植IRI,促进肾功能恢复。
GDF15与肾移植的关系临床研究较少,有研究发现,GDF15的表达水平与AKI程度有关,也是造影剂肾病、慢性肾脏病进展的独立危险因素[22,24-26]。本研究发现,GDF15在移植肾标本中升高,主要表达在肾小管,且GDF15敲除增加了移植小鼠病死率,加重了移植肾IRI。这一发现为GDF15作为肾移植新治疗靶点提供了理论依据。值得关注的是,本研究及既往的实验研究均发现GDF15作为疾病进展过程中的炎症对抗因子,敲除或者抑制GDF15将加速疾病进展。我们发现GDF15敲除后明显加重移植肾炎性损伤。目前GDF15对炎症的调控机制研究还不清楚。GDF15能显著减轻LPS所诱导的脓毒症,TLR4是LPS最主要的受体[27]。另外有文献支持,TLR4-NF-κB信号通路在移植肾IRI中起到关键作用[23,28]。基于上述研究,我们推测GDF15可能通过抑制TLR4-NF-κB信号通路发挥作用,并使用GDF15敲除鼠进一步证实,结果发现GDF15敲除可促进移植中TLR4、NF-κB的表达,提示供体来源的GDF15具有抑制炎症的作用。因此,GDF15减轻移植肾IRI可能与抑制TLR4-NF-κB信号通路有关,但更为深入的分子生物机制仍有待进一步研究。
目前世界各研究机构和制药企业已针对GDF15为靶点进行了药物研究,涉及肥胖、肿瘤及厌食综合征等领域,利用其激活或抑制作用开发了各类药物,如GDF15类似物、GDF15融合蛋白、GDF15单克隆抗体、胶质细胞源性神经营养因子家族α样受体(glial cell line-derived neurotrophic factor family receptor alpha-like,GFRAL)拮抗剂单克隆抗体等[29-30],处于临床前或I期临床试验等不同阶段[11,25]。例如GDF15 Fc融合蛋白(AMG-171)治疗代谢综合征已经进入临床试验(NCT04199351);美国强生公司研发了GDF15受体GFRAL激动剂JNJ-9090,可通过促进产热、脂解以及氧化代谢发挥抗肥胖作用。GDF15相关药物对肾移植IRI的作用值得进一步研究。
综上所述,本研究建立了与临床移植过程更为贴合的小鼠肾移植模型,并利用基因敲除,首次发现GDF15是移植后肾小管损伤的关键性调节剂,可影响肾移植炎症反应。本研究为肾移植IRI提供了新的思路和实验依据,有望为今后找寻肾移植IRI的干预靶点提供参考。

