EBV脑脊髓炎合并GFAP特异性IgG抗体阳性1例报告
王璐璐,董露露,江 超,耿敏霞,李 爽,邢佳豪,王天俊
胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体由外周和中枢神经系统浸润性淋巴细胞产生,被认为是自身免疫性胶质纤维酸性蛋白星形细胞病的生物标志物,脑、脑膜、脊髓及视神经最易受累,对激素敏感。爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)感染所致脑脊髓炎是一种严重的中枢神经系统感染性疾病,EBV脑脊髓炎继发自身免疫反应在国内尚无报道,国外有极少数病例,值得引起神经医师的重视。本文报告1例EBV脑脊髓炎合并GFAP特异性IgG抗体阳性患者的诊疗过程,结合相关文献复习,以提高临床医师对EBV脑脊髓炎的认识。
1 病例资料
患者,男性,37岁,技术人员,因发热伴头疼1 w于2022年2月5日收入我院神经内科。患者入院前1 w出现发热,体温最高39 ℃,伴寒战,口服布洛芬可退热,后出现搏动性头疼,疼痛部位描述不详,疼痛评分3分,病程中患者反复发热,无咳嗽咽痛,精神、饮食及睡眠差,大小便正常。既往体健,发病前于南京出差2 d,病前有着凉史,否认高血压、糖尿病等病史,无外伤史、传染病史,家族史无特殊。
体格查体:体温38.9 ℃,心率127 次/min,呼吸20 次/min,血压118/74 mmHg(1 mmHg=0.133 kPa)。内科系统查体无异常。神经系统查体:高级皮质系统功能正常,神清语利,查体合作,双侧瞳孔正大等圆,对光反射灵敏,颅神经查体正常。四肢肌张力及肌力正常,四肢反射对称,腱反射(+),深浅感觉对称,颈抗阳性,距颏下3横指,双侧病理征及脑膜刺激征阴性。
入院后检查:入院前后共进行7次血常规(见表1)、3次腰椎穿刺术(见表2)检查,尿便常规、甲状腺功能、男性肿瘤全项、凝血5项、术前八项均正常。脑脊液墨汁染色、革兰氏染色、抗酸染色阴性。病毒10项:单纯疱疹病毒I(IgG)、风疹病毒IgG、巨细胞病毒IgG抗体均阴性。呼吸道病原体谱阴性。布氏杆菌凝集试验及结核感染T细胞检测均阴性。生化全项、风湿全套、类风湿全套、血沉均阴性。心脏超声、腹部超声等均未见异常。实时荧光定量PCR技术检测脑脊液(入院后7 d)EBV DNA为2.68×103拷贝/ml(正常参考范围<500 拷贝/ml);脑脊液(入院后7 d)标本通过宏基因组学第二代测序技术检出人疱疹病毒性4型(EB病毒):特异序列数22条,高置信区间。而脑脊液(入院后7 d)水通道蛋白4抗体(AQP4-Ab)、髓鞘少突胶质细胞糖蛋白抗体(MOG-Ab)、胶质纤维酸性蛋白抗体(GFAP-IgG)抗体均阴性。影像学检查:头部平扫+DWI+ADC(见图1)提示双侧大脑半球皮质及白质区多发斑片状长T1、长T2信号影,Flair高信号影;病灶处DWI明显高信号影,ADC明显信号减低。颈椎核磁增强(见图2)提示颈2-5椎体水平颈髓内小斑片状强化灶。脑膜CUBE强化(见图2):左侧小脑幕及左侧中央后回皮质明显强化。头部+体部PET(见图3):全段脊髓弥漫不均匀代谢增高。
诊疗过程:本例患者急性起病,起病初期出现发热、头痛等神经系统症状,3次脑脊液检查均符合病毒性脑脊髓炎特点,脑脊液病原学检查证实EBV,影像学提示脑、脊髓等部位均受累,结合入院后第4天出现排尿困难等神经系统并发症,予以抗病毒治疗后患者症状缓解,支持EBV病毒性脑脊髓炎。予以更昔洛韦0.375 g每12 h 一次抗病毒治疗后患者体温仍持续升高,因目前暂未排除自身免疫性疾病,故暂应用丙种免疫球蛋白[0.4 g/(kg·d)]静点,而后患者体温逐渐降至正常。入院后第10天患者体温再次升至38.1 ℃,后转至上级医院诊治,查脑脊液(转院后2 d)GFAP-Ab为强阳性,再次给予丙种免疫球蛋白及继续抗病毒治疗,患者病情逐渐改善,目前未再发热头痛,可正常工作。
2 讨 论
EBV又称人类疱疹病毒4型(human herpesvirus 4,HHV-4),可直接侵入神经系统,如脑膜、脑、脊髓及周围神经等[1]。EBV感染可引起脑炎、脑膜炎及脊髓炎,其中以脑炎和脑膜炎较为多见,脊髓炎少见。多数EBV脑脊髓炎患者急性起病,临床表现各样,包括头痛、发热、肢体无力、肌肉抽搐等[2]。脑脊液EBV DNA的PCR检测具有敏感性和特异性,目前已作为EBV中枢神经系统感染诊断的首选方法[3]。此外,脑脊液检查也可作为EBV脑脊髓炎与其他脑脊髓炎鉴别标准之一,EBV脑脊髓炎的脑脊液特点为压力增高,白细胞数增多(正常<200×106/L),且以淋巴细胞增多为主,蛋白质轻度增高(总<200 g/L),糖及氯化物含量正常。该病病程一般较短,并发症少,预后良好。

表1 患者入院前后血常规结果
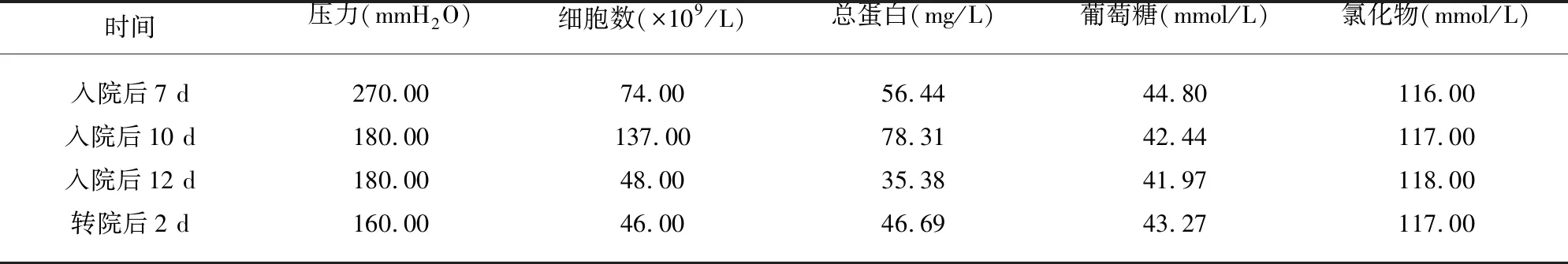
表2 患者入院前后脑脊液结果

A、B示双侧大脑半球皮质及白质区多发斑片状长T1、长T2信号影,Flair高信号影;C、D示病灶处DWI明显高信号影,ADC明显信号减低
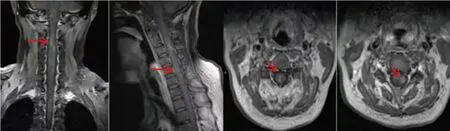
颈2-5椎体水平颈髓内小斑片状强化灶

A、B均可见左侧小脑幕及左侧中央后回皮质明显强化 A为全段脊髓弥漫不均匀代谢增高;B为颈髓代谢增高 图3 脑膜CUBE强化 图4 头部+体部PET
本例患者在我院查脑脊液基因二代测序提示EBV高置信区间,但查脑脊液GFAP特异性IgG抗体阴性,而转入上级医院再次查GFAP特异性IgG抗体为强阳性,我们进一步思索,起初GFAP特异性IgG抗体阴性是否为EBV脑脊髓炎临床前期的表现,随着病程的延长,GFAP特异性IgG抗体具有转阳的可能性。据报道,EBV脑脊髓炎的发生可与自身免疫反应有关,如GFAP星形细胞病。Rutkowska等[4]通过EBV诱导基因2(Epstein-Barr virus inducible gene 2,EBI2)敲除小鼠试验发现EBI2激活在星形胶质细胞中可刺激细胞外信号调节激酶(ERK)磷酸化及Ca2+信号转导通路诱导细胞迁移,且首次证明EBI2在星形胶质细胞中可调节相关受体,对中枢神经系统感染性疾病诊断及治疗方面具有重要作用。GFAP主要分布于中枢神经系统的星形胶质细胞,参与细胞骨架构成,在维持细胞形态、调节细胞突触功能和保持血脑屏障完整性等方面具有重要意义。故笔者推测,GFAP通过参与构成星形胶质细胞的形成,为EBI2的激活及受体调节等方面奠定基础。分析本例患者GFAP特异性IgG抗体阳性可能是由于EBV感染后触发产生。
自身免疫性GFAP星形细胞病是一种中枢神经系统自身免疫性疾病,可由病毒或肿瘤感染引起,病因尚不明确。血清或脑脊液GFAP特异性IgG抗体阳性是自身免疫性GFAP星形细胞病诊断的特异性指标[5]。其发病年龄常在40岁以上,以女性居多,临床特点可出现发热、头痛、视力下降及自主神经功能障碍等症状。头部磁共振可见多发病灶,常累及大脑白质、基底节、脑干、小脑、脑膜等,为自身免疫性GFAP脑脊髓炎特征性改变。该病可与视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)相鉴别,NMOSD患者多有视神经受损和横贯性脊髓炎表现,并有反复发作性病程,脊髓核磁提示病灶超过3个脊柱节段,且NMO-lgG抗体阳性,本例患者不符,故排除。本例患者头部MRI显示双侧大脑半球多发病灶,头+脊髓PET显示全段脊髓不均匀代谢增高。经多项研究表明,病毒感染是诱发自身免疫性脑脊髓炎的机制,目前报道相关病毒性有单纯疱疹病毒、流感病毒、EBV等,其中以单纯疱疹病毒最为常见。本例为EBV感染继发GFAP特异性IgG抗体阳性脑脊髓炎,临床较为少见,分析其发病机制可能是EBV感染致神经元破坏,神经元表面抗原暴露造成机体免疫耐受失衡,进而引发自身免疫反应。此外,由于非特异性B细胞激活或分子模拟参与,可能EBV与GFAP受体存在共同的抗原表位,病毒性感染引发B细胞激活并产生病毒性抗体发生交叉反应,从而导致自身免疫性脑脊髓炎的发生[6]。
相关文献报道EBV脑脊髓炎可与EBV脑炎治疗方法一致。抗病毒药物更昔洛韦可抑制EBV复制,但其在治疗EBV相关疾病尚无证据支持。目前应用肾上腺皮质激素尚存在争议,Adachi等[7]发现激素对EBV脑脊髓炎患者有效,但需长期应用,停药会再次复发。Eveline等[8]发现EBV编码的BamHI-A区域的早期基因可在免疫逃避中创建微环境,通过编码粒细胞-巨噬细胞集落刺激因子杀死肿瘤细胞。Ke等[9]发现静脉或联合鞘内注射利妥昔单抗均可取得较好疗效,其原因可能与炎症导致血脑屏障开放,有利于利妥昔单抗的通透有关。除此之外,营养神经细胞药物及功能康复治疗也是必不可少。
综上所述,当我们在临床上遇到颅内感染引发的脑、长节段脊髓病变时需考虑EBV感染,目前自身免疫性GFAP星形细胞病和EBV脑脊髓炎之间的关联性和治疗方案尚未明确,提示我们在今后的临床工作中应不断地发现总结。

