基于高效液相色谱法分析不同品种马铃薯中可溶性糖含量
杨志国,李彩林,王亮
(山西农业大学(山西省农业科学院)食品科学与工程学院(农产品贮藏保鲜研究所),山西 太原 030031)
马铃薯(Solanum tuberosum L.)是茄科茄属的一年生草本植物,其可食块茎又被称为土豆、山药蛋、洋山芋等[1-2]。马铃薯是世界第三大重要的粮食作物,超4 500种马铃薯种植于160多个国家,年产量达3.70亿t,为全球13亿人口的主食[3-7]。我国是世界上最大的马铃薯生产国和消费国,2018年马铃薯种植面积和产量分别为491万hm2和0.92亿t,占全球比例的28.34%和24.80%[8]。山西作为我国马铃薯主产地之一,马铃薯常年种植面积可达26.67万hm2,相关产业亦逐年发展壮大[9-10]。
马铃薯营养丰富,不仅富含碳水化合物和蛋白质,还含有各种矿质元素、维生素和膳食纤维等[11-13]。相对于鲜食,马铃薯加工产品显得更加重要[14-16],全球50%的马铃薯是加工后消耗的[5]。然而,在我国马铃薯主要用来鲜食,加工率远低于欧美等发达国家[17-19],这也是我国马铃薯产业发展滞后和人均消费量较低的主要原因。结合现有国情和产业发展现状,我国于2015年提出马铃薯主粮化战略,鼓励对马铃薯进行主食化加工利用[20-22]。研究表明,马铃薯品种间加工特性差异显著[23-24],其中可溶性糖是马铃薯食用品质和加工过程的重要指标之一[17,25]。通常可溶性糖含量高的马铃薯适宜鲜食,而加工用薯则要求低可溶性糖,以防止加工变色,提高转化效率[26]。研究发现,贮藏期间的低温环境,也会造成马铃薯还原糖急剧增加,出现“低温糖化”现象,严重影响加工品质[27-28]。此外,地域和环境对马铃薯可溶性糖含量也有重要影响[29-30],因此准确测定特定种植区域马铃薯中可溶性糖含量对其开发和利用具有重要价值。
目前测定马铃薯可溶性糖的方法主要基于碱性条件下对糖的氧化,且往往要求高温显色,如蒽酮试剂法[26]、斐林试剂法[17]、3,5-二硝基水杨酸法[12]等。虽然这些方法操作简单,但均不能对可溶性糖的种类进行测定。利用高效液相色谱法不仅可以对样品中可溶性糖的种类和含量进行测定,而且该法还具有样品提取操作简单、无需衍生化、灵敏度高、检测结果准确等优点[31-32]。近年来该方法已被应用于苹果[33]、梨[34]、桔子[35]、桃[36]、甘薯[37]、南瓜[38]等果蔬中可溶性糖的检测,但此法运用在马铃薯上鲜有报道。
本文建立了一种利用高效液相色谱-示差检测器法测定马铃薯中可溶性糖含量的方法,并对山西省的17个马铃薯品种中可溶性糖含量进行了分析,旨在为山西省马铃薯的加工利用提供一定依据。
1 材料与方法
1.1 材料与试剂
试验用马铃薯由山西农业大学高寒区作物研究所国家产业体系大同马铃薯试验站提供。17个品种分别为冀张8号、甘引4号、青薯9号、大同里外黄、中加2 号、大西洋、希森 6 号、M13、彩薯、夏波蒂、V7、晋薯15号、同薯20号、丽薯6号、雪川红、希森9号和晋薯16号。收获块茎后,于15℃黑暗通风环境下愈伤15 d后,选择大小一致的马铃薯去皮取肉用液氮冷冻并于-80℃冰箱中保存备用。
葡萄糖、果糖、麦芽糖、蔗糖标准品:美国Sigma-Aldrich公司;乙腈(色谱纯):德国Merck公司;超纯水:由Ming-CH24UV超纯水机制备。
1.2 仪器与设备
1200高效液相色谱仪、ZORBAX Carbohydrate柱(4.6 mm×250 mm,5 μm):美国 Agilent公司;Ming-CH24UV超纯水机:德国Merck Millipore公司;AS10200AH型超声波清洗器:天津奥特赛恩斯仪器有限公司;Allegra X-30R Centrifuge高速冷冻离心机:美国Beckman Coulter公司;CP224S电子分析天平:德国Sartorius公司;A11 basic液氮研磨机:德国IKA公司;0.45 μm微孔滤膜:天津津腾实验设备有限公司。
1.3 方法
1.3.1 样品处理
参照Wu等[35]的方法并略作修改,精确称取用液氮研磨仪研磨后的马铃薯样品2.00 g于50 mL离心管中,加入10 mL超纯水置于超声清洗器中提取50 min,10 000 r/min离心10 min后上清液过滤到25 mL容量瓶中,残渣中再加入10 mL超纯水提取,合并上清液,用超纯水定容后过滤备用。
1.3.2 标准溶液的配制
先单独称取4种可溶性糖标准品各少许,分别溶于超纯水后制成单标溶液,用于测定各可溶性糖的保留时间。再分别精密称取蔗糖、果糖、麦芽糖0.100 0 g和葡萄糖0.200 0 g(精确至0.000 1 g),用超纯水溶解后定溶于10 mL容量瓶中作为混合标准溶液母液,备用。
1.3.3 色谱条件
ZORBAX Carbohydrate色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈∶水(70∶30,体积比),等度洗脱;柱温35℃,流速0.9 mL/min;进样量20 μL;检测池温度35℃。
1.3.4 标准曲线绘制
将1.3.2配制的标准母液精确稀释为0.05、0.1、0.2、0.5、1.0、2.0、4.0 mg/mL 的系列混合标准溶液,经0.45 μm滤膜过滤后,在1.3.3色谱条件下测定并计算峰面积,每个浓度重复3次。以浓度为横坐标,峰面积为纵坐标建立标准曲线。
1.3.5 精密度检测
取1.3.4中配制好的可溶性糖混合标准溶液,在1.3.3的色谱条件下重复进样5次,记录4种可溶性糖的峰面积,并计算其相对标准偏差(relative standard deviation,RSD)。
1.3.6 重复率检测
按照1.3.1的方法,平行制备马铃薯样品溶液5份,在1.3.3的色谱条件下进样测定,根据峰面积计算4种可溶性糖的RSD。
1.3.7 稳定性检测
按照1.3.1的方法制备1份马铃薯样品溶液,在室温下放置 0、2、4、12、24 h 后,在 1.3.3 的色谱条件下注入高效液相色谱仪中进行分析,计算4种可溶性糖的峰面积和RSD。
1.3.8 回收率检测
按照1.3.1的方法制备1份马铃薯样品溶液,等体积取4份分别加入适量可溶性糖标准品,在1.3.3的色谱条件下进样测定,利用外标法定量并计算平均回收率。
1.3.9 可溶性糖、还原糖的计算方法
各可溶性糖含量结果以鲜重计。可溶性糖含量=果糖含量+葡萄糖含量+蔗糖含量+麦芽糖含量。还原糖含量=果糖含量+葡萄糖含量+麦芽糖含量。
1.4 数据处理
数据分析及处理采用Excel和SPSS 22软件;表格制作采用Excel。
2 结果与分析
2.1 可溶性糖标准品与马铃薯样品高效液相色谱分析
4种可溶性糖高效液相色谱图见图1。

图1 4种可溶性糖高效液相色谱图Fig.1 High performance liquid chromatogram of 4 kinds of soluble sugars
从图1和图2中可以看出,在1.3.3色谱条件下马铃薯样品和可溶性糖标准品均得到良好的分离,且样品中可溶性糖的出峰时间为果糖7.565 min、葡萄糖8.138 min、蔗糖 9.871 min、麦芽糖 11.044 min,标准品的出峰时间为果糖7.650 min、葡萄糖8.235 min、蔗糖10.015 min、麦芽糖11.511 min,马铃薯样品的出峰时间较标准品稍早一些。

图2 马铃薯样品高效液相色谱图Fig.2 High performance liquid chromatogram of potato samples
2.2 可溶性糖标准曲线
表1为4种可溶性糖的标准曲线方程、相关系数及线性范围。
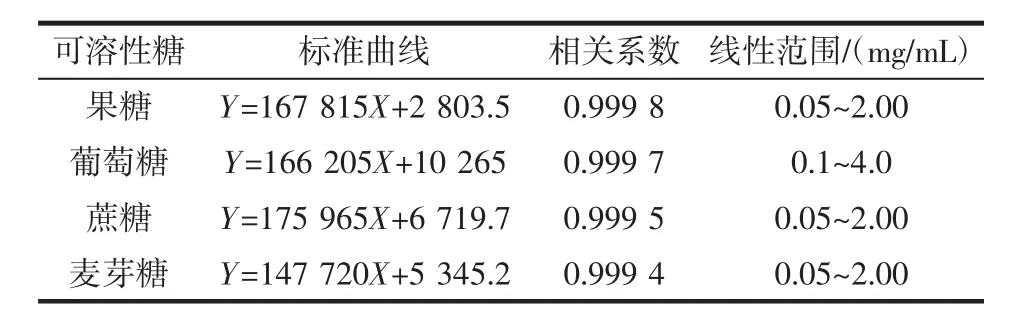
表1 4种可溶性糖标准曲线方程、相关系数及线性范围Table 1 Standard curve equations,correlation coefficients and linear range of 4 kinds of soluble sugars
如表1所示当线性范围在0.05 mg/mL~4.0 mg/mL时,标准曲线的相关系数均达到0.999以上,表明该方法良好。
2.3 精密度检测
表2为4种可溶性糖精密度测定结果。
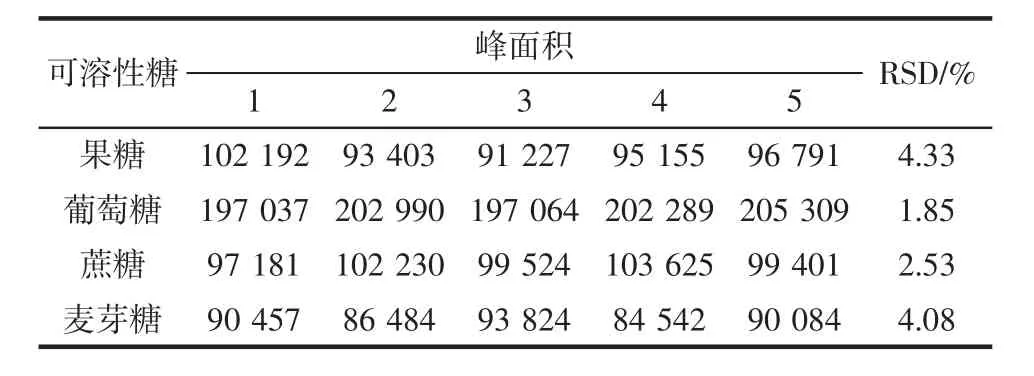
表2 4种可溶性糖精密度(n=5)Table 2 Precision of 4 kinds of soluble sugars(n=5)
表2结果显示:果糖、葡萄糖、蔗糖、麦芽糖的RSD值分别为4.33%、1.83%、2.53%、4.08%,均小于5%,表明该方法的精密度良好。
2.4 重复性检测
表3为4种可溶性糖重复性测定结果。

表3 4种可溶性糖重复性(n=5)Table 3 Repeatability of 4 kinds of soluble sugars(n=5)
从表3中可以看出,果糖、葡萄糖、蔗糖、麦芽糖的相对标准偏差RSD值分别为4.34%、3.01%、3.58%、4.17%,均小于5%,说明该方法的重复性达到分析要求。
2.5 稳定性检测
表4为4种可溶性糖稳定性测定结果。

表4 4种可溶性糖稳定性(n=5)Table 4 Stability of 4 soluble sugars(n=5)
由表4可知,果糖、葡萄糖、蔗糖、麦芽糖的RSD值分别为 2.24%、3.20%、4.73%、3.68%,均小于5%,说明马铃薯样品溶液在24 h之内是稳定的。
2.6 回收率检测
4种可溶性糖回收率测定结果见表5。

表5 4种可溶性糖回收率测定Table 5 Recovery rate of 4 kinds of soluble sugars
由表5可知,4种可溶性糖的回收率为96.00%~104.44%,RSD均小于5%,表明该检测方法的回收率良好,测定结果准确性较高。
2.7 17种马铃薯可溶性糖含量分析
17个马铃薯品种可溶性糖含量见表6。
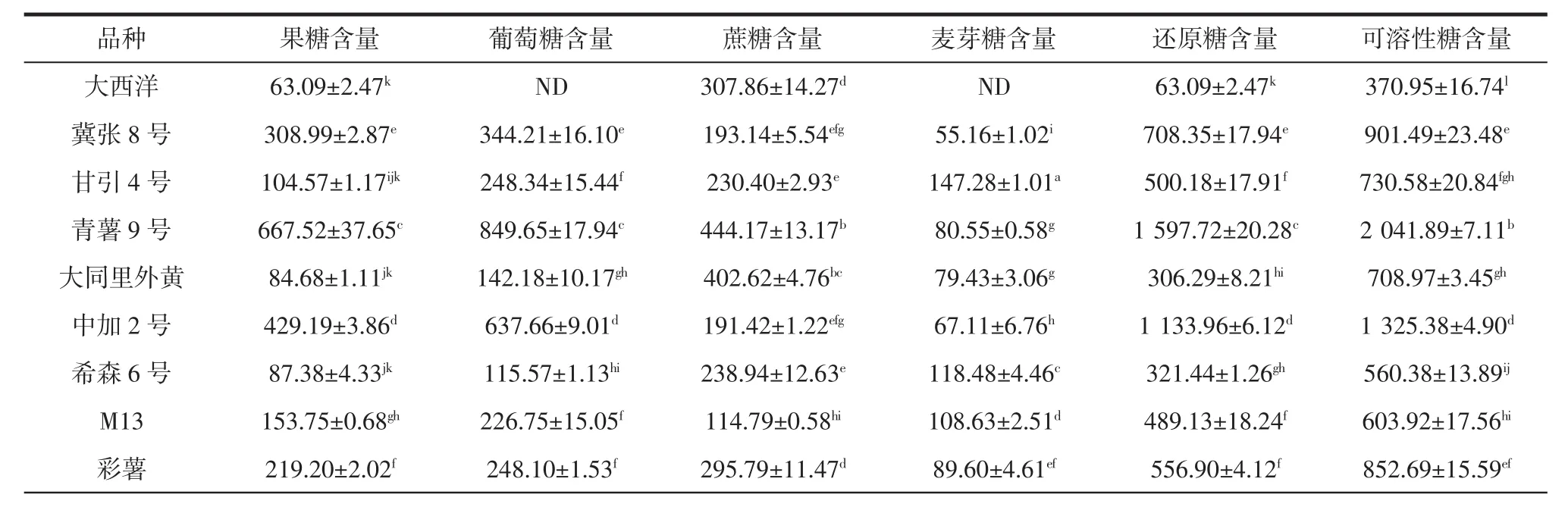
表6 17个马铃薯品种可溶性糖含量(n=3)Table 6 The soluble sugar content of 17 varieties of potatoes(n=3)mg/100 g

续表6 17个马铃薯品种可溶性糖含量(n=3)Continue table 6 The soluble sugar content of 17 varieties of potatoes(n=3)mg/100 g
从表6中可以得出,17种马铃薯中可溶性糖组分相似,基本上均检测出4种可溶性糖。各种可溶性糖、还原糖以及各可溶性糖组分的变异系数除麦芽糖为52.71%外,其余均为90%以上,说明17种马铃薯可溶性糖含量差异较大。这与Duarte-Delgado等[39]的研究结果一致。但是Choi等[40]对6个不同品种马铃薯的研究却发现各可溶性糖组分含量在品种间差异较大,但可溶性糖含量却没有观察到相同程度的变化。高佳等[26]采用传统的蒽酮试剂法检测了川中丘陵区马铃薯可溶性糖含量,结果表明10个品种间可溶性糖含量的变异系数仅为17.16%,差异较小。
17种马铃薯可溶性糖的含量为370.95 mg/100 g~4 497.24 mg/100 g。其中大西洋的含量最低,仅为370.95 mg/100 g,其次是夏波蒂和雪川红,分别为404.08 mg/100 g和459.03 mg/100 g。希森9号、青薯9号、晋薯16号和中加2号的可溶性糖含量相互之间差异显著(P<0.05),且显著高于其他品种(P<0.05)。其中希森9号的含量最高,高达4 497.24 mg/100 g,是含量第二高的青薯9号(2 041.89 mg/100 g)的2.20倍,是大西洋的13.48倍。
马铃薯还原糖在高温条件下会发生美拉德反应,明显影响其食品加工产品的色泽、味道,同时还会形成丙烯酰胺等有害物质,是要求最为严格的指标之一[7,25]。17种马铃薯还原糖含量为 63.09 mg/100 g~2 727.03mg/100g,占可溶性糖含量的17.01%~98.64%。其中大西洋还原糖含量仅为63.09 mg/100 g,显著低于其他品种(P<0.05);其次是夏波蒂和晋薯15号,分别为181.08 mg/100 g和241.63 mg/100 g。希森9号还原糖含量为2 727.03 mg/100 g,显著高于其他品种(P<0.05);晋薯16号、青薯9号、中加2号和冀张8号次之。大西洋和夏波蒂是目前国内用于油炸薯片和薯条加工的主要品种[17]。本研究发现除大西洋和夏波蒂外,晋薯15号还原糖的含量也低于0.3%,符合薯条加工要求[41],可作为薯片薯条等油炸加工的原料品种。孙莎莎等[17]研究发现,直接滴定法测得的希森6号还原糖含量低于夏波蒂,且薯条加工产品感官评价二者之间无显著差异。而本研究中,希森6号还原糖含量显著高于夏波蒂(P<0.05),这可能是因为测量方法或生长环境不同导致的。对于还原糖含量较高的品种,尤其是还原糖含量低于0.4%的大同里外黄、希森6号、丽薯6号、雪川红和V7可以通过蒸煮方式加工[42],或采用辐照、超声波等非热技术预处理后再油炸加工[7],以避免或减少加工过程中有害物质的产生。
表6显示各可溶性糖组分中,17种马铃薯中均检测到蔗糖,晋薯15号中未检测到果糖、大西洋中未检测到葡萄糖和麦芽糖、雪川红中未检测到麦芽糖。其余品种中果糖含量为63.09 mg/100 g~1 272.67 mg/100 g,占还原糖含量的20.91%~100%,占可溶性糖含量的 11.95%~40.10%;葡萄糖含量在33.11 mg/100 g~1 409.66 mg/100 g之间,占还原糖含量的18.28%~62.24%,占可溶性糖含量的8.19%~56.37%;麦芽糖含量为40.29 mg/100 g~147.28 mg/100 g,占还原糖含量的1.64%~44.82%,占可溶性糖含量的0.99%~24.96%;蔗糖含量在25.11 mg/100 g~1 770.21 mg/100 g,占可溶性糖含量的1.36%~82.99%。各品种中,希森9号的果糖、葡萄糖、蔗糖的含量均最高(P<0.05),而麦芽糖含量最高的是甘引4号(P<0.05);大西洋的果糖、葡萄糖、麦芽糖含量较低或低于检测线,晋薯16号的蔗糖含量最低(P<0.05)。
3 结论
本研究证明,采用Agilent NH2色谱柱,在流动相为乙腈∶水(70∶30,体积比),流速 0.9 mL/min,柱温及检测池温度35℃的条件下,马铃薯中的果糖、葡萄糖、蔗糖、麦芽糖在15 min内得到良好的分离,且标准曲线呈现良好的线性关系,重复率、稳定性、回收率的RSD值也均在5%以内,说明利用该方法对马铃薯中可溶性糖进行测定分析是可行的。不同品种马铃薯中可溶性糖组分相似,基本上均检测出了4种可溶性糖。但各品种可溶性糖含量差异较大,其中希森9号和青薯9号的可溶性糖含量较高,而大西洋、夏波蒂和雪川红的含量较低。对于还原糖含量而言,大西洋显著低于其他品种,希森9号显著高于其他品种。

