胃腺癌乳腺转移18F-FDG PET/CT 显像一例
彭小娟 寇莹 李川 程祝忠
四川省肿瘤医院·研究所核医学科,四川省癌症防治中心,电子科技大学医学院,成都 610041
转移性乳腺癌的原发灶主要见于淋巴瘤和黑色素瘤,而胃癌转移至乳腺的发生率仅为0.5%~1.2%[1-2]。原发性胃癌仅伴乳腺及腋窝淋巴结转移在临床中罕见,且18F-FDG PET/CT 影像学征象不典型,在临床中容易误诊。我们报道了1 例胃腺癌乳腺转移18F-FDG PET/CT 显像的病例,从临床表现、18F-FDG PET/CT 影像学表现、病理诊断及鉴别诊断等方面分析了该病的特点,旨在拓宽临床实践中的经验,提高对此类疾病诊断的准确率。
1 患者资料
患者女性,45 岁,因“右乳肿块2 月余”至四川省肿瘤医院就诊。体格检查:双乳基本对称,右乳头无凹陷、溢液,皮肤未见“酒窝征”或橘皮外观。右乳距乳头3 cm 处可扪及1 个大小约5.0 cm×4.0 cm 质韧肿块,边界欠清,欠活动,无压痛;左乳未扪及肿块;双侧腋窝及双侧锁骨上未扪及肿大淋巴结。乳腺X 线摄影检查结果显示:右乳头皮肤后上方见边界不清肿块影,邻近腺体内有少许点状钙化,右乳晕皮肤较对侧增厚,右侧乳头凹陷,见漏斗征(图1A),乳腺影像报告和数据系统(BI-RADS)4c 类;右腋下淋巴结增大。胸部CT 平扫提示双肺内散在小结节。进一步行右乳占位穿刺,组织病理学检查结果为低分化癌,倾向腺癌,免疫表型不能排除消化道来源可能,且乳腺相关肿瘤标志物均为阴性(图2A)。肿瘤细胞免疫表型:角蛋白(cytokeratin, CK)p(++)、CK7(+)、CK20(++)(图2B)、GATA 结合蛋白3(-)(图2C)、SOX10(-)、p63(-)、CD34(-)、ERG(-)、白细胞共同抗原(LCA,-)、细胞增殖核抗原Ki-67(+, 50%)、CDX2(++)、绒毛蛋白(villin,++),连环蛋白P120(浆+)、E 黏附蛋白(E-ca, -)、雌激素受体(ER, -)(图2D),孕激素受体(PR, -)(图2E)、CerbB-2(0)、CK5/6(-)、AR(-)、p53(++)、乳球蛋白(-)、CKh(34βE12)(个别弱+)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)。右腋窝淋巴结穿刺组织病理学检查结果如图2所示:见少许癌细胞,符合转移。因患者双肺有数个小结节,请胸外科会诊后不能排除转移,建议行18F-FDG PET/CT检查评估全身情况。18F-FDG PET/CT 显像结果显示:右乳外上象限有局灶性摄取稍增高灶,相应部位密度稍高(图3B、C);右乳皮肤摄取稍增高(图3D、E);双侧乳腺呈弥漫性摄取增高,SUVmax=2.2。右侧腋窝见大小13 mm×7 mm 淋巴结,摄取稍高(图3F、G);胃小弯局部摄取增高(图3H、I)。胸部多发小结节,部分呈簇状分布,部分紧贴胸膜,均未见明显摄取增高(图4A~C),考虑为炎性。因乳腺免疫组织化学检查结果提示原发灶可能来源于消化道,故进一步行胃镜检查,结果显示,胃体见一火山口样新生物隆起,中央凹陷,附着白胎,边界不清,取活检经组织病理学检查诊断为胃腺癌(图2F),肿瘤细胞免疫表型:SATB2(个别阳性)、CK7(部分+),CK20(+)(图2G)、GATA 结合蛋白3(-)(图2H)、CDX2(+)(图2I)、CerbB-2(0)、彩蛋白(MUC)2(-),乳球蛋白(-)、巨大囊肿病液体蛋白(gross cystic disease fluid protein,GCDFP)15(-)(图2J)、ER(-)、PR(-)、GATA 结合蛋白3(-),考虑为胃腺癌原发。全院多学科诊疗讨论后考虑为胃低分化腺癌伴右乳、右侧腋窝淋巴结转移[人表皮生长因子受体(HER)2 为阴性,Ⅳ期],建议以全身治疗为主。患者接受静脉滴注多西他赛60 mg(1 d)+静脉注射氟尿嘧啶3 400 mg+静脉滴注顺铂60 mg(2 d) ,化疗3 个周期。化疗后复查乳腺X 线摄影检查结果显示:右乳头皮肤后上方约2.0 cm 处有不规则结节影,较前缩小、密度较前减低(图1B),乳腺影像报告和数据系统(BI-RADS)6 类;右腋下小淋巴结较前缩小。胸部CT 复查结果显示:胸部小结节未见明显变化(图4D~F)。评估治疗有效后继续上述方案化疗3 个周期。之后,对患者行规律治疗。
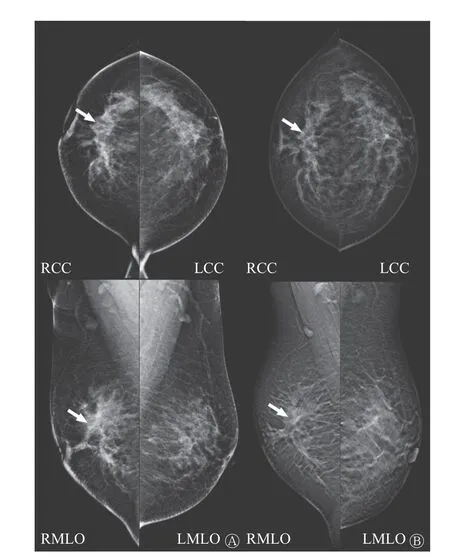
图1 胃腺癌乳腺转移患者(女性,45 岁)的乳腺X 线摄影图 A 为治疗前,可见右乳头后上方边界不清肿块影(箭头所示);B 为治疗后,可见右乳肿块较前缩小(箭头所示)。RCC 为右侧乳腺正位;LCC 为左侧乳腺正位;RMLO 为右侧乳腺斜位;LMLO 为左侧乳腺斜位Figure 1 Mammogram of a patient (female, 45 years old) with breast metastasis of gastric adenocarcinoma
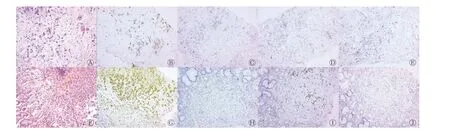
图2 乳腺转移性癌和胃原发低分化腺癌的组织病理学检查、免疫组织化学染色检查图(×100) A 为乳腺组织的组织病理学检查(苏木精-伊红染色);B~E 为乳腺组织的免疫组织化学染色检查,抗体分别为角蛋白20(++)、GATA 结合蛋白3(-)、雌激素受体(-)、孕激素受体(-);H 为胃体的组织病理学检查(苏木精-伊红染色);G~J 为胃体的免疫组织化学染色,抗体分别为角蛋白20(+)、GATA 结合蛋白3(-)、CDX2(+)、巨大囊肿病液体蛋白15(-)Figure 2 Histopathological examination and immunohistochemical examination of metastatic carcinoma of the breast and primary hypofractionated adenocarcinoma of the stomach
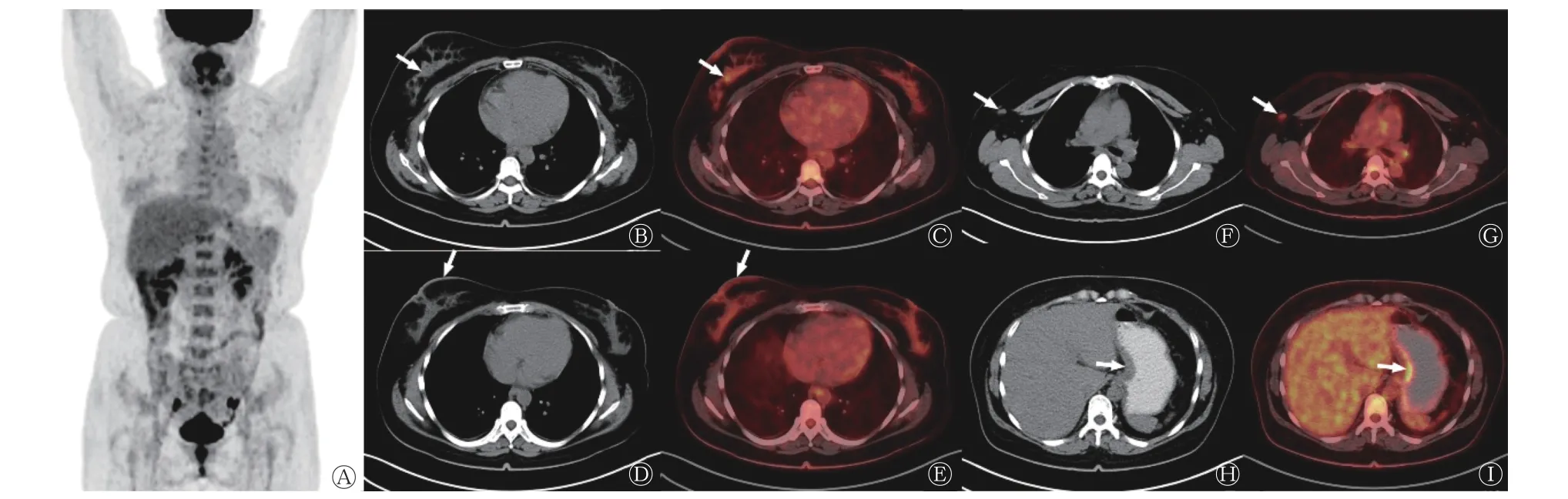
图3 胃腺癌乳腺转移患者(女性,45 岁)的18F-FDG PET/CT 显像图 A 为最大密度投影图,可见右乳、右腋窝及胃代谢稍增高灶,双侧卵巢生理性摄取;B、C 示右乳外上象限局灶性摄取稍增高灶,相应部位密度稍高(箭头所示),SUVmax=2.4;D、E 示右乳皮肤增厚,右侧乳头凹陷,右乳皮肤摄取增高(箭头所示),SUVmax=2.3;F、G 示右侧腋窝淋巴结摄取增高(箭头所示),SUVmax=1.7;H、I 示胃小弯局部摄取增高(箭头所示)SUVmax=3.4,其中B、D、F、H 为CT 检查图;C、E、G、I 为PET/CT 显像图。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;SUVmax 为最大标准化摄取值Figure 3 18F-FDG PET/CT imaging of a patient (female, 45 years old) with breast metastasis of gastric adenocarcinoma
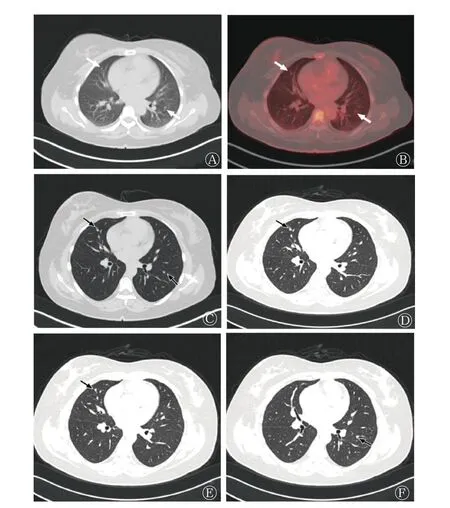
图4 胃腺癌乳腺转移患者(女性,45 岁)的18F-FDG PET/CT 显像图与3 个月后复查胸部的CT 检查图 A、B 分别为CT 、PET/CT 图,示胸部多发小结节(白色箭头所示);C 为诊断剂量CT 图,示胸部多发小结节,部分呈簇状分布,部分紧贴胸膜(黑色箭头所示);D、E、F 为3 个月后复查胸部薄层CT 图(3 个不同层面),示胸部小结节无明显变化。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术Figure 4 18F-FDG PET/CT imaging and chest routine scan of a patient (female, 45 years old) with breast metastasis of gastric adenocarcinoma
2 讨论
本例患者特点为胃腺癌仅伴乳腺、腋窝淋巴结转移,临床罕见且18F-FDG PET/CT 影像学征象不典型。据报道,转移性乳腺癌的原发灶主要见于淋巴瘤和黑色素瘤,而胃癌转移至乳腺的发生率仅为0.5%~1.2%[1-2]。
本例患者的18F-FDG PET/CT 影像学征象不典型,具体表现:作为原发灶胃腺癌的PET/CT 显像仅表现为胃壁局部增厚伴轻度18F-FDG 摄取增高,具有此征象的可以为炎性、肿瘤,甚至为生理性改变,同时未见胃局部淋巴结转移的间接证据,诊断胃癌的证据不足。临床上,胃壁局部收缩和胃充盈不佳是引起胃壁局限性摄取增高的常见原因,有研究结果显示,喝水充盈胃后可以减少此干扰[3]。本例患者胃充盈良好,基本可排除局部生理性摄取。但18F-FDG PET/CT 对胃癌,特别是印戒细胞胃癌的诊断价值有限,病灶低摄取不能排除不是胃癌,病灶高摄取也不能诊断是胃癌,故对其诊断难度较高,但可提示临床行胃镜检查,帮助排除恶性病变。
其次,本例患者的转移灶18F-FDG PET/CT 影像学征象不典型,乳腺转移灶的主病灶与增生的腺体分界不清,仅伴皮肤稍增厚及局灶性18F-FDG 摄取轻度增高,根据此征象可考虑原发性乳腺癌、乳腺炎,较难推断乳腺转移。此外,右侧腋窝梭形淋巴结增大,摄取轻度增高,也很难诊断为转移灶。原发性乳腺癌以导管内癌和小叶内癌多见,常表现为乳腺肿块,好发于外上象限,MRI 检查病灶呈稍长T1、稍长T2 信号,弥散加权成像(DWI)弥散受限,动态增强扫描通常呈速升平台型或速升速降型,累及皮肤时可见局部皮肤增厚;PET/CT 表现为乳腺肿块伴有分叶征、毛刺征,导管内癌病灶通常呈高摄取,且T/NT>6.5[4-5],小叶内癌病灶摄取较导管内癌病灶稍低,皮肤受累时,局部皮肤摄取增高。另外,表现为该征象的也可能为原发性炎性乳腺癌,炎性乳腺癌皮肤增厚好发于乳晕区及下象限向整个乳房蔓延,约56%的炎性乳腺癌可见微小钙化[6],PET/CT表现为乳腺增大及皮肤增厚区域摄取呈弥漫性增高[7]。转移性乳腺癌患者发病年龄为45~47 岁,相比原发性乳腺癌患者发病年龄小,患者多处于绝经前状态[8];影像学表现一般分为两种类型,一种类型表现为乳腺肿块,多经血行途径转移而来,占54.8%[9],边界较清楚,有时为多发,病灶内钙化灶及肿瘤周围卫星灶很少见[9-11];另一种类型以局部皮肤的炎性反应为主,多为淋巴途径转移而来,为局部皮肤受肿瘤侵犯水肿造成[9],MRI 可灵敏地检查出皮肤增厚的范围及周围软组织肿胀的情况。本例患者处于绝经前期,不伴腺体弥漫增厚,因此首先可排除生理性摄取;乳腺结节边界不清,病灶与皮肤增厚分界尚清,病灶内未见钙化,摄取不高,不符合典型炎性乳腺癌表现。本例患者胃病灶同时有转移性乳腺癌第2 种影像类型表现,应高度怀疑为胃腺癌乳腺转移。
和绝大多数肿瘤一样,组织病理学检查结果为诊断胃腺癌乳腺转移的“金标准”。目前常用的鉴别指标包括CK20、GCDFP-15、GATA 结合蛋白3。乳腺来源组织多表现为CK20-,而胃肠道来源多为CK20+;CK7+/CK20+多为上消化道来源[12];GCDFP-15 在乳腺和汗腺来源肿瘤中可呈阳性,据报道,GCDFP-15 在乳腺组织的特异度可高达93%以上,而在胃肠道组织中很少表达,是鉴别肿瘤是乳腺还是胃肠道来源的重要标志[13];GATA 结合蛋白3 也是乳腺组织特异性指标,其灵敏度可达95%[14]。
本例患者以乳腺包块为首发症状,专科检查中包块较PET/CT 检查差异较大,主要原因如下:(1)专科体检受主观因素影响,且本病例病灶与腺体分界不清,会影响临床上对肿瘤大小的评估;(2)18F-FDG 摄取程度与肿瘤的病理类型、分化程度、肿瘤细胞数量等相关,受周围炎性腺体干扰,可能无法准确反映肿瘤病灶。通过对本病例的分析,可以提示PET/CT 诊断医师,当遇到胃与乳腺同时出现异常,特别出现乳腺皮肤增厚时,要考虑胃癌乳腺转移的可能性。成纤维激活蛋抑制剂(FAPI)较传统FDG 对胃癌及乳腺癌均有较高的灵敏度[15],FAPI 显像对于原发性乳腺癌与乳腺转移性肿瘤的鉴别有待进一步研究。18F-FDG PET/CT 显像可以早期检测胃癌乳腺转移患者全身病灶的情况,提示临床可疑转移部位;而各种新型显像剂可以对传统FDG 进行补充,提高诊断的准确率。
利益冲突所有作者声明无利益冲突
作者贡献声明彭小娟负责命题的提出与设计、病例的收集与分析、论文的撰写与修订;寇莹负责命题的设计、论文的修订;李川负责数据的收集与分析、论文的修订;程祝忠负责命题的设计、论文的审阅

