白头翁皂苷注射液对奶牛隐性乳房炎的临床治疗效果
汪培嘉,严 静,王银龙,苏柘僮,赵俊卿,许小琴*
(1.扬州大学 兽医学院,江苏 扬州 225000;2.成都馨海英路生物医药科技有限公司,四川 成都 610000;3.广西英路维特药物有限公司,广西 荔浦 541000)
奶牛乳房炎是由细菌感染、物理损伤等引起的乳腺组织的炎症反应。该病主要分为临床型和隐性型,其中隐性乳房炎的发病率远高于临床型乳房炎的发病率。近年来,兽医临床上主要使用抗生素防治奶牛乳房炎,然而抗生素的长期使用引发了细菌耐药性、抗生素残留等问题,严重危害公共安全,因此在临床上,抗生素受到了限用甚至禁用。中草药因具有药用、保健等功能以及不易导致耐药性的特点[1],而逐渐成为兽医工作者研究的热点。多种中药制剂被证实对奶牛隐性乳房炎有较好的临床治疗效果[2-4],因此选取中药对奶牛隐性乳房炎进行防治与当下需求非常吻合。白头翁皂苷B4是白头翁皂苷注射液的主要有效成分,它是从中药白头翁的根中提取出的一种天然皂苷,具有显著的生物活性。现代药理学研究表明,白头翁皂苷B4具有抑菌、抗炎、抗氧化、调节免疫功能等作用[5-8]。沈留红等[9]将白头翁皂苷B4用于奶牛临床型乳房炎的治疗,证实以0.05 mL/(kg·d)的剂量连续给药6 d,能够有效治疗奶牛临床型乳房炎,治愈率可达75.00%。据此,我们认为白头翁皂苷B4对奶牛隐性乳房炎可能具有潜在的治疗价值,故选择白头翁皂苷注射液按0.05 mL/(kg·d)作为中剂量开展了对奶牛隐性乳房炎的治疗。
本试验旨在探究白头翁皂苷注射液对奶牛隐性乳房炎的临床疗效,及部分药效机制,以期对奶牛隐性乳房炎的防治和白头翁皂苷B4的研究与应用提供理论依据。
1 材料与方法
1.1 主要试剂
1.1.1受试药物 白头翁皂苷注射液,100 mL/瓶,主要成分为白头翁皂苷B4(质量浓度为33.5 g/L),批号:20201101,由广西英路维特药物有限公司提供。
1.1.2阳性对照药物 双丁注射液,肌内注射,给药量根据奶牛体质量0.1 mL/kg,规格10 mL/支(相当于原生药18 g),10 支/盒,由河北远征禾木药业有限公司生产,批号EPC200501。
1.1.3其他 奶牛乳房炎检测试剂(HMT),25 g/瓶,批号200510,由浙江大学食品科学与发酵工程研究所提供;生化试剂盒均购自上海酶联生物科技有限公司,其他常规试剂均为国产分析纯级产品。
1.2 主要仪器FOSS多功能乳制品分析仪(MilkoScan FT1,丹麦)、福斯原奶细菌与体细胞快速检测一体机(BacSomatic BS型,丹麦)、乳房炎塑料诊断盘(兴牧荷斯坦畜牧机械厂)、Sartorius电子天平(BSA223S-CW,德国)、赛恩斯磁力搅拌机(MS-H280-Pro,中国)、Eppendorf多功能台式离心机(5811 dG271611,德国)等。
1.3 奶牛隐性乳房炎的诊断参考钟英杰等[2]的方法,于挤奶前进行奶牛隐性乳房炎的诊断,并根据表1判定隐性乳房炎炎症度,判定为可疑的乳样应重复测定1次,如结果仍为可疑则判定为阴性。为了便于统计,将HMT检测的乳房炎判定标准“+、++、+++”分别用分数“1分、2分、3分”表示,每头牛取4个乳区检测的得分总和为炎症度积分指标。奶牛及其乳房无肉眼可见的异常变化,隐性乳房炎炎症度积分>1分的判为患隐性乳房炎奶牛[2],其中隐性乳房炎炎症度积分≥3分的奶牛选为治疗试验动物。

表1 杭州乳房炎试验(HMT)判定标准
1.4 实验动物与处理选择扬州市某奶牛场为试验牧场,场内奶牛品种为荷兰黑白花奶牛。选择该场经产3~6胎,处于泌乳期,符合奶牛隐性乳房炎诊断标准和试验纳入标准的自然患隐性乳房炎奶牛103头,确认患牛最近1月内未用过任何药物后,按牛存栏编号随机分为5组,分别为白头翁皂苷注射液高剂量组(受试药物高剂量组)、白头翁皂苷注射液中剂量组(受试药物中剂量组)、白头翁皂苷注射液低剂量组(受试药物低剂量组)、阳性药物对照组(阳性药物对照组、双丁注射液组)和阳性对照组(生理盐水组)。各组于每天上午8~9点间经肌肉注射给药,1 次/d,连用5 d。于给药前1 d、给药后3 和5 d,分别用HMT检测各试验牛患隐性乳房炎的炎症度积分,并于给药前1 d和给药后5 d,分别采集各奶牛4个乳区的乳样各50 mL,送至扬大康源乳业乳品检测实验中心进行体细胞含量的检测和乳蛋白、乳糖、非脂固形物和乳密度等乳成分理化指标的测定;采集各头牛的静脉血进行血常规、炎性因子和免疫因子的检测。经综合分析各项指标来考察试验药物的疗效。具体分组及处理情况见表2。

表2 各试验组处理情况
1.5 治疗效果判断标准根据HMT检测结果进行药物治疗效果的判定,治疗效果分痊愈、有效和无效[2],具体标准如下:
治疗后炎症度积分为0,且全身无肉眼可见的病理现象者,判为痊愈。治疗后炎症度积分下降2分以上,且炎症度积分≤6分,全身无肉眼可见的病理现象者,判为有效。治疗后患病奶牛全身虽无肉眼可见的病理现象,但经HMT检测,其隐性乳房炎炎症度积分下降≤2分,或4个乳区的炎症度积分>6分;或1个乳区以上转变为临床型乳房炎者,判为无效。
治愈率%=(该组痊愈牛头数/该组治疗牛头数)×100;
有效率%=(该组有效牛头数/该组治疗牛头数)×100;
无效率%=(该组无效牛头数/该组治疗牛头数)×100;
总有效率%=治愈率%+有效率%。
1.6 数据统计分析乳成分理化指标、血常规指标用“平均数±标准差”表示,用SPSS 25.0软件,经t检验统计分析各组间的差异性。痊愈率、有效率、总有效率和无效率,用卡方检验比较各组间的差异性[2]。
2 结果
2.1 临床试验的隐性乳房炎治疗效果所有试验组经1次/d,连续给药5 d,并于给药前1 d、给药后3 和5 d进行HMT诊断液检测从而判断临床治疗效果。结果显示,给药后3 d,受试药物高剂量组、受试药物中剂量组、受试药物低剂量组、双丁注射液组和阳性对照组的总有效率分别为81.82%,67.74%,45.45%,40.00%,29.17%,其中受试药物高剂量组的总有效率与阳性对照组的总有效率相比差异极显著(P<0.01),与受试药物低剂量组、双丁注射液组的总有效率相比差异显著(P<0.05),同时受试药物高剂量组的治愈率最高为18.18%,显著高于受试药物低剂量组治愈率0.00% (P<0.05)。给药后5 d,受试药物高剂量组、受试药物中剂量组、受试药物低剂量组、双丁注射液组和阳性对照组的总有效率分别为90.91%,77.42%,77.27%,46.67%,33.33%,其中受试药物高、中剂量组的总有效率显著高于双丁注射液组的总有效率 (P<0.05),受试药物高剂量组、中剂量组、低剂量组3个治疗组的总有效率与阳性对照组的总有效率相比差异均极显著(P<0.01),同时受试药物中剂量组的治愈率最高为16.13%,显著高于受试药物低剂量组治愈率0.00% (P<0.05)。将各组给药后3和5 d的总有效率进行比较,其中受试药物低剂量组给药后3和5 d的总有效率差异性显著(P<0.05),其余各组给药后3和5 d的总有效率差异性不显著(P>0.05)。将各组给药后3和5 d的治愈率进行比较,差异性均不显著(P> 0.05)。详细结果见表3。
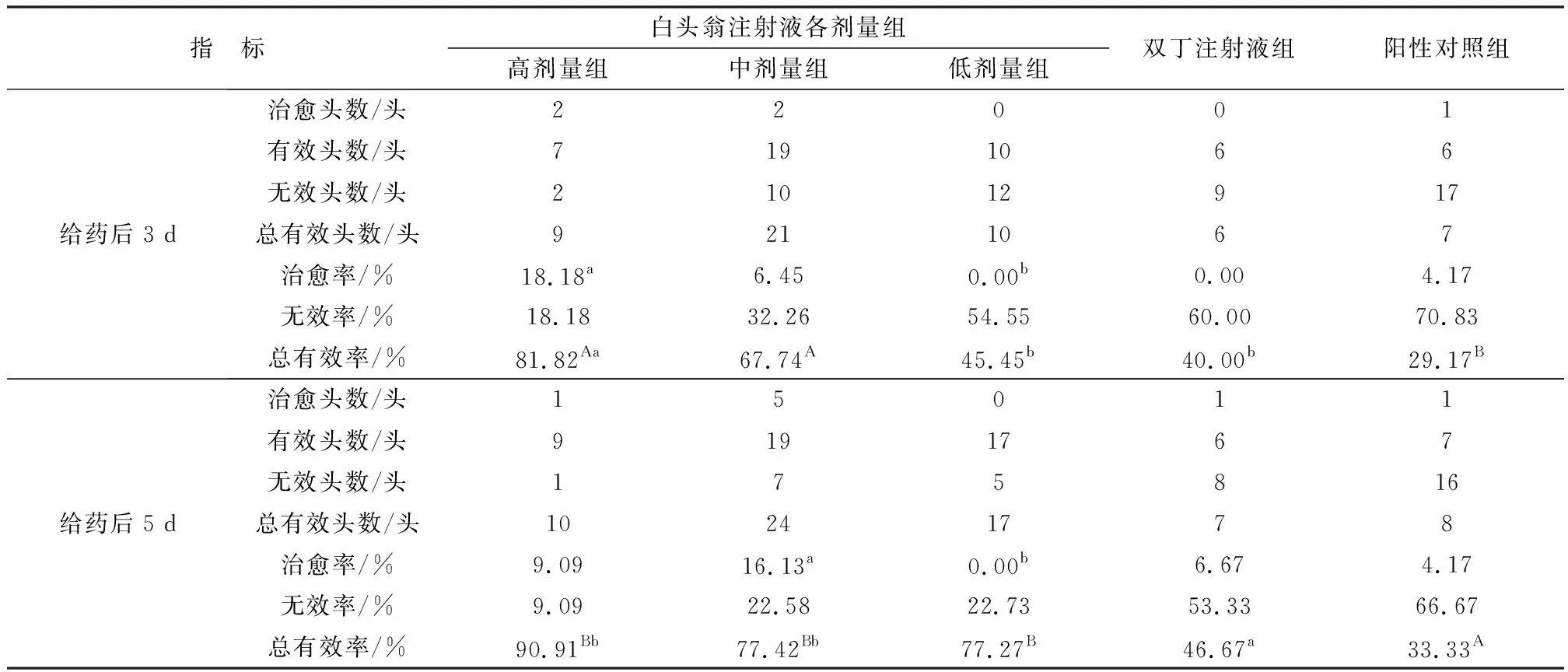
表3 临床试验的奶牛隐性乳房炎治疗结果
2.2 临床试验治疗前后炎症度积分变化治疗前,所有组别患病牛的炎症度积分均值皆在6.09以上。给药3 d后,与用药前炎症度积分均值相比,受试药物高、中、低剂量组、双丁注射液组和阳性对照组的炎症度积分均值分别下降了2.91,2.39,1.75,1.47,1.04,且受试药物高、中、低剂量组炎症度积分均值皆不高于阳性对照组炎症度积分均值5.11。给药后5 d,与用药前炎症度积分均值相比,受试药物高、中、低剂量组、双丁注射液组和阳性对照组的炎症度积分均值分别下降了3.18,3.05,2.66,1.46,1.61,且受试药物高、中、低剂量组炎症度积分均值皆低于阳性对照组炎症度积分均值4.54。受试药物高剂量组炎症度积分均值下降最多,并且受试药物高剂量组给药前1 d和给药后3和5 d炎症度积分差异显著(P<0.05),受试药物中剂量组给药前4 d和给药后3和5 d炎症度积分差异极显著(P<0.01),受试药物低剂量组给药后5 d炎症度积分极显著高于用药前(P<0.01)。结果见图1。

*表示差异显著(P<0.05),** 表示差异极显著(P<0.01),***表示差异极显著(P<0.001)。下同
2.3 临床试验治疗前后乳样体细胞数变化比较治疗前各组受试牛乳样中的平均体细胞数,各组数值基本接近,与各组平均炎症度积分所反映的情况亦相一致。连续肌肉注射给药治疗5 d后,受试药物高、中、低剂量组的乳样体细胞数与治疗前的乳样体细胞数相比分别出现了显著(P<0.05)、极显著(P<0.01)和极显著(P<0.01)下降。而双丁注射液组乳样体细胞数虽有所下降,但无显著性差异(P>0.05),结果见图2。

图2 临床试验治疗前后各组乳样中体细胞数变化
2.4 临床试验治疗后乳成分测定结果见表4。由表可知,治疗后,各组乳脂、乳蛋白、乳糖、非脂固形物和乳密度无显著差异(P>0.05)。

表4 临床试验治疗后乳成分测定结果
2.5 临床试验血液学指标的测定比较治疗前与治疗后各试验组奶牛血常规检测结果,各项检测指标的变化均没有显著性差异,且所有测定数据均在奶牛血液学指标的正常参考值范围内。
2.6 临床试验血清中IL-8、IL-1β、IgG、IgM、HP的含量检测结果显示,治疗后IgM在奶牛血清中的含量,受试药物高剂量组显著低于双丁注射液组 (P<0.05);治疗后IL-8在奶牛血清中的含量,受试药物高剂量组显著高于受试药物低剂量组 (P<0.05),受试药物高剂量组极显著高于阳性对照组 (P<0.01),结果见图3。

图3 临床试验治疗前后奶牛血清中IL-8、IL-1β、IgG、IgM、HP的含量
3 讨论
3.1 诊断标准本试验采用HMT检测试剂作为奶牛隐性乳房炎的临床快速诊断标准,并与FOSS-BacSomatic BS型体细胞检测仪对乳样的细胞检测数据进行比较,按临床诊断标准和试验纳入标准的患隐性乳房炎奶牛,每头牛4个乳区的隐性乳房炎炎症度积分在3.5分以上,各组的平均炎症度积分在5.55~6.09之间,其乳样的平均体细胞数约为357 万/mL,即本次试验HMT检测的隐性乳房炎1个“+”即炎症度1分的平均体细胞数约为59.5 万/mL,恰好处于诊断标准中弱阳性(+),即体细胞数在40~150 万/mL之间,符合试验设计判定标准[10],表明试验选用的HMT检测试剂所开展的临床快速检测诊断标准可行,入选的患隐性乳房炎的奶牛符合试验要求。
SCC是指每毫升牛乳中含有的细胞总数,其中98%~99%为淋巴细胞、巨噬细胞和嗜中性粒细胞,还有少量坏死脱落的乳腺上皮细胞等[11]。有研究表明,SCC与奶牛健康状况、牛乳质量密切相关,当奶牛乳房出现由组织损伤、细菌感染等引起的炎症时,乳腺上皮细胞中的巨噬细胞、中性粒细胞等免疫相关细胞大量聚集,导致SCC出现显著增加[11-12]。因此,SCC现为国内外判定隐性乳房炎的重要指标[12-15]。
3.2 结果分析本试验发现,对患隐性乳房炎的奶牛以0.08 mL/(kg·d)的剂量肌肉注射白头翁皂苷注射液,连续治疗5 d后总有效率最高,可达90.91%。同时,将给药后3和5 d的治疗效果进行对比,各组总有效率皆有所上升。且给药后5 d,受试药物高、中剂量组的总有效率显著高于阳性药物对照组和阳性对照组的总有效率,受试药物高、中、低剂量组的隐性乳房炎炎症程度积分与治疗前相比达到了极显著性(P<0.01)或显著性(P<0.05)下降,且下降幅度皆大于阳性对照组炎症度积分下降幅度。因此连续给药5 d为1个疗程的治疗效果更佳。本试验结果表明,经白头翁皂苷注射液治疗后,受试药物高、中、低剂量组的SCC与治疗前各组SCC相比出现了显著(P<0.05)或极显著(P<0.01)下降。这与沈留红等[9]使用白头翁皂苷B4治疗临床性乳房炎后,牛乳中SCC显著降低的结果相似。治疗后,双丁注射液组乳样体细胞数虽有所下降,但无显著性差异(P>0.05),而有研究发现,患隐性乳房炎的奶牛经双丁注射液与鱼腥草注射液联用治疗后,SCC显著下降(P<0.05)[16]。这表明白头翁皂苷注射液对奶牛隐性乳房炎有较好的临床治疗效果,而双丁注射液单独使用时,对奶牛隐性乳房炎的治疗效果不理想。
奶牛隐性乳房炎是最常见的奶牛疾病之一,该病的发生对牛乳品质带来了极大的影响[17-18]。隐性乳房炎的发生会破坏乳腺组织,导致乳脂、乳糖合成量下降,最终表现为牛乳中乳脂、乳糖含量降低。隐性乳房炎的发生还会引起乳房毛细血管通透性增加,进而导致乳汁中乳清蛋白含量增加[18]。刘延鑫等[4]研究发现,使用五味消毒饮对患隐性乳房炎的奶牛进行治疗时,治疗第7天对照组和治疗组各项乳成分指标差异不显著(P>0.05),治疗第14天仅治疗组产奶量显著高于对照组(P<0.05)。本试验中,治疗后5 d各组间乳脂、乳蛋白、乳糖、非脂固形物和乳密度均无显著性差异(P>0.05),与上述试验结果一致。说明白头翁皂苷注射液在短期内对患隐性乳房炎奶牛的乳成分影响较小。
细胞因子是机体在炎症过程中进行调节的重要因素,当奶牛患隐性乳房炎时,机体免疫细胞受到刺激,释放细胞因子,导致患病奶牛体内细胞因子含量增加[19]。有研究表明,当奶牛患隐性乳房炎时,细胞因子HP、IL-1β、IL-8的基因表达水平显著上升[20-21]。沈留红等[9]发现,经白头翁皂苷B4治疗后,患临床型乳房炎的奶牛血清中HP、IL-1β、IL-8含量显著降低。胡屹屹等[22]发现,白头翁皂苷B4可显著降低由细菌内毒素引起的内皮细胞IL-8分泌增加。本试验结果显示,治疗后,各组患隐性乳房炎的奶牛血清中HP和IL-1β含量均无显著变化,仅治疗后IL-8在奶牛血清中的含量受试药物高剂量组极显著高于阳性对照组(P< 0.01),与上述试验结果不一致。同时对血液学常规指标和血清中IgG、IgM等免疫指标进行检测,结果显示经白头翁注射液治疗后,这些指标未出现显著变化。表明肌肉注射白头翁皂苷注射液连续5 d,对患隐性乳房炎奶牛的基础生理代谢活动影响较小。
综上所述,白头翁皂苷注射液,按奶牛体质量0.08 mL/kg 肌肉注射, 1次/d,连续5 d,对奶牛隐性乳房炎具有较好的治疗效果,且明显优于双丁注射液的疗效。

