河南省牛肠道病毒的遗传变异分析
常晓冉,林 倩,钱明珠,胡俊英,李 欣,古丽巴哈尔·图尔荪,王新平,3*
(1.吉林大学 动物医学学院,吉林 长春 130062;2.河南农业职业学院,河南 郑州 451450;3.吉林大学 人兽共患病研究所 教育部人兽共患病重点实验室,吉林 长春 130062)
肠道病毒(enterovirus,EV)属于小RNA病毒科肠道病毒属的成员,是引起人类与动物临床上以消化系统、呼吸系统和神经系统症状为特征疾病的病原体[1-3]。肠道病毒目前分为12个肠道病毒种和3个鼻病毒种,其中E种肠道病毒(EV-E)和F种肠道病毒(EV-F)统称为牛肠道病毒(BEV),主要感染牛只[4-6]。作为小RNA病毒科肠道病毒属中的成员之一,BEV为无囊膜的单股正链RNA病毒,具有典型的二十面体立体对称的球形结构。病毒粒子大小为 25~30 nm,基因组全长为7 300~7 500 bp。基因组中仅有1个开放阅读框(ORF),可直接作为mRNA翻译出1个前体多聚蛋白,该蛋白经过一系列降解,形成4种结构蛋白( VP1、VP2、VP3 和VP4) 和7种非结构蛋白( 2A、2B、2C、 3A、3B、3C和3D)[7-8]。在肠道病毒的4种结构蛋白中,VP1、VP2和VP3位于病毒粒子表面,病毒主要抗原表位位于其上,可诱导机体产生抗体[9]。而7种非结构蛋白在病毒基因组复制、转录与翻译等过程中发挥重要作用。
BEV的分类经历了多次变动。目前,依据病毒基因组序列的差异,国际病毒分类委员会将BEV分为EV-E和EV-F 2个种,前者包括EV-E1~EV-E5共5种基因型,后者包括EV-F1~EV-F7共7种基因型。在肠道病毒中,VP1蛋白是病毒基因组编码的衣壳蛋白,暴露在病毒粒子最外部,该蛋白可构成2个重要结构“峡谷”和“口袋结构”。二十面体五重轴周围的凹陷称为“峡谷”[10];而疏水性“口袋结构”主要暴露在峡谷的表面,可以稳定病毒粒子。肠道病毒通过VP1与特异性受体(如SCARB2)结合感染细胞,导致疏水“口袋结构”从“峡谷”底部排除,进而引起病毒不稳定,这种不稳定可能是基因组释放的前提[11]。VP1含有6个表面环(BC、DE、BE/aB、GF、GH和HI),主要位于二十面体五重轴周围,暴露在病毒粒子表面,是病毒的主要可变区域[12]。VP1蛋白富集多个中和表位区,因而被认为是中和抗体的主要靶标,具有最多的型特异性中和位点。由于VP1蛋白编码基因序列与病毒血清型具有较高的相关性,通过扩增全长VP1序列,构建系统进化树与对比VP1区核苷酸同源性进而判断所分离病毒的血清型[13]。
本实验室前期对河南省牛群BEV感染进行了流行病学调查,发现河南省不同地区的牛群存在BEV感染。为了进一步确定河南省不同地区感染的BEV毒株的遗传变异与分子差异,本研究应用RT-PCR方法扩增了不同BEV毒株的VP1基因,并进行了序列测定与比对分析,确定出BEV毒株的分子差异,为河南省BEV的防控提供理论依据。
1 材料与方法
1.1 样品的采集与处理待检粪便样品如参考文献[14]所示,采集于河南省5个地区(编号为RZ、ZM、JX、SQ、XX) 的5个奶牛场有腹泻症状的病牛群,其处理方法参照文献[15]进行。
1.2 主要试剂与仪器DMEM购自Gibco (美国) 公司;胎牛血清(FBS)购自海克隆生物公司;Reverse Transcriptase M-MLV试剂盒、Premix Taq 酶,均购自 TaKaRa公司;琼脂糖凝胶回收试剂盒、pGM-T载体试剂盒均购自北京天根生化科技有限公司;PCR扩增仪,购自杭州博日科技有限公司;电泳仪,购自上海天能科技有限公司;显微镜,购自上海立光精密仪器有限公司。
1.3 引物的设计与合成根据基因文库收录的部分EV-E和EV-F肠道病毒的核苷酸序列,分别设计合成1对 EV-E和EV-F的特异性引物,用于扩增BEV的VP1基因序列。EV-E引物序列为EV-E-S:5′-CGAGACCGGTGCAACATCCA-3′,EV-E-AS:5′-CGGGGGCCCTTCGGTATC-3′;EV-F引物序列为EV-F-S:5′-TGGCGGAATTGGTAGGTGGATAGT-3′,EV-E-AS:5′-AGGTGTTTGGGCTTCGCATAGA-3′。引物由上海生工生物工程公司合成。
1.4 病毒分离及培养将病料以PBS按照1∶5(W/V)比例稀释后,8 000 r/min离心10 min,上清液用0.45 μm滤器过滤,然后将滤液接种于生长密度为70%的单层Vero细胞,37℃、5%CO2培养箱中感作2 h后弃掉接种物,以 Hank’s 液洗涤细胞2次后,加入含有2% FBS的DMEM细胞培养液培养,每4~6 h 观察细胞1次。细胞接种病料48 h 后,将其反复冻融3次,收集病毒液,置于-80℃保存。将收获的病毒液连续传至第5代,-80℃ 保存。
1.5 病毒分离株抗原交叉的检测采用免疫过氧化物酶单层细胞试验(IPMA)进行[14]。将分离病毒株接种单层Vero细胞,待细胞出现30%左右的病变后,以甲醇于-20℃固定15~20 min。以兔源抗HY12病毒 VP1多克隆抗体和兔源抗SD-S67 毒株VP1多克隆抗体为一抗[15-16],HRP标记的羊抗兔抗体为二抗,经显色后置于显微镜下观察并记录结果。同时设置阴性血清对照和未接毒细胞对照。
1.6 病毒RNA的提取及VP1基因序列的扩增应用天根生化科技有限公司的TRIzol 试剂盒提取BEV阳性样品或细胞分离毒株的RNA,然后以Reverse Transcriptase M-MLV试剂盒进行病毒cDNA的合成。应用PCR方法,以上述合成的cDNA为模板,扩增VP1基因。扩增条件为95℃预变性5 min;95℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环;最后72℃延伸10 min。PCR扩增产物以1%琼脂糖凝胶进行鉴定。
1.7 PCR产物或阳性克隆的序列测序将PCR产物直接进行序列测定或将PCR扩增的目的DNA片段连接到T载体上,酶切鉴定得到的阳性质粒送至上海生工有限公司测序。
1.8 序列比对分析采用文献[17]方法进行。应用Lasergene DNAStar和MEGA 7.0软件将测序获得的样本序列与GenBank中BEV代表毒株的VP1序列进行同源性比较和进化树分析,确定获得序列之间的同源性及差异性。
2 结果
2.1 病毒的分离及其致细胞病变特征单层Vero细胞接种处理样品后,一般于12~24 h后开始出现细胞皱缩变圆、聚集、透光性增强,之后细胞逐渐脱落死亡等病变现象(图1A~C)。少数样品盲传2~5代才能观察到明显的细胞病理变化。病毒分离结果如图1所示。

A~C.代表毒株接种Vero细胞引起的细胞病变;D.正常细胞对照
2.2 分离毒株间免疫学交叉反应以IPMA检测分离毒株感染的细胞,确定分离毒株与EV-E和EV-F参考毒株间是否存在交叉反应。结果如图2所示,应用抗HY12-VP1和SD-S67-VP1的多克隆抗体,检测分离的EV-F及EV-E代表毒株。与未接毒的细胞相比(图2G,H),在接毒细胞的胞浆中观察到大量的、信号非常强或比较强的染色(图2A,B,D,E)。同时,应用EV-E和EV-F抗血清检测正常细胞(图2G,H)以及兔阴性血清检测EV-E和EV-F接毒细胞及正常细胞(图2C,F,I)时,均未观察到信号。上述结果说明分离毒株与EV-E和EV-F参考毒株之间存在着免疫学交叉反应。

A.D,G.HY12毒株高免血清检测分离的EV-E、EV-F和正常细胞对照结果;B,E,H.SD-S67高免血清检测分离的EV-E、EV-F和正常细胞对照结果;C,F,I.兔阴性血清检测分离的EV-E、EV-F和正常细胞对照结果(40×)
2.3 PCR扩增分离毒株VP1基因的结果应用EV-E和EV-F特异性引物,进行VP1基因的PCR扩增。结果如图3所示,获到了预期大小的目的条带。

M.DL2000 DNA Marker;1~8.EV-E样品;9~11.EV-F检测样品;N.阴性对照
2.4 河南省牛群存在EV-E和EV-F病毒感染将扩增出VP1基因片段进行序列测定与比对分析,结果如图4所示。河南省不同地区分离毒株HeN-A2、HeN-A3、HeN-B72、HeN-B78、HeN-B81、HeN-B83、HeN-B84、HeN-C4之间的同源性为70.2%~98.6%,与国内首株E种肠道病毒HY12毒株VP1序列的同源性为69.3%~80.3%。其中分离株HeN-C4和HeN-A3与HY12的同源性比较低,只有69.3%和69.5%,而HeN-A2与HY12同源性最高,其同源性为80.3%;与国外BEV病毒株比较,结果HeN-B84与BEV-K2577的同源性最高,仅为78.1%(红色方框所示)。与此同时,上述8株病毒与EV-F同源性只有50.3%~58.4%(绿色方框所示),依据肠道病毒种的分类标准,上述8株病毒应分类为EV-E毒株。
BEV分离株HeN-A12、HeN-B62和HeN-YR91与EV-F代表株具有较高的同源性,其中HeN-A12与国内首株EV-F毒株BHM26的同源性为68.6%,而与SD-S67的同源性最高,为88.8%,其次与Alpaca-KC748420的同源性比较高,为82.2%;HeN-YR91分离株与BHM26毒株的同源性为70.8%,与SD-S67毒株的同源性为73.7%;而HeN-B62与其他EV-F肠道病毒的同源性相比于HeN-A12和HeN-YR91毒株来说比较低,同源性为54%~76.9%(黄色方框所示)。同时,与EV-E病毒株相比,3株分离株与其同源性为53.6%~58.7%(蓝色方框所示),表明3株分离株分类为EV-F毒株。所述结果表明,河南省牛群中同时存在着EV-E和EV-F的混合感染。

图4 BEV河南分离株与国内外BEV代表毒株VP1核苷酸序列同源性比较
2.5 河南省BEV毒株的遗传多样性与基因型差异应用MEGA 7.0 软件将分离毒株的序列比对分析后,采用临近法(Neighbor-Joining)构建进化树,如图5所示。河南省不同地区分离株可以分为4个不同的分支,其中HeN-A2、HeN-A3、HeN-B72、HeN-B78、HeN-B81、HeN-B83、HeN-B84、HeN-C4这8株分离株与EV-E毒株同属于一个大分支,表明上述8株分离株均属于EV-E。进一步分析发现河南省牛群中EV-E存在2种不同的基因型,分离株HeN-A2与HY12和国外分离得到的毒株D-14-3-96同属于一个分支,且同源性最高,为EV-E3;HeN-B81、HeN-B72、HeN-B83、HeN-B78、HeN-B84、HeN-A3和HeN-C4与国外分离到的K2577、SL305、PS42和PS83毒株同属于一个分支,表明这7株河南分离毒株为EV-E2分离株HeN-A12、HeN-B62和HeN-YR91与EV-F同属于一个大分支。进一步分析显示,3株病毒株存在着2种不同的基因型。其中HeN-A12和HeN-YR91分离株与本实验室分离得到的F种羊源肠道病毒SD-S67同属于一个分支,为EV-F1;而HeN-B62与毒株EV-F4血清型的代表毒株BEV-Enterovirus-W1同源性最高,同属于一个分支,为EV-F4。
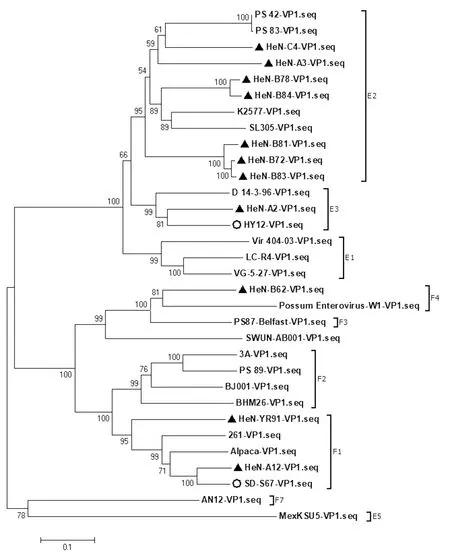
▲.BEV新分离株序列;○.2012年及2018年实验室分离的EV-E和EV-F毒株
3 讨论
BEV感染可引起一种临床上以严重消化道、呼吸道症状为特征的传染病,母牛感染后引起繁育障碍如不孕或流产等,某些牛只呈现隐性感染。本病最早于1959年由MOLL等[2]首次报道,之后国外许多国家也报道有本病的发生与流行。国内LI等[6]于2008年从内蒙古腹泻犊牛体内分离出我国第一株F种肠道病毒。之后邢泽黎等[15]于2012年从吉林省某发病牛群中分离出国内首株E种肠道病毒 HY12毒株,并对其分子特性以及遗传变异等情况进行研究。对吉林省不同地区分离的BEV毒株的遗传变异进行分析发现,BEV毒株的同源性存在明显差异[18]。BEV属于小RNA病毒科、肠道病毒属的成员,为单股正链RNA病毒。根据病毒基因组非结构蛋白和5’UTR序列的差异,可将其分为EV-E和EV-F 2个种。 而同一肠道病毒种依据VP1结构蛋白序列的差异又可进一步分为不同的基因型。截止目前,EV-E分为5个基因型(EV-E1~EV-E5),EV-F分为7个基因型(EV-F1~EV-F7)。河南省为国内牛羊养殖大省,有关BEV感染及其病毒株的差异缺乏研究。本研究应用前期制备的抗HY12-VP1和SD-S67-VP1多克隆抗体,对从河南省分离的11株BEV进行IPMA试验,结果发现分离毒株分别与HY12毒株(EV-E)和SD-S67毒株(EV-F)抗体发生特异性反应。同时比较分析不同毒株的序列差异,发现河南省牛群中同时存在着E种和F种肠道病毒感染[19]。其中,HeN-A2、HeN-A3、HeN-B72、HeN-B78、HeN-B81、HeN-B83、HeN-B84和HeN-C4这8株病毒株为E种肠道病毒;分离毒株HeN-A12、HeN-B62和HeN-YR91为EV-F。对不同毒株VP1基因进行了扩增、序列测定与分析,分离的8株E种肠道病毒可进一步分类为EV-E2和EV-E3,而HeN-A12及HeN-YR91与羊源F种肠道病毒SD-S67同属于EV-F1, HeN-B62与EV-F4血清型代表毒株BEV-Enterovirus-W1属于EV-F4。本研究揭示出河南省分离BEV的遗传变异及毒株的分子差异,发现牛群中同时存在着EV-E和EV-F毒株的混合感染,确定了分离毒株的基因型,上述结果为今后河南省BEV的预防及深入研究奠定了基础。

