1株朱鹮源致病性拟肺炎克雷伯菌的分离鉴定与分子特征分析
翟祎梦,邱国强,雷 蕾,胡依凡,白洪青,秦勇强,翟瑞东,周莹珊,王晓杜,杨永春*,宋厚辉*
(1.浙江农林大学 动物科技学院/动物医学学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,浙江 杭州 311300;2.德清县自然资源和规划局,浙江 德清 313200;3.湖州市生态林业保护研究中心,浙江 湖州 313099)
朱鹮(Nipponianippon)属鸟纲(Aves)、鹈形目(Pelecaniformes)、鹮科(Threskiornithidae)、朱鹮属(Nipponia),被誉为“东方宝石”和“鸟中大熊猫”,国家一级保护动物[1],曾濒临灭绝。疫病一直是威胁朱鹮保护的重要阻碍,目前已报道的朱鹮细菌性疾病有大肠杆菌和结核分枝杆菌[2-3],未见拟肺炎克雷伯菌感染报道。
拟肺炎克雷伯菌(Klebsiellaquasipneumoniae)与肺炎克雷伯菌(Klebsiellapneumoniae)、天花克雷伯菌(Klebsiellavariicola),广义都可称为肺炎克雷伯菌[4],是一类革兰阴性、兼性厌氧、不动杆菌,广泛存在于自然界以及人和动物的呼吸道、消化道、泌尿道等部位[5-7],为重要机会致病菌[8],可引起人和动物的肺炎、脑膜炎、腹膜炎、膀胱炎、败血症等多种疾病,引起世界范围内水禽感染,给家禽养殖业造成了严重的经济损失[9]。狭义地讲,上述3种细菌为不同的种,但由于相近的系统发育关系,拟肺炎克雷伯菌和天花克雷伯菌常被错误的鉴定为肺炎克雷伯菌。致病性耐药肺炎克雷伯菌早已经引起了广泛关注,为动物常见病原菌,已有海狮[10]、狐猴[11]、水貂[12]等多种野生动物感染相关报道,而拟肺炎克雷伯菌、天花克雷伯菌在此方面的报道较少。近年来,陆续有拟肺炎克雷伯菌、天花克雷伯菌高毒力耐药菌株报道,且部分菌株的毒力高于肺炎克雷伯菌[13-15],因此,拟肺炎克雷伯菌、天花克雷伯菌也开始受到关注。
本研究通过细菌分离培养、生化特征、16S rDNA和全基因组测序,从2020年9月浙江省德清县下渚湖1只死亡朱鹮体内分离鉴定到1株拟肺炎克雷伯菌,采用1日龄麻鸭致死试验鉴定了其致病性、药敏试鉴定了其耐药表型,利用全基因组序列分析明确了其耐药基因、毒力基因、ST型和分子血清型。此为首次报道拟肺炎克雷伯菌感染朱鹮,并对分离菌株的致病性、耐药性及分子特性进行了描述,为朱鹮拟肺炎克雷伯菌感染的防治提供了相关的基础数据。
1 材料与方法
1.1 病例来源2020年9月,浙江省德清县下渚湖发现1只濒死成年朱鹮,经紧急救护无效死亡。
1.2 主要试剂无菌脱纤绵羊血购自上海儒安生物科技有限公司;LB培养基、琼脂粉购自生工生物工程(上海)股份有限公司;伊红美蓝琼脂购自北京奥博星生物技术有限公司;Wilkins-Chalgren厌氧菌琼脂购自金克隆(北京)生物技术有限公司;BHI肉汤培养基购自青岛高科园海博生物技术有限公司;革兰阴性菌(GN)生化鉴定卡购自Bio Mérieux公司;26种抗生素药敏纸片购自杭州微生物试剂有限公司;革兰染色液购自杭州微生物试剂有限公司;DNeasy Power Soil Kit基因组提取试剂盒购自QIAGEN公司;KOD one DNA聚合酶购自东洋纺(上海)生物科技有限公司。
1.3 病理学观察按照先外后内,先室后腔的原则剖检并检查死亡朱鹮,将采集的气管、肺、肝等样本固定在4%甲醛溶液中,常规石蜡包埋,HE染色镜检。
1.4 细菌分离培养及菌种鉴定
1.4.1分离培养和生长特性 采集的肺、肝脏和腹水等样本在绵羊血琼脂平板、LB琼脂平板、伊红美蓝琼脂平板和Wilkins-Chalgren厌氧菌琼脂平板上划线,分别放置于需氧、厌氧环境,37℃培养18~24 h,取单菌落纯化后进行革兰染色观察菌体形态并测定体外生长曲线。
1.4.2细菌生化鉴定 使用Bio Mérieux公司的VITEK®2 COMPACT全自动微生物生化鉴定仪和VITEK®2 COMPACT革兰阴性菌(GN)生化鉴定卡对分离菌株进行生化鉴定。
1.4.316S rDNA序列分析 挑取上述纯化后的单菌落接种到BHI肉汤培养基中,180 r/min,37℃振荡培养16 h,用QIAGEN公司的DNeasy Power Soil试剂盒提取基因组。取提取的基因组2 μL为模板,引物使用16S rDNA通用引物27F和1492R,反应体系及程序参考文献[16]。扩增产物用1%琼脂糖凝胶进行电泳检测,若出现约1 500 bp的特异性扩增条带,则为阳性。阳性产物送至杭州有康生物科技有限公司进行纯化和测序。序列在NCBI上进行Blast,确定细菌种类。
1.5 致病性鉴定鉴于朱鹮为珍稀濒危野生保护动物,故选择同为水禽的麻鸭做为实验动物进行感染试验。将上述分离鉴定菌株接种于BHI肉汤中,37℃振荡培养12 h,用PBS缓冲液洗涤2次,调整D600 nm值至对应细菌数量为1×109CFU,并采用平板菌落计数法计算细菌数量[17]。将45只1日龄麻鸭平均分为5组:4组为试验组,分别腹腔注射1×108,1×107,1×106和1×105CFU(0.2 mL/只)菌液;1组做对照组,腹腔注射无菌PBS缓冲液(0.2 mL/只)。每12 h观察1次,连续观察10 d[17],死亡鸭及时剖检观察病理变化并分离鉴定细菌。
1.6 细菌药敏表型鉴定选取头孢噻肟、美罗培南、环丙沙星、阿米卡星、庆大霉素等26种药物(表1)依据CLSI-M100(2020)的操作规程[18],运用K-B纸片法测定细菌对各种药物的敏感性。
1.7 细菌全基因组分析
1.7.1细菌分离株全基因组测序 将1.4.3提取的基因组用Illumina Hiseq测序平台进行双端150 bp测序,对获得的测序片段进行Clean Data处理后,应用基于SPAdes[19]的Unicycler进行拼接,使用GapCloser(版本:1.12)软件对组装结果进行内洞修补,去除冗余的段序列得到最后组装结果。
1.7.2耐药基因与毒力基因分析 将拼接的细菌全基因组分别于CARD(the Comprehensive Antibiotic Research Database)数据库 (http://arpcard.mcmaster.ca)和VFDB(http://www.mgc.ac.cn/VFs/)数据库进行比对注释。
1.7.3细菌分型 根据1.7.2鉴定的荚膜基因与菌体抗原序号确定分离株分子血清型,并利用CGE(Center for Genomic Epidemiology)网站(https://cge.cbs.dtu.dk/services/MLST/),对分离株进行多位点序列分型(multilocus sequence typing,MLST)分析,明确其序列号(sequence type,ST)。
1.7.4比较基因组学分析 分别采用ANI calculator(http://enve-omics.ce.gatech.edu/ani/index)和BRIG软件[20]分析分离株ZH200912与肺炎克雷伯菌、拟肺炎克雷伯菌全基因组的ANI值和亲缘关系图,依此判定分离株的种类及其与菌株的亲缘关系。当两个基因组的ANI值在95%以上时认为是同一个种[21],遗传关系图可呈现菌株间的同源性情况。
2 结果
2.1 病理变化剖检可见死亡朱鹮腹腔积液,气管内大量血凝块(图1A1),肺肿胀、淤血、切面有泡沫样液体流出(图1B1),肝淤血(图1C1);未见寄生虫。组织病理切片结果可见气管黏膜上皮细胞部分坏死脱落,纤毛部分脱落,黏膜下层水肿(图1A2,A3);支气管内有脱落的上皮细胞,呼吸毛细管中有纤维素和浆液性渗出物,并有炎性细胞浸润,部分呼吸毛细管坏死(图1B2,B3);肝脏中央静脉扩张,充满红细胞,窦周隙淤积大量红细胞(图1C2,C3)。
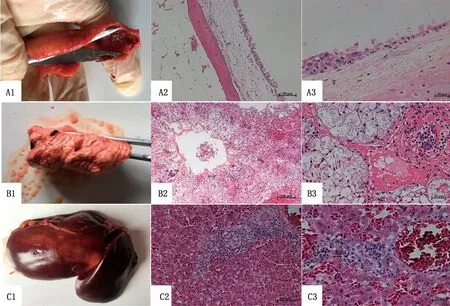
A.气管;B.肺脏;C.肝脏
2.2 细菌分离培养和菌种鉴定腹水和肺脏等样本,在血琼脂平板上形成白色、边缘整齐、光滑、湿润、粘稠、不溶血的菌落(图2A)。在LB琼脂上生长形成白色、圆形突起、表面湿滑的菌落(图2B)。在伊红美兰琼脂上形成中心黑色外周灰白色的菌落(图2C)。Wilkins-Chalgren厌氧菌琼脂上可见白色菌落(图2D)。分离株革兰染色阴性,呈单株或成对排列,无鞭毛,有荚膜(图2E),其生长曲线见图2F。腹水等样本细菌分离株生化鉴定结果相同,符合肺炎克雷伯菌生化反应。对腹水细菌分离株的16S rDNA序列PCR扩增后得到的1 500 bp特异性条带进行测序,在NCBI上Blast比对后,与肺炎克雷伯菌16S rDNA同源性最高,为99.86%,与拟肺炎克雷伯菌16S rDNA的同源性为99.79%,将该分离株暂定名为ZH200912,并进一步分析鉴定。

A.血琼脂平板;B.LB琼脂平板;C.伊红美蓝琼脂平板;D.Wilkins-Chalgren厌氧菌琼脂平板;E.革兰染色;F.菌株ZH200912的体外生长曲线;G.菌株ZH200912对1日龄麻鸭的LD50
2.3 致病性分析分离株ZH200912接种量为1×108和1×107CFU的试验组麻鸭在7 d内全部死亡,LD50为1×106.5CFU(图2G)。剖检可见,病死鸭肺脏淤血,肝肿大,与死亡朱鹮病变相似。同时,鸭内脏细菌分离株形态、16S rDNA序列均与ZH200912相同,结果表明,该菌株对禽类具有潜在致病性。
2.4 分离株耐药表型药敏试验结果显示该菌株对氨苄西林、哌拉西林、头孢噻肟和磷霉素耐药,对头孢曲松、妥布霉素等22种药物敏感(表1)。

表1 分离株ZH200912药敏试验结果
2.5 细菌基因组测序分析
2.5.1基因组组装结果 共生成11 206 958个raw reads,装配后基因组全长5 446 640 bp,43个contigs长度 ≥1 000 bp(N50,2 996 850),GC含量为57.66%。
2.5.2比较基因组学分析 ANI比对分析结果显示,菌株ZH200912对拟肺炎克雷伯菌ATCC 700603(NZ_CP014696.2)的ANI值(99.30%)高于对肺炎克雷伯菌str.Kp52.145(FO834906)的ANI值(93.29%); BRIG软件[20]比较结果(图3)表明,菌株ZH200912与拟肺炎克雷伯菌的同源性更高。综合2种比较基因组学分析结果,菌株ZH200912判定为拟肺炎克雷伯菌。
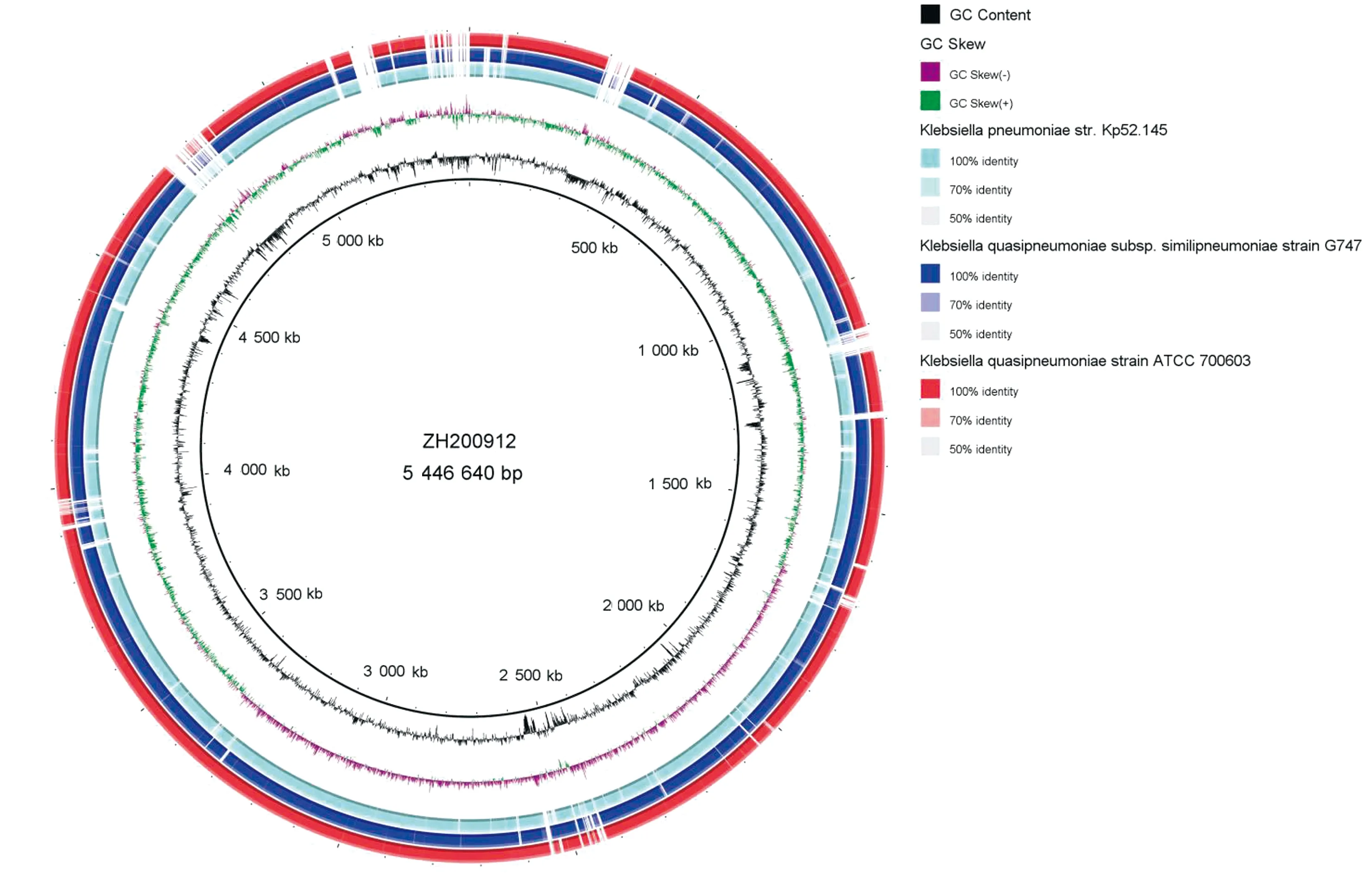
图3 菌株ZH200912与肺炎克雷伯菌str.Kp52.145 (FO834906)和拟肺炎克雷伯菌ATCC 700603 (NZ_CP014696.2)的基因组比较分析
2.5.3毒力基因分析 通过分析该菌的基因组序列,在菌株ZH200912中发现了67个毒力相关基因,其中核心毒力基因18个,包括Ⅰ型和Ⅲ型菌毛蛋白基因fimACD与mrkD、铁摄取相关基因肠杆菌素操纵子entABCEFS和fepABC基因以及铁运输操纵子iroEN等,外膜蛋白基因ompAC、荚膜(capsule,CPS)基因wzi398,脂多糖(lipopolysaccharide,LPS)基因waaF。
2.5.4分子血清型与ST型 根据2.5.3鉴定的荚膜基因与菌体抗原序号确定分离株分子血清型为K165:O12。利用CGE网站对拟肺炎克雷伯菌ZH200912进行MLST分析,结果显示,菌株ZH200912的ST分型为ST3244。
2.5.5耐药基因分析 结果显示该菌含有24个耐药相关基因,主要是多药外排泵基因acrBD、mdfA、mdtBC、emrBR,调节耐药基因转录的因子marAR、CRP、baeRS,以及β-内酰胺酶基因blaOKP-B-1,喹诺酮类药物耐药基因oqxAB和磷霉素耐药基因fosA6。
3 讨论
朱鹮为国家一级保护动物,在保护生物多样性和生态文明建设中具有重要意义,但是很多疫病严重威胁人工繁育和野外朱鹮种群的健康,给朱鹮保护工作带来困难。目前已有关于朱鹮感染新城疫病毒[1]、鹦鹉热衣原体、朱鹮衣原体[22]和放线菌[23]等微生物及寄生虫[24]的报道。本研究首次在野外死亡朱鹮体内分离到拟肺炎克雷伯菌,初步判定为拟肺炎克雷伯菌感染导致死亡,提示拟肺炎克雷伯菌为朱鹮潜在病原菌。
肺炎克雷伯菌为人和动物机会致病菌,可感染人和动物,导致疾病的报道较多[11,25],目前虽然也有拟肺炎克雷伯菌感染人后引起肝脓肿的报道[13],但鲜有水禽感染拟肺炎克雷伯菌的报道。本研究病理检查见死亡朱鹮腹腔积液,肝、肺等器官呈现严重的炎症反应以及不同程度的肿胀、淤血、出血、坏死,这与已报道肺炎克雷伯菌能够引起多器官炎症和败血症等病理变化相似。麻鸭致死试验显示,朱鹮拟肺炎克雷伯菌分离株ZH200912攻毒1日龄麻鸭的LD50为1×106.5CFU,攻毒死亡鸭病变与病死朱鹮相似,细菌分离鉴定回收到分离株ZH200912,这充分表明分离株ZH200912对水禽具有一定毒力。目前研究表明,肺炎克雷伯菌重要毒力因子主要为铁载体、菌毛、荚膜、脂多糖等,其中,铁摄取对细菌毒力至关重要,相关毒力因子往往与高毒力肺炎克雷伯菌(hypervirulentKlebsiellapneumoniae,hvKp)有关,ent、fep、iro基因对促进细菌生长和提高其在特定条件的竞争优势具有重要作用,iro系统相关基因缺失会导致毒力减弱[26];高黏表型相关基因rmpA和rpmA2也是高致病性肺炎克雷伯菌必不可少的。本研究分离株ZH200912携带67个毒力基因,包括荚膜(K165型)、Ⅰ型和Ⅲ型菌毛、脂多糖(O12)毒力基因以及铁摄取相关肠杆菌素操纵子entABCEFS、fepABC和铁运输操纵子iroEN等,但是,缺失高黏表型相关rmpA和rpmA2基因。本研究分离鉴定的致朱鹮死亡的耐药拟肺炎克雷伯的毒力因子,与FARZANA等[27]报道的1株致新生儿极高病死率的高毒力多重耐药天花克雷伯菌类似,都只具有铁摄取系统、菌毛等典型毒力因子,均缺乏rmpA/rmpA2基因。这说明拟肺炎克雷伯菌和天花克雷伯菌可能有不同于肺炎克雷伯菌的毒力因子,其机制有待进一步研究。
近年来,拟肺炎克雷伯菌的多重耐药情况也日益受到关注,携带blaKPC-2、blaOKP-B-6,aph(3’)-VIa,银抗性基因的多重耐药人源拟肺炎克雷伯菌[28]、携带mcr-8.2的猪源拟肺炎克雷伯菌以及人源耐碳青霉烯拟肺炎克雷伯菌[15]均有报道。本研究分离鉴定的拟肺炎克雷伯菌分离株ZH200912尽管对多种药物敏感,但也呈现出四重耐药表型:携带β-内酰胺酶基因blaOKP-B-1和磷霉素耐药基因fosA6与其对青霉素类药物和磷霉素耐药表型一致;携带外排泵基因acrBD、mdfA、mdtBC、emrBR及耐药基因转录调节因子marAR、CRP、baeRS可能与头孢噻肟耐药有关;携带喹诺酮类耐药基因oqxAB但无耐药表型,提示该菌可能是一个多药耐药基因的储存库[4]。由于拟肺炎克雷伯菌可以融合其他基因以适应环境,可通过增加耐药基因和毒力因子来提高耐药性和致病力[29],因此后期仍需持续监测朱鹮及其环境中的拟肺炎克雷伯菌。
拟肺炎克雷伯菌与肺炎克雷伯菌具有非常相似的生化和表型特征,在传统的细菌鉴定中常被错误的归类为肺炎克雷伯菌[30],从而忽视其在引起动物感染方面的重要性。本研究前期通过细菌分离、生化及16S rDNA序列鉴定,将分离株ZH200912鉴定为肺炎克雷伯菌,但全基因组序列分析确定该菌株为拟肺炎克雷伯菌。因此,在鉴别菌种时,应配合使用管家基因的系统发育分析,从而提高结果的准确性[31]。截至目前,在兽医临床上关于拟肺炎克雷伯菌的报道较少,对其研究主要是基于肺炎克雷伯菌数据。我们认为拟肺炎克雷伯菌是一种被忽视的动物病原体,本研究关于朱鹮源多重耐药致病性拟肺炎克雷伯菌的发现及其特征描述,为该类条件致病菌的监测和控制提供了基础数据,特别是野生水生动物中流行应该引起关注,提示应重视拟肺炎克雷伯菌对动物的潜在危害并加强对其毒力因子的研究。

