内肽酶O对马链球菌兽疫亚种突破血脑屏障的影响
尚天甜,彭 婕,鲁强生,刘旭明,曾巧英
(甘肃农业大学 动物医学学院,甘肃 兰州 730070)
马链球菌兽疫亚种(Streptococcusequissp.zooepidemicus,SEZ)属于兰氏分群的C群β溶血链球菌[1]。该菌宿主广泛,在全世界范围内都有分布,可感染猪、马、奶牛等多种动物,其中猪最易感,新生仔猪和哺乳仔猪发病率最高,死亡率高达50%,主要表现为脑膜炎、关节炎、心内膜炎等症状,是危害养猪业的重要细菌性病原之一[2-6]。人类通过直接与已感染动物密切接触或食用被该菌污染的食物亦可感染而引发脑膜炎,因此SEZ也是一种重要的人兽共患病病原菌[7-8]。SEZ ATCC35246株1976年分离自我国四川省一病死猪,由于其毒力强、免疫原性好被作为标准菌株广泛研究[9]。
SEZ可穿透血脑屏障引起人和动物脑膜炎。定殖于宿主上皮黏膜的细菌可穿过黏膜屏障进入血液,通过逃避宿主清除作用在血液中存活并增殖,引发菌血症,之后随血流到达脑部,通过跨细胞途径、细胞旁途径等方式侵入血脑屏障,在脑部大量增殖造成中枢神经系统感染,引起宿主脑膜炎[10-11]。血脑屏障主要由脑微血管内皮细胞及其之间的紧密连接,血管基底膜、周细胞和星型胶质细胞组成,细菌借助一些毒力因子来破坏该屏障,故黏附于脑微血管内皮细胞的毒力因子可作为细菌破坏血脑屏障的一个关键靶点进行研究[12-13]。为进一步明确SEZ穿透血脑屏障的作用机制,前期研究对能够黏附或侵袭脑微血管内皮细胞的SEZ分泌蛋白进行了筛选,其中内肽酶O(endopeptidase O,PepO)能够被菌体分泌至细胞外并有效黏附于脑微血管内皮细胞[14]。
PepO是一种锌金属内肽酶,属于M13肽酶家族的一员,与哺乳动物的金属内肽酶具有氨基酸序列同源性,参与调节多种生理和病理过程,是参与神经肽和肽激素加工和降解的重要调节剂[15-18]。PepO除具有以上生理功能外,还参与调节细菌毒力。在化脓性链球菌中,PepO通过与C1q相互作用逃避补体介导的细菌溶解[19-20]。肺炎链球菌PepO被证实是纤维连接结合蛋白,能够与宿主细胞外基质的各种成分结合,促进细菌对内皮细胞和上皮细胞的黏附,也可以与补体蛋白结合使细菌逃避宿主免疫防御系统从而侵入宿主细胞[21]。猪链球菌PepO也被证实是纤维连接结合蛋白,通过介导与纤维连接蛋白的结合增加血脑屏障通透性,从而促进猪链球菌脑膜炎的发生[22-23]。由此可见链球菌pepO基因为其重要的毒力基因,PepO可能与SEZ穿透血脑屏障有关,但其参与细菌穿透宿主血脑屏障具体机制仍未阐明。
本研究通过构建SEZ ATCC35246株的pepO基因缺失株及其pepO基因互补株, 以实验动物小鼠和脑微血管内皮细胞为模型,比较分析pepO基因对SEZ生长性能、感染小鼠的能力、小鼠全血存活率、小鼠脑组织定殖能力的影响、小鼠脑组织病理变化、黏附侵袭hBMEC的能力以及体外血脑屏障模型穿透能力的影响,初步探究pepO基因对SEZ突破血脑屏障的影响,有助于进一步阐明SEZ致脑膜炎机制。
1 材料与方法
1.1 主要试剂PrimeStar®HS(Premix)、DL2000 DNA Marker、DL5000 DNA Marker、T4DNA Ligase、限制性内切酶购自TaKaRa公司;2×Taq PlusMasterMix(Dye Plus)、ClonExpress®Ⅱ One Step Cloning Kit购自诺唯赞生物科技股份有限公司;DMEM培养基、0.25% Trypsin-EDTA(1×)、HBSS购自Gibco公司;胎牛血清购自ScienceCell公司;质粒提取试剂盒、胶回收试剂盒购自Axygen公司;THB培养基购自BD公司;鼠尾胶原蛋白Ⅰ型、壮观霉素购自Solarbio公司;细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;12孔板、Transwell小室购自康宁公司;生化反应管购自杭州滨河微生物试剂有限公司;其他分析纯试剂均购自天津市百世化工有限公司。
1.2 菌株和质粒菌株和质粒见表1。

表1 使用的菌株和质粒
1.3 实验动物和细胞系4~6周龄雌性BALB/c小鼠购自中国农业科学院兰州兽医研究所;人脑微血管内皮细胞(hBMEC)由南京农业大学兽医微生物学与免疫学实验室馈赠并由本实验室保存,使用含10% FBS的DMEM培养基培养。
1.4 引物设计与合成根据GenBank公布的SEZ ATCC35246菌株pepO基因(GenBank登录号:CP002904.1)序列,使用Oligo 7.0软件设计相关引物,由苏州金唯智生物科技有限公司合成,引物序列见表2。

表2 引物信息
1.5pepO基因缺失株构建参照TAKAMATSU等[24]方法构建pepO基因缺失株。以SEZ ATCC35246基因组为模板,表1所列引物扩增获得pepO基因的上、下游基因融合片段,利用同源重组方法构建温敏自杀性质粒△pepO-pSET4s。将△pepO-pSET4s电转化至SEZ ATCC35246感受态细胞中,涂布于含100 mg/L壮观霉素的THB平板,经过传代筛选,挑取疑似菌落使用引物SEZ-del-pepO-tsF/R、SEZ-pepO-tsF/R进行PCR鉴定,将鉴定正确的菌液送至苏州金唯智生物科技有限公司测序鉴定,获得pepO基因缺失株SEZ △pepO。
1.6pepO基因互补株构建参照TAKAMATSU等[24]方法构建pepO基因互补株。以SEZ ATCC35246基因组为模板,表1所列引物扩增获得SEZpepO基因片段,并运用同源重组法克隆至pSET2载体,构建互补质粒pepO-pSET2。将pepO-pSET2电转化至SEZ △pepO感受态细胞中,涂布于含100 mg/L壮观霉素的THB平板,挑取疑似菌落使用引物SEZ-pepO/pSET2F/R进行PCR鉴定,将鉴定正确的菌液送至苏州金唯智生物科技有限公司测序鉴定,获得pepO基因互补株SEZ C△pepO。
1.7 细菌形态特征及染色特性将SEZ WT、SEZ △pepO、SEZ C△pepO纯培养液划线于5%绵羊血琼脂平板上,37℃倒置培养过夜,观察细菌形态特征,挑取单克隆菌落进行革兰染色,显微镜下观察细菌染色特性。
1.8 细菌生化试验对SEZ WT、SEZ △pepO、SEZ C△pepO进行七叶苷、硝酸盐还原试验、蕈糖、乳糖、棉子糖、葡萄糖、麦芽糖、蔗糖、阿拉伯糖、山梨醇等11种生化试验,挑取单克隆菌落接种于生化管中,37℃培养24 h,观察结果。
1.9 细菌生长曲线测定将新鲜SEZ WT、SEZ △pepO、SEZ C△pepO菌液按1∶50接种至100 mL THB液体培养基中,37℃、220 r/min培养,每隔1 h 测定D600 nm,连续测定12 h,每组设立3个重复。
1.10 小鼠感染细菌存活率测定选取4~6周龄BALB/c雌性小鼠30只,随机分为SEZ WT、SEZ △pepO、SEZ C△pepO3个处理组,每组10只。3组小鼠分别经腹腔攻毒培养至对数期的SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液106CFU(5×LD50),每12 h观察记录每组小鼠存活情况。
1.11 细菌全血存活率测定无菌条件下采取小鼠抗凝血,将105CFU/mL 培养至对数期的SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液按1∶9加至小鼠抗凝血中混匀,37℃、220 r/min培养,分别于30,60 min取样,采用平板计数法计算细菌在全血中的存活率,试验重复3次。
1.12 小鼠脑组织细菌载量测定选取4~6周龄BALB/c雌性小鼠9只,随机分为SEZ WT、SEZ △pepO、SEZ C△pepO3个处理组,每组3只。3组小鼠分别经尾静脉注射培养至对数期的菌悬液105CFU(LD50),24 h后经安乐法处死。无菌条件下称取脑组织,每0.1 g加900 μL无菌生理盐水,组织匀浆后进行梯度稀释,各梯度吸取100 μL涂布于THB平板,37℃倒置培养过夜,采用平板计数法计算小鼠脑组织中的细菌载量。
1.13 小鼠脑组织病理切片观察将培养至对数期的SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液分别经尾静脉攻毒小鼠105CFU(LD50)菌悬液,48 h后经安乐法处死小鼠。分别取各组小鼠脑组织固定于10%多聚甲醛,送至武汉赛维尔生物科技有限公司进行HE切片制作,观察病理变化。
1.14 细菌对hBMEC细胞黏附侵袭能力测定参照ESGLEAS等[25]方法检测SEZ WT、SEZ △pepO、SEZ C△pepO菌株对hBMEC细胞的黏附侵袭能力。
1.15 细菌穿透体外血脑屏障模型能力测定选取生长良好的hBMEC细胞为体外血脑屏障模型细胞,待其生长至致密单层传代至已包被鼠尾胶原蛋白Ⅰ型的Transwell上室中,包被质量浓度为10 μg/cm2;使用含10%胎牛血清的DMEM培养基培养2~3 d至致密单层后,更换含5%胎牛血清的DMEM培养基继续培养;每2~3 d换液,每天于同一时间点用细胞电阻仪检测并记录细胞跨膜电阻值;培养至第9天时,细胞电阻值大于80 Ωcm2,可用于后续细菌穿透试验[12]。将培养至对数期的SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液用DMEM稀释后接种至血脑屏障模型Transwell上室中(MOI=10),下室加入1.5 mL DMEM培养液,置于37℃、5% CO2温箱培养2 h,吸取下室培养液梯度稀释后各取100 μL涂布于THB平板,37℃倒置培养过夜,采用平板计数法计算细菌穿透率,试验重复3次。
2 结果
2.1pepO基因缺失株构建将重组自杀质粒pepO-pSET4s电转至SEZ ATCC35246感受态细胞中,挑取在含壮观霉素的THB平板不生长,但在无抗THB平板生长的疑似菌落进行PCR鉴定。结果如图1所示,使用pepO基因内部引物IN-F/R进行PCR鉴定,野生株可扩增出大小为303 bp的条带,而pepO基因缺失株SEZ △pepO没有条带(图1A);使用pepO基因外部引物OUT-F/R进行PCR鉴定,野生株与缺失株SEZ △pepO条带大小相差1 873 bp(图1B),PCR及测序结果表明pepO基因缺失株SEZ △pepO构建成功。
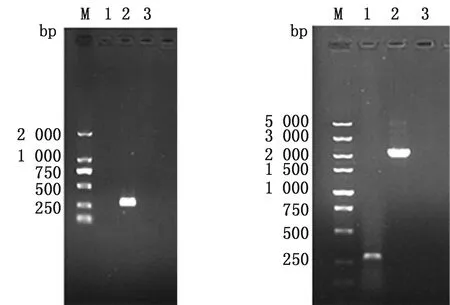
A.IN-F/R PCR扩增;B.OUT-F/R PCR扩增。M.DL2000/5000 DNA Marker;1.缺失株基因组;2.野生株基因组;3.阴性对照
2.2pepO基因互补株构建互补质粒pepO-pSET2电转化至SEZ △pepO感受态细胞中,用引物SEZ-pepO-pSET2F/R进行PCR扩增。结果如图2所示,扩增出大小为1 893 bp的条带,与预期相符,表明pepO基因互补株SEZ C△pepO构建成功。
M.DL2000 DNA Marker; 1.互补质粒; 2,3.互补株鉴定; 4.阴性对照
2.3 细菌形态特征及染色特性结果如图3所示,SEZ WT、SEZ △pepO、SEZ C△pepO均在24 h内长出露滴状、半透明菌落,革兰染色镜检均可见革兰阳性球菌,以短链或长链状排列,结果显示pepO基因缺失不影响细菌形态特征及染色特性。

图3 SEZ WT、SEZ △pepO、SEZ C△pepO形态特征(A)及染色特性(B)(1 000×)
2.4 细菌生化试验挑取单克隆菌落接种于生化管中,37℃培养24 h观察结果。结果如表3所示,SEZ WT、SEZ △pepO、SEZ C△pepO葡萄糖、麦芽糖、蔗糖、乳糖、山梨醇及硝酸盐还原试验均为阳性,七叶苷、棉子糖、甘露醇、阿拉伯糖及蕈糖试验均为阴性,表明pepO基因缺失不影响细菌生化特性。
2.5 细菌生长曲线测定根据测定结果,利用软件Graphpad Prism 8.0绘制SEZ WT、SEZ △pepO、SEZ C△pepO菌株的生长曲线并进行显著性分析。结果如图4所示,3株菌的生长速率无显著性差异(P>0.05),表明pepO基因缺失对其生长速率没有影响。

图4 SEZ WT、SEZ △pepO、SEZ C△pepO细菌生长曲线
2.6 小鼠感染细菌存活率测定分别将SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液经腹腔攻毒小鼠,每12 h观察并记录小鼠的存活情况,利用软件Graphpad Prism 8.0绘制存活曲线并进行显著性分析。结果如图5所示,SEZ WT感染组24 h开始死亡,48 h全部死亡;SEZ △pepO感染组24 h开始死亡,108 h全部死亡;SEZ C△pepO感染组24 h开始死亡,72 h全部死亡;说明SEZ △pepO感染组小鼠存活时间较SEZ WT感染组和SEZ C△pepO感染组小鼠显著增加(P<0.05),表明SEZ △pepO毒力显著下降。

**表示差异显著(P<0.05);ns表示无显著性差异(P>0.05)
2.7 细菌全血存活率测定将105CFU/mL SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液按1∶9加至小鼠抗凝血中混匀,37℃、220 r/min培养,分别于30和60 min取样,采用平板计数法计算细菌在小鼠全血中的存活率,使用软件GraphPad Prism 8绘制柱状图并进行显著性分析。结果如图6所示,培养30和60 min,SEZ WT、SEZ △pepO、SEZ C△pepO菌株在全血中的存活率均无显著性差异(P>0.05)。
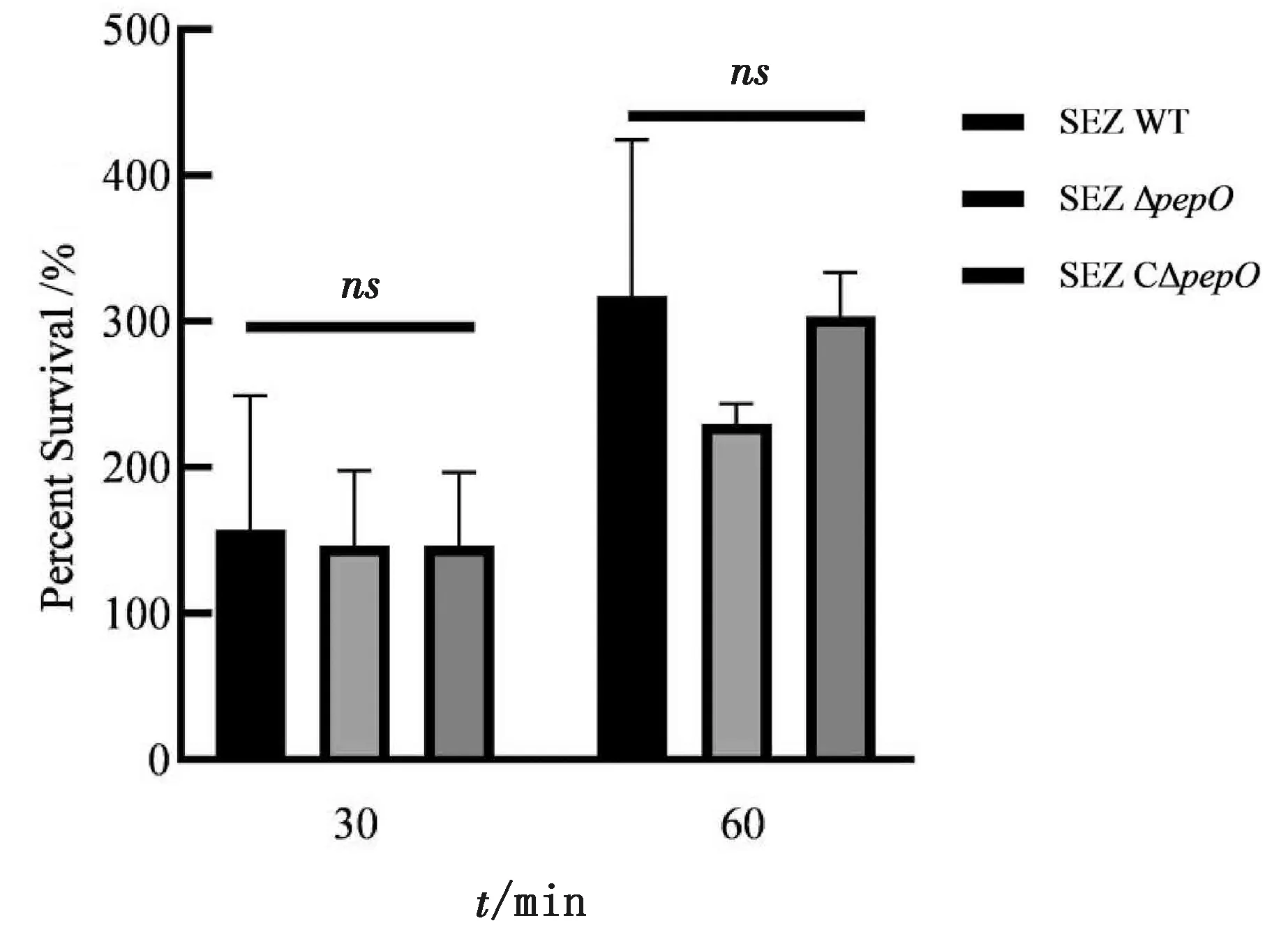
ns表示无显著性差异(P>0.05)
2.8 小鼠脑组织细菌载量测定在无菌条件下称取不同感染组小鼠脑组织0.1 g,加入900 μL无菌PBS进行组织匀浆,倍比稀释后采用平板计数法进行菌落计数,计算1 g脑组织的细菌载量,使用软件GraphPad Prism 8.0绘制柱状图并进行显著性分析。结果如图7所示,与SEZ WT处理组相比,SEZ △pepO处理组脑组织中的细菌载量显著下降(P<0.05),SEZ C△pepO组脑组织中的细菌载量无明显差异(P>0.05)。

**表示差异显著(P<0.05);ns表示无显著性差异(P>0.05)
2.9 小鼠脑组织病理切片观察取各组小鼠脑组织,结果如图8所示,SEZ WT和SEZ C△pepO感染组小鼠脑组织出现明显充血出血及水肿,病理切片见大量出血及炎性细胞浸润,SEZ △pepO感染组未见明显病变。
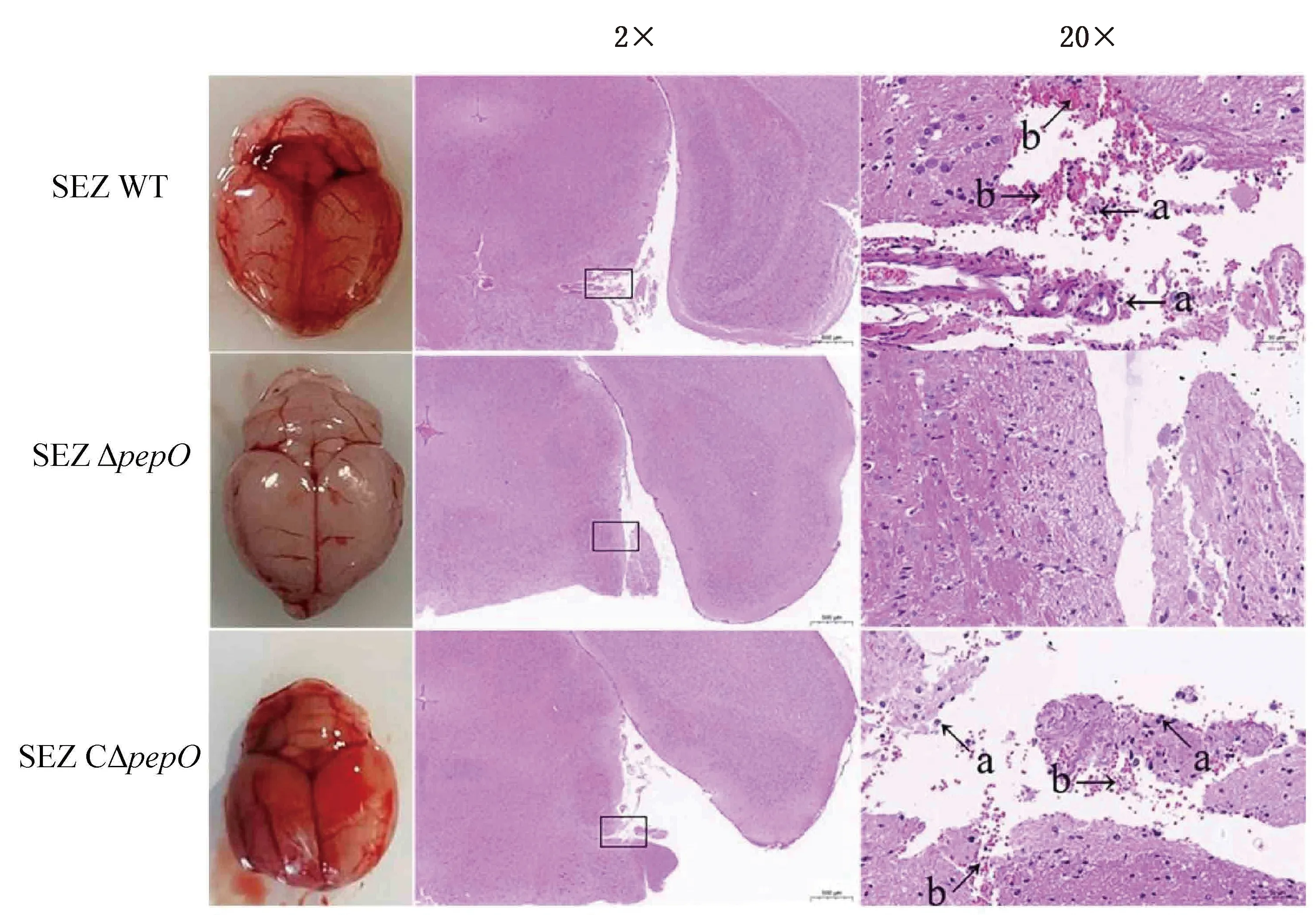
注:a.炎性细胞浸润;b.出血
2.10 细菌对hBMEC细胞的黏附侵袭能力测定将SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液感染hBMEC细胞,通过平板计数法计算细菌黏附侵袭率,使用软件GraphPad Prism 8.0绘制柱状图并进行显著性分析。结果如图9所示,与SEZ WT组和SEZ C△pepO组相比,SEZ △pepO组对hBMEC细胞内黏附侵袭率显著降低(P<0.001)。

***表示差异极显著(P<0.001)
2.11 细菌穿透体外血脑屏障模型能力测定选择hBMEC细胞构建体外血脑屏障模型,将新鲜培养的SEZ WT、SEZ △pepO、SEZ C△pepO菌悬液接种至Transwell上室培养2 h,通过平板计数法计算细菌穿透率。结果如图10所示,与SEZ WT组和SEZ C△pepO组相比,SEZ △pepO组对体外血脑屏障模型的穿透率显著降低(P<0.001)。

***表示差异极显著(P<0.001)
3 讨论
SEZ是可引起人和动物脑膜炎的人兽共患病病原菌,其穿透血脑屏障相关机制仍有待研究[4-6]。前期研究筛选出SEZ ATCC35246株分泌蛋白PepO可显著黏附于脑微血管内皮细胞,可能是SEZ突破血脑屏障相关的潜在毒力因子。
本研究对编码SEZ PepO蛋白的pepO基因进行研究,成功构建了SEZ ATCC35246株的pepO基因缺失株及pepO基因互补株,研究结果表明pepO基因缺失后对SEZ的形态特征以及生长速率均无显著影响,这与副血链球菌pepO基因缺失后生长速率变化相一致[26],说明pepO基因不是SEZ生长代谢所必需的基因,但可能与其致病力有关。小鼠存活率试验结果初步证实pepO基因在SEZ毒力中发挥着重要作用,这与BROUWER等[19]在化脓性链球菌研究结果相一致,表明pepO基因与SEZ毒力密切相关。细菌的一些毒力因子有助于其通过逃避机体的杀伤作用而在血液中增殖,随血流到达脑组织,突破血脑屏障后损伤中枢神经系统,因此抵抗血液杀菌能力被认为与细菌致病能力相关[27-29]。本研究发现pepO基因缺失后不影响SEZ在血液中的存活率,但AGARWAL等[18]报道的肺炎链球菌pepO基因缺失后细菌在血液中的存活率显著降低,这说明pepO基因可能参与肺炎链球菌抵抗血液杀菌作用,但不参与SEZ抵抗血液杀菌作用,有助于SEZ逃避宿主清除作用。细菌感染小鼠试验发现pepO基因缺失后小鼠脑组织细菌载量显著降低,病理切片未见明显病变,这与LIU 等[22]报道的猪链球菌研究结果相似,说明SEZ在脑组织中的定殖能力降低不是由其宿主杀伤作用造成的,而是与其穿透血脑屏障能力有关,进一步表明pepO基因有助于SEZ逃避宿主清除作用,促进对脑组织的入侵,从而影响其穿透血脑屏障的能力。
毒力因子穿透血脑屏障的方式并不完全相同,比如SEZ毒力蛋白BifA,通过与细胞膜骨架蛋白moesin结合促进RhoA活化,改变hBMEC形态及细胞骨架变化,从而破坏血脑屏障[12];猪链球菌毒力因子stk则是通过破坏脑微血管内皮细胞之间的紧密连接,介导细胞旁途径突破宿主血脑屏障[30]。本研究发现pepO基因缺失后SEZ对hBMEC细胞的黏附侵袭能力和体外血脑屏障模型的穿透能力均显著降低,与AGARWAL等[18]研究结果相似,表明PepO通过促进SEZ对脑微血管内皮细胞的黏附侵袭,增强了对血脑屏障的穿透能力。但PepO通过怎样的途径黏附于脑微血管内皮细胞以及促进SEZ突破血脑屏障的具体机制与已报道穿透机制是否存在异同有待进一步研究。
本研究成功构建了SEZ ATCC35246株pepO基因缺失株及互补株,证实了pepO基因不是SEZ生长代谢所必需的基因,通过促进SEZ对脑微血管内皮细胞的黏附侵袭,增强SEZ穿透血脑屏障的能力,从而发挥其毒力作用。该研究结果有助于进一步阐明SEZ致脑膜炎机制。

