猪IFN-α14的表达、纯化及抗病毒活性分析
方剑玉,白 杰,2,席燕燕,2,黄慧敏,徐引弟,王改利,2,张青娴,徐 彬,2,李绍钰,2*,王克领*
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;2.畜禽繁育与营养调控河南省重点实验室,河南 郑州 450002;3.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002)
目前发现与动物传染病相关的病毒至少200多种,通过疫苗接种等措施控制了多种病毒的传播和感染暴发,但是目前猪群仍然呈现多种病毒混合感染,尤其是近年来猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒、非洲猪瘟病毒的出现和流行,给我国养猪业造成了巨大的经济损失。其中,猪流行型腹泻(porcine epidemic diarrhea,PED)是由冠状病毒属的猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性肠道传染病[1]。该病毒可感染所有年龄段的猪,特别是新生仔猪。PEDV主要感染猪小肠上皮细胞,导致明显的肠道充血及绒毛萎缩,引起水样腹泻、呕吐、厌食、脱水,发病率和死亡率较高[2]。尽管目前有商业化疫苗用于该病的预防和治疗,但在我国仍频繁引起地方性流行[3]。因此,研究和开发新型高效的抗病毒药物已经成为目前保证养猪行业健康发展的当务之急。
干扰素(IFN)是一类具有广谱抗病毒、抗肿瘤和免疫调节功能的细胞因子。1975年,ISAACS等[4-5]首次在试验中发现一种可溶性物质,对流感病毒具有抑制增值的作用,因此将这种物质命名为IFN。正常生理条件下,机体IFN的分泌量很低,受到病毒或者细菌等诱导物质刺激时,IFN会迅速大量产生,成为机体第一道感染防线。由于IFN的抗病毒功能,已经广泛应于人类和动物临床多种病毒病的治疗[6]。IFN根据其细胞表面受体、基因序列以及其在染色体上的定位不同,IFN国际命名委员会将IFN分为3大类:Ⅰ、Ⅱ和Ⅲ型[7]。其中Ⅰ型IFN的抗病毒活性最强,其基因主要分布于1和10号染色体上,猪的Ⅰ型IFN包括17个IFN-α亚型,11个IFN-δ亚型,7个IFN-ω亚型和单一的IFN-β、IFN-К、IFN-ε亚型[8- 9]。IFN-α是一种分泌蛋白,这种糖蛋白在体内由信号肽引导IFN-α分泌到细胞外后,信号肽被切割分解,形成成熟的IFN,多数IFN-α翻译后均没有进行糖基化修饰[10]。
研究证明猪的不同IFN-α亚型之间虽然氨基酸同源性较高,但其抗病毒活性差异较大,目前针对猪IFN-α14抗病毒活性报道较少。为更为详细了解猪不同亚型IFN-α的抗病毒活性,本研究合成了猪IFN-α14的成熟肽基因,采用大肠杆菌进行表达后,进行Ni琼脂糖凝胶柱亲和层析纯化,检测了纯化猪IFN-α14对PEDV的抗病毒活性。
1 材料与方法
1.1 毒株、细胞与质粒含His-Tag的原核表达载体pCSMH由本实验室保存;VERO细胞由本实验室保存;PEDV 毒株(MK124712)由河南省农业科学院免疫学重点实验室惠赠;原核表达并纯化的猪IFN-α2、8蛋白由本实验室保存。
1.2 主要试剂预染蛋白Marker、氨苄青霉素(ampicillin)、DMEM细胞培养液、Ni-NTA琼脂糖凝胶、尿素、盐酸胍购自北京索莱宝科技有限公司;DH5α感受态细胞、XhoⅠ和BamHⅠ限制性内切酶购自TaKaRa生物工程有限公司;核酸提取试剂盒、质粒提取试剂盒、反转录试剂HiScript Ⅲ RT SuperMix for qPCR (+gDNA wiper)、SYBR Green Real-time PCR Master Mix试剂盒、T4连接酶均购自南京诺唯赞生物科技股份有限公司;鼠源抗猪IFN-α多克隆抗体购自武汉云克隆科技股份有限公司;羊抗鼠荧光二抗(IRDye®680RD)购自美国LI-COR公司。
1.3 引物用于荧光定量PCR扩增用引物见表1,由上海生工生物工程股份有限公司进行合成。

表1 实时荧光定量PCR引物序列
1.4 重组质粒pCSMH-poIFN-α14的构建猪IFN-α14基因序列(GQ415068)由DNASTAR软件进行序列分析后,在序列两端加入XhoⅠ和BamHⅠ限制性内切酶基因序列和His标签后,由上海生工生物工程有限公司进行基因合成,利用XhoⅠ和BamHⅠ限制性内切酶对合成的猪IFN-α14基因序列和pCSMH质粒双酶切后,进行琼脂糖电泳。采用凝胶回收试剂盒进行DNA纯化,将目的基因与质粒片段在16℃连接15 min构建重组质粒,命名为pCSMH-poIFN-α14。将连接产物转化DH5α感受态细胞,筛选阳性克隆,提取质粒后进行酶切鉴定,并送上海生工生物工程有限公司进行测序。
1.5 重组猪IFN-α14工程菌的诱导表达及分离纯化将阳性单克隆菌落接种至含氨苄的LB培养基,37℃、180 r/min振荡培养至菌液D值为0.6~0.8。将菌液转移至42℃、200 r/min振荡培养6 h,收集菌体, 6 000 r/min离心15 min,弃上清,加入PBS (pH=7.0) 洗涤菌体,重复清洗1次;按照菌体∶溶解buffer(50 mmol/L NaH2PO4,300 mmol/L NaCl,pH=8.0)1∶10 (W/V) 将菌体悬浮混匀,加入终浓度为 1 mmol/L PMSF和0.2~0.4 g/L溶菌酶,冰上孵育20 min。将菌体用超声破碎仪进行破碎,设置功率为5%,超声5 s间歇5 s,超声25 min至菌液澄清;将破碎后菌液转移至离心管中,12 000 r/min、4℃离心 20 min,弃上清,用菌体裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,6 mol/L guanidine hydrochloride,pH=8.0)将包涵体悬浮,采用Ni-琼脂糖凝胶纯化柱对重组猪IFN-α14蛋白进行分离纯化。分段收集流出液,每1个柱体积收集1管,分别对纯化后的蛋白进行检测。
1.6 Western blot 检测猪IFN-α14的特异性将纯化后的猪干扰素-α14蛋白进行SDS-PAGE电泳,并将目的蛋白转印NC膜,23 V电压转印15 min。采用鼠源抗猪IFN的抗体进行Western blot,检测表达蛋白的特异性。
1.7 PEDV滴度测定将Vero细胞接种96孔板,待长成单层后,用无钙、镁离子的Hank’s (37℃预热)稀释洗涤2次,弃去残留液体。取待检PEDV样品,用含4 mg/L胰酶的DMEM稀释液,将病毒液进行10×倍比连续稀释至×10-11,稀释体系为100 μL病毒液添加900 μL稀释液。将稀释好的病毒液接种至96孔Vero细胞培养板中,每个稀释度接种8个孔,100 μL/孔。放置37℃ 5% CO2培养箱中培养,每天观察细胞病变情况,培养3~5 d,并计算TCID50。计算公式:距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数);logTCID50=距离比例×稀释度对数之间的差+高于50%病变率的稀释度对数。
1.8 荧光定量PCR采用OMIGA RNA提取试剂盒提取细胞总RNA,利用南京Vazyme公司的HiScript Ⅲ RT SuperMix for qPCR (+gDNA wiper)反转录试剂盒合成cDNA,反转录体系及反应过程如下:加入8 μL提取RNA模板(总RNA不超过500 ng),2 μL 5 × qRT SuperMixⅡ,然后25℃ 10 min,50℃ 30 min,85℃ 5 min进行反转录反应。合成的cDNA用南京Vazyme公司的SYBR Green Real-time PCR Master Mix预混酶在ABI公司7300型全自动荧光定量PCR仪上进行PCR扩增反应,β-actin基因作为内参。反应条件为:预变性95℃ 5 min,扩增程序为95℃ 10 s,60℃ 30 s共40个循环,并添加溶解曲线。反应结束后利用ABI 7300软件分析数据。本研究采用2-△△Ct相对定量。计算公式:Ct目的基因-Ct内参基因=△Ct;△Ct处理样本-△Ct对照样本=△△Ct;倍数变化 = 2-△△Ct。
1.9 在Vero细胞上检测重组猪IFN-α14抑制PEDV复制的活性将Vero细胞接种至24孔板,每孔2×105个细胞,待细胞铺满单层后,分别加入质量浓度为0.1,1.0,10.0 μg/L重组IFN处理Vero细胞,同时设置未处理对照组。24 h后接种103TCID50的PEDV,感染48 h后收集细胞,采用RNA提取试剂盒提取细胞总RNA,采用HiScript Ⅲ RT SuperMix for qPCR (+gDNA wiper)进行反转录,用SYBR Green Real-time PCR Master Mix试剂盒进行荧光定量PCR检测细胞内PEDV水平,同时收集细胞上清,并检测其TCID50。
1.10 猪IFN-α14抑制细胞增殖试验用CellTiter96@AQueous one solution cell proliferation assay(Promega生物公司)检测重组猪IFN-α14对Vero的细胞毒性。将Vero细胞铺96孔板,待长成单层后,取10 μg/L重组猪IFN-α14加入Vero细胞单层后24 h,加入20 μL的Cell Titer 96®Aqueous 单溶液试剂并直接加入到96细胞板培养孔中,孵育1~4 h,然后在96 孔板读板仪上记录D490 nm值。D490 nm值与培养物中活细胞的数量直接成正比。
2 结果
2.1 重组表达质粒pCMSH-poIFN-α14的鉴定将猪IFN-α14基因去掉信号肽序列,加入BamHⅠ和XhoⅠ酶切位点和his标签序列后,进行密码子优化,送上海生工生物有限公司进行基因合成。将合成目的片段和pCMSH质粒分别采用BamHⅠ和XhoⅠ酶切、连接、转化DH5α感受态细胞,提取质粒采用BamHⅠ和XhoⅠ酶切鉴定后,进行琼脂糖凝胶电泳,结果在3 800,545 bp位置可观察到目的特异性条带(图1),与目的片段大小相符。并对目的片段进行测序分析,结果证明pCMSH-poIFN-α14重组质粒构建成功。

M.DL5000 DNA Marker;1.重组pCSMH-poIFN-α14质粒双酶切产物
2.2 重组猪IFN-α14蛋白的大肠杆菌温度诱导表达将包含pCMSH-poIFN-α14重组质粒的菌液接种液体LB培养基,在37℃振荡培养至菌液D值达0.6~0.8后,将温度提升至42℃进行诱导表达,进行SDS-PAGE电泳鉴定,在19.1 kDa位置可见目的条带,与预期大小一致,表达蛋白以包涵体形式存在(图2)。

M.蛋白Marker;1.未诱导对照;2.重组猪IFN-α14蛋白诱导表达
2.3 重组猪IFN-α14蛋白的纯化将表达后蛋白采用Ni+琼脂糖凝胶进行亲和层析纯化复性后,采用SDS-PAGE电泳进行鉴定,结果显示纯化后蛋白纯度可达到90%以上(图3)。

M.蛋白Marker;1.纯化蛋白猪IFN-α14
2.4 Western blot试验检测猪IFN-α14将大肠杆菌表达的重组蛋白猪IFN-α14进行SDS-PAGE电泳后,转印NC膜,采用鼠源抗猪IFN-α亚型的特异性抗体进行Western blot试验,在预期的位置出现目的条带,未见空载体转化大肠杆菌出现特异性条带,证明本研究所表达重组猪IFN-α14反应原性较好(图4)。
2.5 猪IFN-α14蛋白在Vero细胞上对PEDV的抑制作用将Vero细胞铺24孔板后,分别用100,10,1 μg/L的IFN-α14处理Vero细胞,24 h 后接种1 000 TCID50PEDV。感染后48 h收集细胞,采用荧光定量PCR检测细胞内PEDV的RNA水平,结果显示10 μg/L IFN-α14可显著抑制PEDV在细胞内的复制。同时,收集细胞上清,检测细胞上清中PEDV的TCID50。结果显示,1 μg/L的IFN-α14处理细胞,病毒核酸拷贝数和TCID50被显著抑制,随着IFN-α14质量浓度的提升,10 μg/L的抑制作用极为显著,而100 μg/L的抑制作用与10 μg/L的相当。表明10 μg/L的重组猪IFN-α14能显著抑制PEDV的复制(图5A,B),且抗病毒效果优于poIFN-α2、8(图5C、D)。

1.重组猪IFN-α14蛋白;2.阴性对照
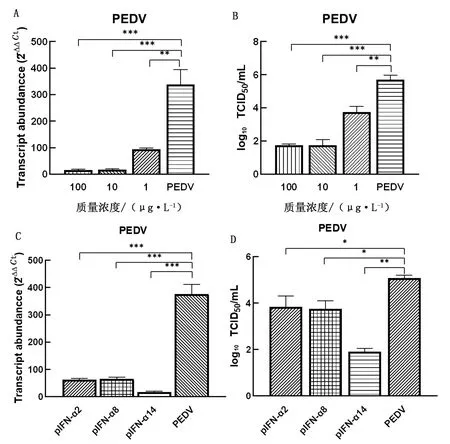
*表示与对照组相比差异较显著(P<0.05),**表示与对照组相比差异显著(P<0.01),***表示与对照组相比差异极显著(P<0.001)
2.6 猪IFN-α14抑制细胞增殖试验重组猪IFN-α14处理铺满96孔板的Vero细胞24 h后,加入20 μL 的Cell Titer 96®Aqueous 单溶液试剂,孵育1~4 h,然后在读板仪上记录D490 nm值。结果显示,10 μg/L猪IFN-α14处理的细胞和空白对照细胞吸光值无明显差异,表明重组猪IFN-α14对Vero细胞的增殖无明显的影响(图6)。

图6 猪IFN-α14对Vero细胞增殖的影响
3 讨论
猪Ⅰ型IFN最初因其抗病毒活性被发现后[11],逐渐证明其具有抗肿瘤和免疫调节活性等功能。其中,猪的IFN-α和IFN-β亚型IFN抗病毒活性最强[9]。当前,Ⅰ型IFN已经在人和猪临床上广泛用于病毒性疾病的治疗,例如乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)、人类免疫缺陷病毒(human immunodeficiency,HIV)、人乳头瘤病毒(human papilloma virus,HPV)、猪繁殖与呼吸障碍综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)、非洲猪瘟病毒(African swine fever virus,ASFV)等[12-15]。尽管如此,由于副作用较大,活性不高、半衰期短等问题,限制了IFN制剂在临床上的应用。因此,开发高效低毒的IFN抗病毒制剂对当前临床疫病的防治具有重要意义。
当前IFN产品虽然具有一定的抗病毒效果,但在临床上还远远没有满足对各种病毒性疾病预防和治疗的要求。多个专家学者采用各种蛋白突变和改构等方法来提高IFN的抗病毒活性,降低其毒副作用。研究报道对人IFN-α进行蛋白质改构后,获得新型IFN制剂“乐复能”目前已广泛应用于HBV的临床治疗,且中国疾控中心病毒研究所证明“乐复能”对新冠病毒感染复制具有显著的抑制作用[16-17]。HUANG等[18-19]也先后尝试对猪IFN-α的氨基酸进行突变以提高IFN的抗病毒活性,研究证明氨基酸突变在一定程度可有效提高IFN的抗病毒活性。研究证明猪的IFN-α亚型抗病毒活性最强,且猪不同IFN-α亚型诱导机体抗病毒反应的能力差异较大[20-21]。本研究克隆并表达了重组猪IFN-α14蛋白,结果证10 μg/L的IFN-α14能有效抑制PEDV的复制,并与前期本实验室表达的猪重组IFN-α2、8相比,抗病毒效果更佳,该差异可能源于IFN与受体蛋白亲和力的差异。通过研究比较多种亚型IFN-α的抗病毒效果,为更好的改构IFN并提高其抗病毒效果具有重要意义。
有研究学者采用真核表达、原核表达等多种表达系统对猪的IFN进行表达,结果证明大肠杆菌表达系统具有表达时间短、成低廉、易于纯化等多种有点。目前多种IFN产品主要是采用大肠杆菌表达系统进行表达。本研究采用温度诱导发酵培养猪IFN-α14蛋白,相比较化学诱导剂IPTG诱导发酵过程中需要增加诱导剂的情况,温度诱导可进一步降低成本,且更方便于大规模生产。采用亲和层析方法纯化后,蛋白纯度可达到90%以上。

