猪粪便微生物移植小鼠肠道菌群结构演替分析
宋园园 施伟领 章啸君 杨 华 吴酬飞 肖英平*
(1.湖州师范学院生命科学学院,湖州 313000;2.浙江农业科学院省部共建农产品质量安全危害因子与风险防控国家重点实验室,农产品质量安全与营养研究所,杭州 310021;3.浙江大飞龙动物保健品有限公司,金华 321017;4.金华市农业科学研究院畜牧兽医研究所,金华 321017)
微生物群对宿主的健康至关重要[1],对食物消化吸收、宿主营养、肠道发育、免疫应答、生理调节都具有显著的影响[2-4]。肠道微生物可以帮助宿主分解难以消化吸收的成分以及保护宿主免受病原菌的入侵[5]。粪便微生物移植(fecal microbiota transplantation,FMT)是指通过筛选供体、制备粪菌、科学选择菌群移植途径,向受体的肠道内移植健康供体粪便的功能菌群,恢复和维持肠道菌群生态平衡[6],是一种历史悠久的微生物治疗策略[7]。FMT技术通过移植肠道微生物,引起抗菌肽、有机酸等抗微生物物质的产生,进而杀灭致病菌,达到治愈改良的效果。FMT干预改变肠道微生物组成结构和多样性,这种变化可调节肠道菌群的代谢产物,可改善肠道黏膜屏障功能;肠道微生物群及其代谢产物均可影响免疫系统的发育和分化,促进免疫细胞和免疫因子等免疫物质的生成[8]。
Yang等[9]对31例混合型便秘患者进行为期1个月的生物反馈疗法和生物反馈疗法联合FMT治疗发现,FMT联合的治疗效果更好,且患者粪便中普氏菌属(Prevotella)和双歧杆菌属(Bifidobacterium)相对丰度增加。另有外国学者研究报道,30名HIV感染者每周随机接受粪菌胶囊8周后,患者肠道微生物多样性明显增加,且毛螺菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)相对丰度增加,从而调节感染者菌群失调[10]。FMT也应用于维持动物健康以及促进动物的生产,随着无抗饲料的推广,FMT有望推动畜牧行业向绿色健康养殖方向发展[11]。目前,FMT技术在猪养殖业方面的应用主要是调节新生仔猪肠道菌群,优化仔猪肠道菌群结构,提高肠道健康水平[8]。其中在猪肠道微生物调控宿主生长的代谢机理研究中,通常采用小鼠作为研究模型[12]探究跨物种肠道菌群移植对动物肠道发育的影响。Wu等[13]将金华猪和长白猪作为粪菌移植的供体,受体是经广谱抗生素处理过的小鼠,粪菌移植结果发现金华猪和长白猪粪便微生物重建了小鼠空肠和结肠的肠道微生物。Yan等[14]研究发现,通过FMT可以将瘦肉型长白猪和脂肪型荣昌猪骨骼肌的纤维特征和脂质代谢特征转移到无菌小鼠身上。Diao等[15]将藏猪、约克郡猪和荣昌猪3种不同品种猪的粪便悬浮液灌胃于新生无菌小鼠,结果表明无菌小鼠重现了猪的表型,且表现出不同的肠道特征和形态。FMT群落演替是一个动态的、受遗传控制的过程,受体肠道菌群演替的过程也是与宿主建立共生关系的过程,研究群落演替对预测FMT的效果及其对宿主健康和疾病的影响至关重要[16-17],且对针对性的微生物群治疗具有重要意义。但是目前大部分研究主要聚焦于动物FMT后受体某1个时间点的肠道菌群,对于移植过程中菌群的动态变化依然未知,鲜见有关于小鼠FMT后菌群变化和规律的研究。本研究中选取金华猪和长白猪2个不同代表性猪品种作为微生物的供体,其中金华猪是我国优良猪种,生长缓慢,体脂含量高,而长白猪生长速度快,瘦肉率高,是优良外来品种[13],分析金华猪和长白猪FMT小鼠不同时间点菌群和代谢产物短链脂肪酸(short-chain fatty acids, SCFAs)含量的演替规律,以及探析不同品种猪FMT小鼠的肠道菌群差异。通过跟踪受体小鼠肠道菌群组成随移植时间的演替变化,为经济动物肠道微生物的功能研究提供基础数据,为跨物种的FMT奠定理论基础,也为FMT过程中受体肠道微生物结构的演替提供参考依据。
1 材料与方法
1.1 猪供体粪便及粪便微生物菌悬液的制备
猪供体粪便同前期的研究[18],具体为:选取饲养于同一环境中的10头金华猪和10头长白猪,每个品种公、母猪数量各占1/2,饲喂标准的商业玉米-大豆型饲粮,饲粮中无添加抗生素。在240日龄时收集猪的新鲜粪便,根据品种进行等量混合,生成“代表性”粪便样本。猪粪便微生物菌悬液的制备:取1 g粪便加入4 mL无菌生理盐水即稀释5倍用于制作粪便微生物接种物。
1.2 小鼠抗生素处理与粪菌移植处理
选取24只4周龄无特定病原菌(SPF)C57BL/6J小鼠(斯贝福生物技术有限公司,北京),在无菌隔离包内饲养,恒温23 ℃,相对湿度为63%,昼夜12 h循环光照,饲粮为无菌的标准颗粒鼠粮,自由饮水和采食。试验处理同前期的研究[18]:向饮用水中添加1 g/L氨苄西林、1 g/L硫酸新霉素、0.5 g/L万古霉素和1 g/L甲硝唑抗生素混合物,小鼠口服28 d以去除肠道内共生细菌;将抗生素处理过的小鼠随机分成2组(每组12只,雌雄各占1/2),一组灌胃金华猪的粪便微生物菌悬液,另外一组灌胃长白猪粪便微生物菌悬液,灌胃剂量每天每只小鼠为0.2 mL,连续灌胃7 d,分别在灌胃第1、2、4和7天及在停止灌胃后的第7、14、21和28天收集小鼠的新鲜粪便,用于后续提DNA和测序。
1.3 DNA提取和16S rRNA基因扩增
定量称取0.1 g小鼠粪便,使用QIAamp DNA Stool Mini Kit(QIAGEN)试剂盒从小鼠粪便中提取基因组DNA,用正向引物338F和反向引物806R通过聚合酶链式反应扩增细菌16S rRNA基因的V3~V4区,引物序列338F为5’-ACTCCTACGGGAGGCAGCA-3’和806R为5’-GGACTACHVGGGTWTCTAAT-3’。
1.4 Illumina HiSeq测序和生物信息学分析
使用Illumina HiSeq对PCR扩增的V3~V4区测序。随后测序数据用QIIME进行分析。操作分类单元(OTU)以97%的同一阈值进行组装,将全部OTU的代表性序列与RDP和Sliva数据库进行对比和物种注释。计算Goods coverage以估计样本占总物种的百分比,构建了在门和属水平上显示物种分布的柱状图。用QIIME软件计算α多样性指数与β多样性指数,并用R software作图,主坐标分析(PCoA)利用加权UniFrac法进行分析。
1.5 细菌相对丰度的实时荧光定量PCR(RT-PCR)分析
参照Xu等[19]的引物序列对小鼠粪样中细菌总数的相对丰度进行RT-PCR分析,引物为5’-CGGYCCAGACTCCTACGGG-3’和5’-TTACCGCGGCTGCTGGCA-3’。RT-PCR使用SYBR Green PCR Master Mix在ABI 7900 HT快速检测系统中进行。PCR反应混合物包括:5.0 μL SYBR Green qPCR mix,正向和反向引物各0.5 μL,4.0 μL ddH2O。根据不同浓度细菌总DNA,添加不同体积模板量保证体系中总细菌DNA的量一致。RT-PCR反应条件:预变性程序95 ℃,2 min;扩增定量程序为95 ℃,15 s;58 ℃,45 s;72 ℃,1 min;35个循环,熔解曲线程序为60~95 ℃,20 min,每秒增加0.1 ℃持续检测荧光[20]。每个样品做3个平行。将测得的Ct值联合标准曲线计算得到小鼠粪便样品中相应的DNA拷贝数,采用2-△△Ct对定量结果进行整理分析。
1.6 粪便SCFAs含量的测定
称取小鼠0.1 g左右粪便样本溶于1 mL去离子水中,涡旋使其混匀,9 850×g离心10 min,取1 mL上清液转移至新的离心管中,随后加入200 μL丁烯酸,滤膜(0.22 μm)过滤。得到的溶液利用气相色谱(GC)分析仪测定SCFAs含量。色谱条件:汽化室温度180 ℃,毛细管色谱柱(TnertCAPFFAP)柱温110 ℃;载气是氮气,压力为60 kPa,燃烧气氢气压力为50 kPa,氧气压力为50 kPa,氢火焰离子化检测仪(FID)温度180 ℃。
2 结 果
2.1 受体小鼠粪便细菌总数
通过RT-PCR分析发现,受体小鼠单位质量粪便中细菌总数在移植过程中逐渐增多(图1),而停止移植后细菌总数变化较小且基本保持稳定。
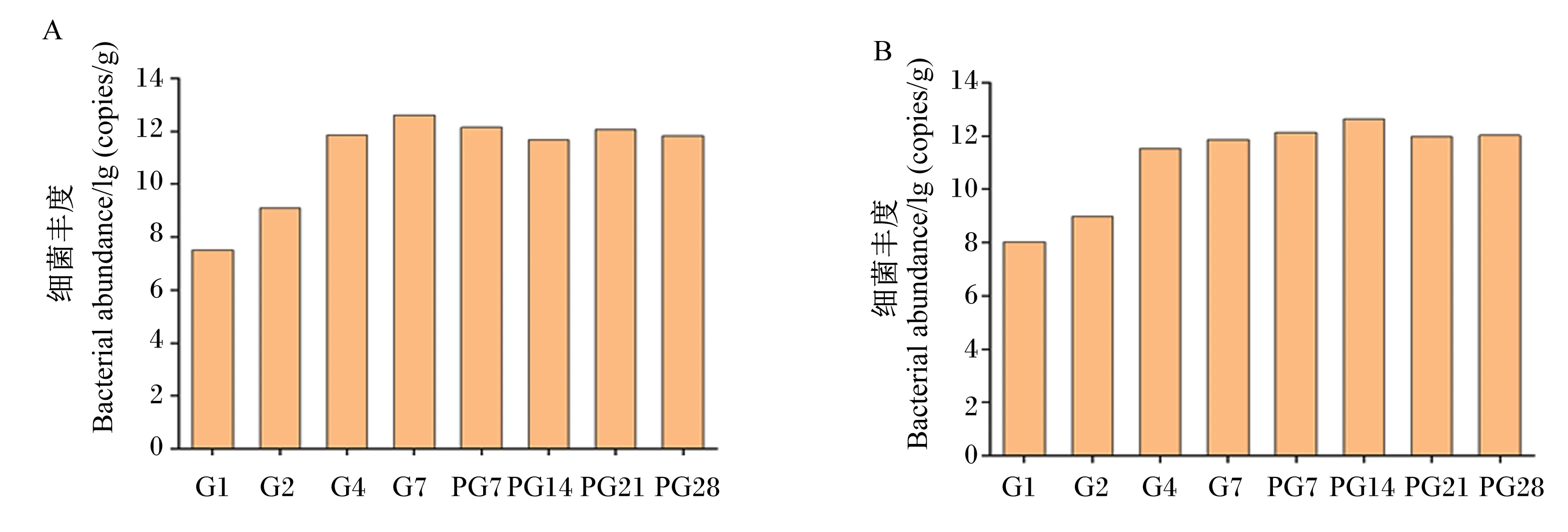
A:金华猪粪便微生物移植小鼠 mice with Jinhua pig fecal microbiota transplantation;B:长白猪粪便微生物移植小鼠 mice with Landrace pig fecal microbiota transplantation。G1、G2、G4、G7表示移植过程中的第1、2、4和7天,PG7、PG14、PG21、PG28表示停止移植后的第7、14、21和28天。下同。G1, G2, G4, G7 represent the days 1, 2, 4 and 7 over the time of transplantation, PG7, PG14, PG21, PG28 represent the days 7, 14, 21, 28 after the transplantation. The same as below.图1 猪粪便微生物移植小鼠粪便细菌总数变化Fig.1 Changes of total bacteria number in fecal samples of mice with pig fecal microbiota transplantation
2.2 受体小鼠粪便菌群结构变化
对受体小鼠粪便样品进行高通量测序分析,从16个受体小鼠的粪便样品中共产生1 018 351条有效序列,平均为63 647条(37 063~77 619条)。有效序列根据97%相似性水平上进一步分为2 945个OTUs,每个样品的平均OTUs数量为184个(95~236个)。样品的覆盖度指数均在0.999~1.000,说明测序结果能反映受体小鼠粪便菌群多样性组成。对测序结果进行α多样性分析(表1),从猪到小鼠的粪便移植过程中,受体小鼠粪便样品的Shannon指数随移植时间变化逐渐升高,表明随着移植时间的增加,小鼠粪便菌群的相对丰度和多样性逐渐增加。
FMT不仅增加了受体小鼠肠道微生物的相对丰度和多样性,且移植过程中小鼠肠道菌群结构也发生动态演替变化。在猪到小鼠的粪便移植过程中,在门水平上,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)的相对丰度随着粪便移植时间的增加而逐渐降低,拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)的相对丰度逐渐增加。此外,与金华猪粪便微生物移植小鼠相比,在停止粪便移植后长白猪粪便微生物移植小鼠粪便中拟杆菌门相对丰度较高,而金华猪粪便微生物移植小鼠则厚壁菌门相对丰度较高(图2-A和图2-B)。可见,受体小鼠肠道微生物相对丰度在一定程度上受供体猪的影响。在属水平上,大多数样品中乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、副拟杆菌属(Parabacteroides)、葡萄球菌属(Staphylocaccus)和阿克曼氏菌属(Akkermansia)的相对丰度占比较大,占全部序列的1/2以上(图2-C和图2-D)。
选取受体小鼠粪便中相对丰度最高的35个属进行热点图(图3)分析发现,受体小鼠粪便中拟杆菌属、阿克曼氏菌属和副拟杆菌属的相对丰度随着粪便移植时间的增加逐渐升高,而乳酸杆菌属、肠球菌属(Enterococcus)、大肠杆菌属(Escherichia)相对丰度逐渐降低,直至停止移植后保持稳定。

表1 猪粪便微生物移植小鼠粪便样品的α多样性Table 1 Alpha diversity of fecal samples of mice with pig fecal microbiota transplantation
为了进一步分析受体小鼠肠道菌群的动态演替规律,进行PCoA发现(图4),小鼠灌胃阶段与停止灌胃后的阶段出现分离,表明2个阶段小鼠菌群结构存在差异;且不同品种猪粪便微生物移植小鼠的肠道微生物演替趋势相同。
2.3 受体小鼠粪便SCFAs含量变化
对受体小鼠粪便样本的短链脂肪酸SCFAs含量进行测定,分析结果发现,乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸含量均随移植时间的增加逐渐升高。在停止移植后,受体小鼠粪便样品中的SCFAs含量变化较小(图5)。
3 讨 论
肠道微生物对人和动物营养物质消化吸收、生长代谢、免疫应答均具有重要调控作用[21]。FMT指将生理状态良好的人或动物粪便中功能性菌群移植到受体肠道内,调控胃肠道菌群平衡以提高免疫功能、维持机体健康水平、提高动物生产性能[22]。Geng等[23]将金华猪的粪便微生物移植于“杜×长×大”杂交新生仔猪14 d后,发现受体仔猪结肠拟杆菌门相对丰度降低,而厚壁菌门相对丰度增加,降低脂多糖诱导的上皮细胞损伤和炎症反应。Yan等[14]将约克夏猪和荣昌猪粪菌移植至小鼠体内5周后分析发现,受体小鼠在菌群和脂肪生成特征上与各自供体猪相似,结果显示肠道微生物群在改变宿主的代谢和脂肪形成中起着重要作用。然而这些研究主要是聚焦于菌群移植后某一时间点菌群结构的变化,以及通过受体小鼠表型来探究肠道微生物与宿主代谢和表型的关联,从不同时间点分析FMT过程菌群结构动态演替变化研究甚少。陈雪等[24]给杜长大新生仔猪连续5 d口服母源粪菌液,收集仔猪1、3、5、7、10、14、18和22日龄粪便,结果发现FMT在一定程度上增加了仔猪肠道微生物的多样性,但口服粪菌液并不能持久影响仔猪肠道微生物定植,在仔猪22日龄左右,肠道菌群会逐渐和母猪肠道菌群趋于一致。也有研究结果表明,将人微生物移植到无菌小鼠肠道后菌群结构会发生剧烈变化,之后逐渐达到稳定,稳定后小鼠肠道中的微生物群落中只有部分细菌的结构特征与人类供体相似[25]。Li等[26]通过FMT将人类粪便样本移植到无菌小鼠体内,使用小鼠模型来复制人类肠道微生物相关表型,研究发现FMT后大于1/3的人肠道微生物在种和属水平上都产生了明显持久的改变,说明肠道栖息地塑造了菌群结构变化[23]。多个时间点观察FMT受体菌群结构变化对解决FMT是否能成功、菌群植入持久性等基本问题十分重要。

A:金华猪粪便微生物移植小鼠粪便中相对丰度最高的6个门 top 6 phyla in the fecal samples of mice with Jinhua pig fecal microbiota transplantation;B:长白猪粪便微生物移植小鼠粪便中相对丰度最高的6个门 top 6 phyla in the fecal samples of mice with Landrace pig fecal microbiota transplantation;C:金华猪粪便微生物移植小鼠粪便中相对丰度最高的15个属 top 15 genera in the fecal samples of mice with Jinhua pig fecal microbiota transplantation;D:长白猪粪便微生物移植小鼠粪便中相对丰度最高的15个属 top 15 genera in the fecal samples of mice with Landrace pig fecal microbiota transplantation。Cyanobacteria:蓝细菌门;Actinobacteria:放线菌门;Fusobacteria:梭杆菌门;Verrucomicrobia:疣微菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Firmicutes:厚壁菌门;Coprococcus:粪球菌属;[Eubacterium]:优杆菌属;Ruminococcus:瘤胃球菌属;Coprococcus:粪球菌属;Acinetobacter:不动细菌属;Clostridium:梭菌属;Blautia:布劳特氏菌属;Staphylococcus:葡萄球菌属;Akkermansia:阿克曼氏菌属;Bacteroides:拟杆菌属;Parabacteroides:副拟杆菌属;Enterococcus:肠球菌属;Escherichia:大肠杆菌属;Lactobacillus:乳酸杆菌属;Turicibacter:苏黎世杆菌属;Sutterella:萨特氏菌属;Stenotrophomonas:寡养单胞菌属;Robinsoniella:嗜硒微生物;Others:其他。图2 猪粪便微生物移植小鼠粪便菌群结构变化Fig.2 Changes of microbial community structure in fecal samples of mice with pig fecal microbiota transplantation
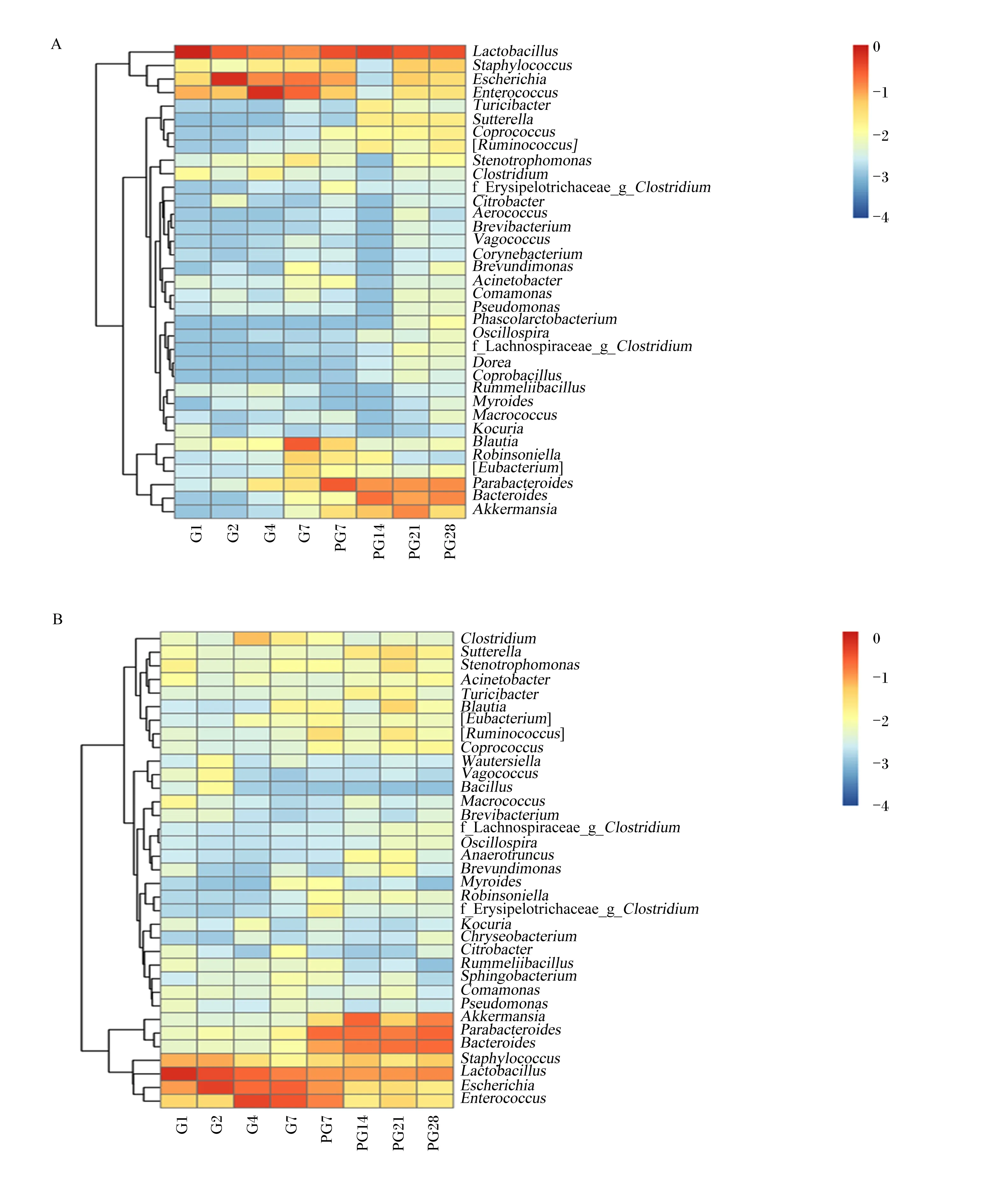
A:金华猪粪便微生物移植小鼠 mice with Jinhua pig fecal microbiota transplantation;B:长白猪粪便微生物移植小鼠 mice with Landrace pig fecal microbiota transplantation。Lactobacillus:乳酸杆菌属;Escherichia:大肠杆菌属;Enterococcus:肠球菌属;Parabacteroides:副拟杆菌属;Bacteroides:拟杆菌属;Blautia:布劳特氏菌;Akkermansia:阿克曼氏菌属;Staphylococcus:葡萄球菌属;[Eubacterium]:优杆菌属;Sutterella:萨特氏菌属;Stenotrophomonas:寡养单胞菌属;Coprococcus:粪球菌属;[Ruminococcus]:瘤胃球菌属;Clostridium:梭菌属;Turicibacter:苏黎世杆菌属;Acinetobacter:不动细菌属;Brevundimonas:短波单胞菌;Comamonas:丛毛单胞菌属;Pseudomonas:假单胞菌属;f_Erysipelotrichaceae_g_Clostridium:韦荣球菌科-梭状芽孢杆菌属;Oscillospira:颤螺菌属;f_Lachnospiraceae_g_Clostridium:毛螺菌科-梭状芽孢杆菌属;Rummeliibacillus:鲁梅利杆菌属;Citrobacter:柠檬酸菌属;Phascolarctobacterium:法氏杆菌属;Macrococcus:巨型球菌属;Vagococcus:漫游球菌属;Coprobacillus:粪芽孢菌属;Myroides:类香菌属;Kocuria:考克氏菌属;Aerococcus:气球菌属;Corynebacterium:棒状杆菌属;Brevibacterium:短杆菌属;Sphingobacterium:鞘氨醇杆菌属;Bacillus:杆菌属;Chryseobacterium:金黄杆菌属;Anaerotruncus:厌氧棍状菌属;Dorea:多尔氏菌属;Wautersiella:嗜硒微生物;Robinsoniella:罗宾逊贝属。图3 猪粪便移植微生物小鼠粪便中相对丰度最高的35个属Fig.3 Top 35 genera in fecal samples of mice with pig fecal microbiota transplantation
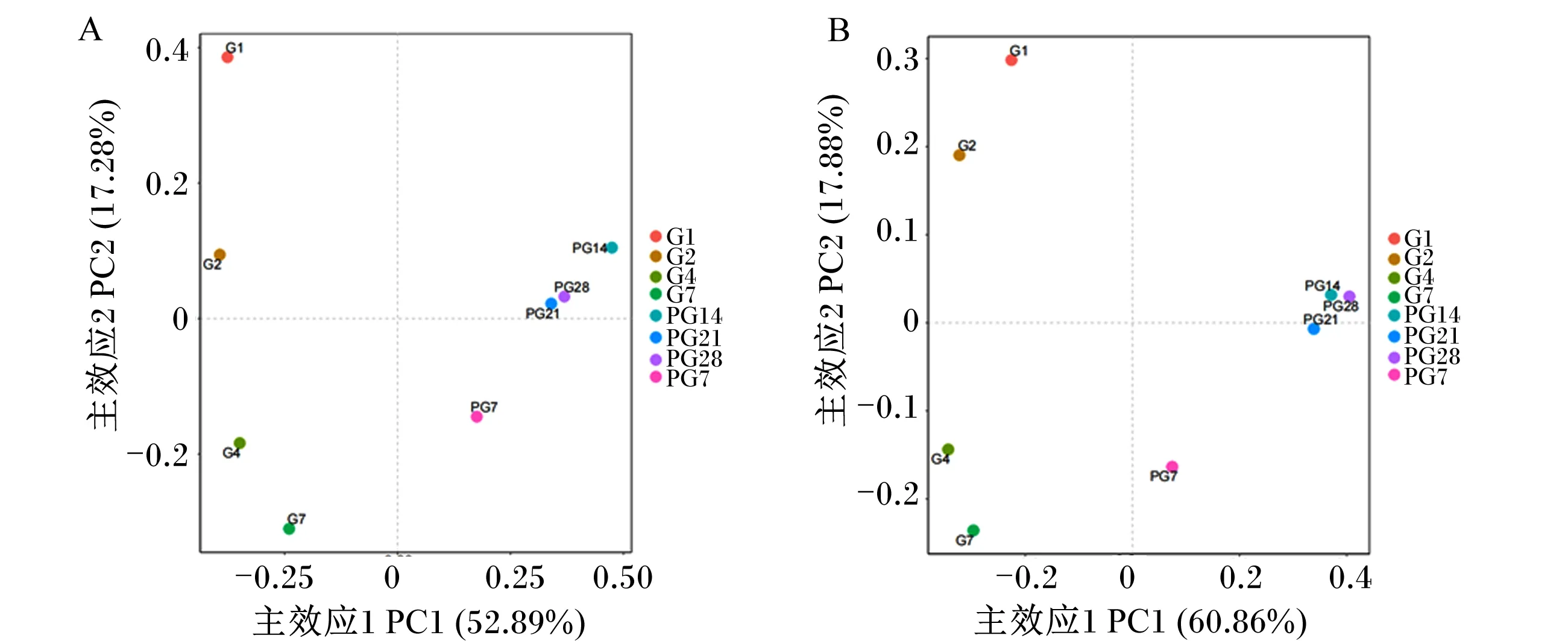
A:金华猪粪便微生物移植小鼠 mice with Jinhua pig fecal microbiota transplantation;B:长白猪粪便微生物移植小鼠 mice with Landrace pig fecal microbiota transplantation。图4 微生物群落组成主坐标分析Fig.4 PCoA of microbial community composition
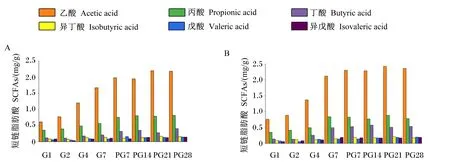
A:金华猪粪便微生物移植小鼠 mice with Jinhua pig fecal microbiota transplantation;B:长白猪粪便微生物移植小鼠 mice with Landrace pig fecal microbiota transplantation。图5 粪便移植微生物小鼠粪便中SCFAs含量变化Fig.5 Changes of SCFAs content in fecal samples of mice with pig fecal microbiota transplantation
本研究中选取金华猪和长白猪2个不同代表性猪品种的粪便微生物移植到经广谱抗生素处理过的小鼠体内,金华猪和长白猪粪便供体的优势菌门均是厚壁菌门、拟杆菌门、变形菌门和螺旋菌门;在属水平上,金华猪粪便中相对丰度最高的前5个属分别为梭菌属、密螺旋体属(Treponema)、苏黎世杆菌属(Turicibacter)、乳酸杆菌属和CF231,长白猪粪便中相对丰度最高的前5个属分别为乳酸杆菌属、大肠杆菌属、梭菌属、苏黎世杆菌属和希瓦氏菌属(Shewanella)[18]。经过广谱抗生素处理过的小鼠肠道中微生物的丰富度和多样性明显减少,且FMT前受体小鼠之间的粪便微生物群结构无明显差异[27]。FMT过程中小鼠肠道中厚壁菌门和变形菌门的相对丰度随着移植时间的增加而逐渐降低,拟杆菌门和疣微菌门的相对丰度逐渐增加。在属水平上,受体小鼠肠道中拟杆菌属、阿克曼氏菌属和副拟杆菌属的相对丰度随着移植时间的增加逐渐升高,而乳酸杆菌属、肠球菌属和大肠杆菌属相对丰度逐渐降低。值得注意的是,不同品种猪FMT小鼠菌群有差异,与金华猪受体小鼠相比,在停止FMT后长白猪受体小鼠粪便中拟杆菌门相对丰度较高,而金华猪受体小鼠则厚壁菌门相对丰度较高,在属水平上,金华猪受体小鼠粪便中乳酸杆菌属相对丰度较高,长白猪受体小鼠拟杆菌属、副拟杆菌属和阿克曼氏菌属相对丰度较高。受体小鼠粪便样品的Shannon指数随移植时间变化逐渐升高,表明随着移植时间的增加,小鼠粪便菌群的相对丰度和多样性逐渐增加。受体小鼠粪便细菌总数也随着移植时间的增加而逐渐增加,停止移植后变化较小。这与前人多个时间点观察菌群变化规律一致,给杜长大新生仔猪口服灌喂母源粪菌液3 mL,持续5 d,并在多个时间点采集仔猪粪样,结果表明FMT能在一定程度上增加仔猪肠道微生物的多样性[24]。
本试验中,受体小鼠粪便中6种SCFAs的含量随移植时间的增加逐渐升高,停止移植后SCFAs含量变化较小,与细菌总数的变化规律相一致,说明菌群代谢产生SCFAs与菌群数量和结构密切相关。张卓[22]试验选取新生“长×荣”二杂仔猪口服灌喂1 mL健康成年“杜×长×大”杂交猪的粪便菌悬液,连续灌喂5 d,结果显示仔猪结肠中SCFAs的含量均有上升趋势,其中丙酸、异丁酸、异戊酸的含量显著增加。本研究报道了猪FMT小鼠过程中菌群及其代谢的动态变化,在FMT结束的第28天,受体小鼠粪便中菌群结构从门到属的水平上已发生了显著的改变,多个时间点观察FMT小鼠肠道菌群变化,为探究FMT受体肠道微生物结构的演替规律提供基础数据,也为外源微生物定植小鼠肠道的研究提供了补充资源。
4 结 论
① 在猪FMT小鼠过程中,随着移植时间的增加,受体小鼠粪便中细菌总数、菌群的相对丰度和多样性逐渐增多,在门水平上,厚壁菌门和变形菌门的相对丰度逐渐降低,拟杆菌门和疣微菌门相对丰度逐渐增加;在属水平上,拟杆菌属、阿克曼氏菌属和副拟杆菌属的相对丰度逐渐变大,而乳酸杆菌属、肠球菌属和大肠杆菌属相对丰度逐渐降低,在停止移植后基本保持稳定。
② 停止FMT后,长白猪粪便微生物移植小鼠粪便中拟杆菌门相对丰度较高,而金华猪粪便微生物移植小鼠厚壁菌门高,在属水平上,金华猪粪便微生物移植小鼠乳酸杆菌属相对丰度较高,长白猪粪便微生物移植小鼠拟杆菌属、副拟杆菌属和阿克曼氏菌属相对丰度较高。
③ FMT期间受体小鼠粪便中SCFAs的含量随移植时间增加逐渐升高,在停止移植后SCFAs含量变化较小。

