阿魏酸酯酶促进粗纤维降解的作用机制及其在饲料工业中的应用
成艳芬 马 菁 朱伟云
(南京农业大学动物科技学院,动物消化道营养国际联合研究中心,南京 210095)
作为世界十大产粮国之一,乌克兰有着“欧洲粮仓”的美誉,2021年粮食总产量约为8 600万t,粮食出口约5 000万t,是世界第四大粮食出口国,在国际粮食供给与粮食价格稳定方面具有举足轻重的作用。今年,俄乌冲突令世界粮食安全受到挑战,国际粮食价格飞涨。对我国来说,乌克兰是我国重要的玉米、小麦进口来源国,每年对我国出口玉米、小麦等谷物以数十万吨计[1],俄乌冲突凸显了我国饲料粮短缺和“人畜争粮”这个迫切需要解决的粮食安全问题[2]。
近年来,我国相继发布《关于促进畜牧业高质量发展的意见》《关于推进玉米豆粕减量替代工作的通知》等文件,旨在通过加强饲料加工、促进秸秆等非粮饲料资源的高效利用等,调整优化我国饲料配方结构,从粮食安全高度解决“人畜争粮”的问题。秸秆等非粮饲料资源的高效利用中普遍存在的问题是其粗纤维含量高而降解效率低下,其中半纤维素、纤维素、木质素等多糖交错复杂,导致这些饲料难以被降解。此外,大量酚酸类物质的附着提高了多糖的分支程度以及多糖之间的交联程度,进一步降低了其酶解特性,增加了其酶解难度。阿魏酸(ferulic acid,FA)是秸秆等非粮饲料中常见的酚酸类物质,在禾本科秸秆中的含量相当高[3],通常与含L-阿拉伯呋喃糖的多糖(如L-阿拉伯糖基-D-木糖、L-阿拉伯聚糖)的分支或侧链通过酯键连接,也可以附着在木质素和蛋白质上[4-5],降低其消化率。阿魏酸酯酶(feruloyl esterase,FAE)是水解阿魏酸和半纤维素以及木质素之间酯键的酶,可以释放阿魏酸及其二聚体,同时也使这些多糖的酶解位点暴露出来,促进其降解[6]。由此可见,FAE不仅具有降解支链释放游离阿魏酸的作用,还具有协同其他粗纤维降解酶(如木聚糖酶、纤维素酶)促进其粗纤维降解能力的作用。目前,关于FAE的研究报道较少,其产业应用也处于起步阶段,其中的瓶颈在于高效FAE基因资源的挖掘和开发。本文综述了FAE的分类和来源、作用机理及其与其他粗纤维降解酶之间的协同作用,并对其在饲料工业中的应用进行了分析与思考,旨在促进FAE在饲料工业中的应用,提高秸秆等非粮饲料在畜禽养殖中的消化利用率。
1 FAE的分类和来源
1.1 FAE的定义
FAE(EC 3.1.1.73)是羧酸酯酶的一个子类,属于碳水化合物酯酶(carbohydrate esterase,CE)亚家族,通过水解粗纤维内阿魏酸和多糖之间的酯键释放阿魏酸[7-8],也可以从粗纤维中释放其他羟基肉桂酸[6],如咖啡酸、对香豆酸、芥子酸等[9]。
1.2 FAE的来源
自然界中FAE的来源大致可分为微生物源和植物源。微生物源FAE主要包含细菌源和真菌源。细菌源FAE多来自于梭菌(Clostridium)、链霉菌(Streptomyces)、假单胞菌(Pseudomonas)、乳酸杆菌(Lactobacillus)等,而真菌源FAE多来自于曲霉(Aspergillus)、青霉(Penicillium)、脉孢菌(Neurospora)、裸节菌(Talaromyces)等丝状真菌[4,10]。本团队对细菌源和真菌源FAE功能域(FAE domain)序列研究分析发现,2种微生物源FAE的氨基酸序列相似度较低,不同微生物源FAE的氨基酸序列在发育树中明显被聚类到不同的簇(图1),这表明真菌源和细菌源FAE的不同的进化过程。目前,被表征的FAE多来源于真菌[4],这可能是由于真菌在粗纤维降解过程中发挥了十分重要的作用。分泌FAE的有益微生物可以直接添加,促进青贮或生物发酵中粗纤维的降解[11-12]。不能直接添加微生物的FAE,可以进行重组与异源表达后再利用。例如,Abokitse等[13]利用大肠杆菌异源表达了来自热厌氧杆菌属(Thermoanaerobacter)的FAE,该酶表现出高度的热稳定性。Moukouli等[14]在毕赤酵母中表达出了来自镰刀菌属(Fusarium)的FAE,该酶显示出广泛的pH稳定性。为了促进FAE的利用,Oliveira等[15]系统整理了近年来被表征的微生物源FAE及其特性。
目前,关于植物中FAE的报道较少。1999年,Sancho等[16]从大麦中检测到了FAE活性,且提取到的FAE对4种典型的甲酯底物和阿魏酰化寡糖均表现出明显的降解活性,随后,大麦芽[17]、龙爪稷[18]、水稻细胞[19]和玉米[20]中FAE的酶学性质被报道。植物源FAE的鉴定、提取和浓缩过程比较耗时,且过程中蛋白质损失较大[20],限制了它们的挖掘和利用,但这些FAE对植物体的生长和发育发挥了重要作用。Buanafina等[21]研究显示,玉米花粉中FAE的分泌可能通过对柱头细胞壁去阿魏酰化而协助其他内源酶对其进行降解,从而为花粉管穿透创造一个开口,促进花粉受精。

图1 真菌源和细菌源FAE进化树Fig.1 Evolutionary tree of fungal and bacterial origin FAE
1.3 FAE的分类
Crepin等[9]基于FAE对4种芳香基底物——阿魏酸甲酯(methyl ferulate,MFA)、咖啡酸甲酯(methyl caffeate,MCA)、芥子酸甲酯(methyl sinapate,MSA)和对香豆酸甲酯(methylp-coumarate,MpCA)的水解特异性以及从底物中释放阿魏酸脱氢二聚体的能力,将FAE分为A、B、C、D 4类(表1)。该分类系统是目前应用最广泛的系统,但随着被挖掘的FAE数量不断增多,大量FAE无法依据该分类系统进行具体分类[22-23]。近年来,基于计算分析和机器学习将365个细菌、真菌和植物来源的FAE分为了12个家族,但这些家族的底物特异性研究还是依赖于A~D型分类[23]。
随着真菌源FAE研究的大量积累,近年来研究者们也尝试对真菌源FAE进行系统的分类。Benoit等[24]从系统发育的角度将真菌源FAE分成了7个亚类(SF1~7),这种分类方法将不同功能的真菌源FAE做了进一步细分,但没有区分出D型FAE。Dilokpimol等[22]通过引入一些已经表征的乙酰木聚糖酯酶、脂肪酶和单宁酸酶对真菌源FAE进行系统发育分析,将其分为了13个亚类(SF1~13),并揭示了FAE与这些酶的关系。其中,属于SF1~4和SF9~11的酶与单宁酶有关,说明大多数FAE是从单宁酶进化而来的。虽然该分类方式依然无法包含所有FAE,但这种从系统发育和功能上对FAEs分类的方式为后续新FAE的分类提供了参考。

表1 A~D型FAE分类Table 1 Classification of A to D types of FAE
2 FAE的理化性质和作用机制
2.1 FAE的理化性质
目前,研究人员已经表征出了许多FAE,不同微生物来源的FAE表现出不同的理化性质,例如最适温度、最适pH以及酶活稳定性等。这些FAE的最适温度和最适pH的差异较大,分别为30~65 ℃和pH 4.0~9.0,而大多数FAE在40~55 ℃和pH 6.5~7.5下表现出较好的催化活性[15]。此外,酶的稳定性也是酶的利用价值的重要方面。酶的稳定性除了和酶本身的氨基酸组成有关外,还与表达载体对酶的修饰有关,例如,毕赤酵母等真核表达系统对酶的糖基化位点的修饰会改变肽链骨架的柔韧性以及酶分子的聚合状态,因此可能会对酶的活性以及稳定性产生积极影响[25-27],从而提高酶的工业利用价值。这种修饰对真核来源的FAE的异源表达尤为重要,能够使这些FAE更有效地发挥作用。
2.2 FAE的结构
晶体结构解析对理解酶功能相关的特定结构或者氨基酸残基十分重要,当前已知的FAE晶体结构较少。以丁酸弧菌来源的FAE蛋白(PDB_ID:2WTM)(https://www.rcsb.org/structure/2WTM)为例,Goldstone等[28]利用X射线技术研究发现,该FAE的活性形式为二聚体,其单体分子具有典型的α/β水解酶折叠,即β-折叠和α-螺旋由环交替连接在一起,其中近乎平行或反平行排列的β-折叠位于被α-螺旋包围的核心区域(图2)。FAE的活性位点位于这些α-螺旋和β-折叠的柔性转角形成的狭长空腔中,空腔内还包含有一些稳定底物芳香部分的疏水残基。除了α/β水解酶折叠,该FAE在其活性位点附近还有一个盖域结构,这个盖域结构在很多FAE中都存在[26,28-30],与脂肪酶的盖域结构相似,可能与酯酶的活性状态有关。盖域结构的覆盖限制了活性位点的作用,盖域结构移动后会引起疏水残基的暴露和活性位点腔的活化[29-30]。盖域结构的移动与其两侧2个铰链区域二面角的转动有关,这提示,对两侧铰链区内氨基酸进行优化来增加其刚性或许可以设计具有永久打开盖域结构的FAE[30]。另外,根据酶的结构特点,也可以通过加强这些酶蛋白质内的相互作用来提高它们的稳定性[31]或者改变底物结合口袋的性质或形状[7,32]来提高它们的活性,从而为获得具有更高利用价值的FAE提供有力指导。
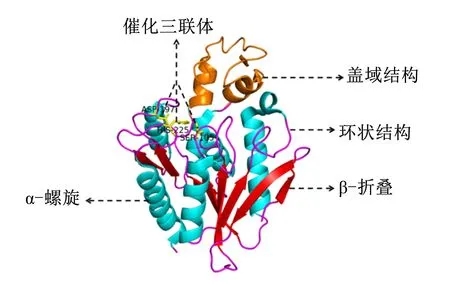
图2 FAE(PDB_ID:2WTM)单体的三维结构Fig.2 Three-dimensional structure of FAE (PDB_ID:2WTM) monomer[23]
2.3 FAE的催化机制
FAE活性状态以单体或多聚体的形式存在,其活性位点是包含天冬氨酸(Asp)、组氨酸(His)以及亲核的丝氨酸(Ser)形成的催化三联体(图2)。Ser残基位于一个保守的具有亲核性的五肽中心,即G-X-S-X-G(X=任何氨基酸)[23]。在催化过程中,His首先从Ser的羟基中去除1个质子,由此被极化的Ser对底物羰基碳进行亲核攻击,形成一个不稳定的四面体中间体。中间体中带负电荷的氧原子被氢键稳定,形成氧阴离子孔,可以稳定过渡态和四面体中间体中正在形成的负电荷。之后,四面体中间体解离,水分子进入反应体系,其氧原子攻击羰基碳,从而又形成了一个由水分子参与的四面体中间物。最终,酰基和酶由水解作用解离,形成的阿魏酸从复合物中被释放出来。这种脱酯机制与Ser型脂肪酶和蛋白酶的作用机制相同[33-35]。
3 FAE在饲料工业中的应用
3.1 与其他纤维降解酶协同作用,促进粗饲料降解
粗饲料的细胞壁结构复杂,除了多糖的错综复杂,其中酚酸类物质与多糖之间的共价交联进一步增加了细胞壁的刚性和机械性能[36],这使得单一的糖苷水解酶(glycoside hydrolase,GH)对粗饲料的降解能力十分有限。FAE作为一类重要的辅助酶,不仅能够从粗饲料底物中高效释放阿魏酸[7,37],还能通过降解支链提高其他纤维素酶或半纤维素酶降解主链多糖的效率[38](表2)。在半纤维素酶(主要是木聚糖酶)与FAE的协同作用中,木聚糖酶裂解木聚糖的主链,得到短阿魏酰基低聚糖,这使得这些低聚糖更容易被FAE水解,同时,阿魏酸残基的释放使木聚糖链更容易被木聚糖酶水解[8]。大量研究表明,在降解复杂底物时,FAE与半纤维素酶之间有显著的协同作用,能释放更多的阿魏酸和还原性单糖[39-41](图3)。FAE和酶互作的酶解位点不同,其降解效率也不同。例如,当在甜菜果胶的降解系统中加入FAE、α-L-阿拉伯呋喃糖苷酶和α-1,5-阿拉伯聚糖内切酶后,FAE从底物中释放的阿魏酸明显增多,这是由于后2种酶对底物中阿拉伯聚糖的酶切作用首先产生了阿魏酰基α-L-阿拉伯呋喃糖,该产物能更好地被FAE降解[39]。此外,GH10和GH11家族的木聚糖酶与FAE协作产生阿魏酸和还原糖的效率也有所差异[41-42],可能是由于GH10更容易在木聚糖链上靠近取代基的位点切割糖苷键,而GH11对未被取代的区域表现出更高的特异性,所以,尽管2个家族的木聚糖酶都对阿拉伯木聚糖产生相当的降解能力,但GH10产生的在非还原端连接有阿拉伯阿魏酸基团的低聚木糖相比于GH11产生的在内部位置有这些取代基的低聚木糖,更有利于FAE发挥作用[41]。所以,根据复杂底物的组成和结构特点,选择合适的酶组合对高效去除支链的阿魏酸以打开植物细胞壁的微观结构十分重要。除了半纤维素酶,FAE也能够与纤维素酶协同作用,通过改善粗饲料的降解效率和糖化程度来改善青贮饲料的质量[11-12,43],这可能是由于阿魏酸的水解移走了部分半纤维素或木质素,从而提高纤维素酶对纤维素的结合能力。此外,添加FAE促进了纤维素酶和半纤维素酶对复杂底物的降解[38,44],同样也是由于该酶裂解了木质纤维素中的半纤维素后,其表面积和孔隙率增加,使纤维素酶更容易结合纤维素的作用。

图3 阿魏酸酯酶协同其他半纤维素酶降解半纤维素示意图Fig.3 Schematic diagram of hemicellulose degraded by hemicellulases with FAE

表2 FAE与其他纤维降解酶在粗饲料降解中的协同作用Table 2 Synergistic effects of FAE and other fiber-degrading enzymes in roughage degradation
3.2 预处理粗纤维含量高的粗饲料,提高其利用价值
酶处理是提高粗饲料降解率常见的生物预处理方法。不论是从粗饲料中回收高价值的阿魏酸产品,还是生产高消化降解率的高品质饲料,使用FAE进行预处理都是一条可行的途径。相比于传统的物理和化学预处理,酶处理高效、节能、环境友好的优点突出。FAE预处理途径包括高效分泌FAE菌株的直接使用和FAE工程菌株的利用。高效分泌FAE菌株的直接使用是指将自然界中筛选出来的能够高效分泌FAE的微生物经扩大培养后直接接种到粗饲料底物上,其FAE伴随菌株生长分泌到周围环境中,促进纤维降解。产FAE的乳杆菌经常被用于青贮饲料的接种剂,以提高青贮饲料的纤维降解率[49-50]。例如,一株筛选自青藏高原青贮饲料的产FAE的植物乳杆菌(Lactobacillusplantarum)A1能够协同纤维素酶促进青贮饲料的糖化效率和可降解性,从而显著改善青贮饲料质量[11,43]。此外,一些高效生产FAE的真菌,例如泡盛曲霉(Aspergillusawamori)[51]、草酸青霉(Penicilliumoxalicum)M1816[52]也被用于农业副产品的固体发酵,以促进这些副产品的生物转化。尽管这些菌株的利用潜力已经被评估,但是它们的工业利用仍需要菌株工程的协助,即对其基因进行定向改造或者对其培养条件进行优化来提高其胞外蛋白产量,达到更好的酶解性能。
FAE工程菌株的利用指将高效的FAE基因在某些特定的表达菌株中异源表达,收集其上清液(粗酶液)或者将粗酶液进行纯化、浓缩后混合其他酶制剂一起混入粗饲料底物中,协同降解粗纤维。经这种酶制剂预处理后的粗饲料,由于其细胞壁结构被破坏,可以被反刍动物瘤胃微生物高效降解利用,从而提高其饲料效率。此外,处理后的产品由于阿魏酸含量增加以及糖化程度提高,也可以显著提高动物健康与机体免疫力[53]。研究表明,适度的物理或化学处理可以提高FAE对粗纤维的酶解效果,如汽爆的高温、高压蒸汽作用能够溶解半纤维素,增加底物空间,扩大木质纤维素与酶的接触面积,从而提高FAE的酶解作用。曾薇等[48]将FAE和纤维素酶同时添加到汽爆后的稻草中得到了理想的不溶性底物失重率。Wu等[54]发现汽爆能够从木质纤维素底物中释放出可溶的阿魏酰化低聚糖,从而提高其被FAE降解的效率,快速释放大量酚酸。
3.3 畜禽饲粮中的有益添加剂,改善动物健康和生产
秸秆类非粮饲料资源中富含阿魏酸,其中玉米麸皮中阿魏酸含量约为30 g/kg,小麦麸和黑麦麸中阿魏酸含量约为5.3、2.8 g/kg[7,55],这些阿魏酸大多与细胞壁组分结合[52],难以被释放出来。利用高催化效率的FAE可以将阿魏酸从秸秆类非粮饲料资源中释放出来,不仅可以提高秸秆类非粮饲料的利用效率,还能极大地提高饲料中阿魏酸含量。阿魏酸具有抗炎、抗氧化和抗癌的功效,此外,相关研究显示,很多秸秆类非粮饲料中的阿魏酸以二聚体形式存在,如黑麦和小麦麸中都有高含量的8-O-4-阿魏酸二聚体,该二聚体在一定的剂量下表现出比单体更强的抗氧化能力[56-57],因此,FAE的合理利用在这些非粮饲料的生物转化中具有很大的生态和经济效益。目前,FAE及产FAE菌株作为畜禽饲料的有益添加剂的作用已经被广泛评估(表2)。一方面,FAE对饲料的预处理减少了饲料中的阿魏酸酯键,改善了畜禽对纤维组分的降解效果,进而提高了饲料的利用效率;另一方面,释放的阿魏酸不仅能转化成香草酸和香草醛等饲料风味物质,提高饲料适口性,且会导致畜禽血清中超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化氢酶等活性的上升以及肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)等一些促炎因子浓度的下降,从而对畜禽的抗氧化能力和免疫功能产生积极的影响。

表3 FAE及产FAE菌株作为畜禽饲料的有益添加剂的应用Table 3 Application of FAE and FAE producing strains as beneficial additives for livestock and poultry feed
4 小结与展望
在木质纤维素降解过程中,FAE作为一类高效的辅助酶,与其他木质纤维素酶具有良好的协同作用,因此,研究FAE的结构、作用机理及与其他酶的相互作用,在秸秆等非粮饲料的高效利用中显得至关重要且前景广阔。目前,如何获得高活性、高稳定性的FAE仍是提高其工业利用价值的重要瓶颈。近年来,越来越多的计算机工具如AlphaFold、Autodock、PoPMuSiC等被广泛应用于蛋白质结构预测或蛋白质内、蛋白质与配体间相互作用的模拟,来指导蛋白质的突变或设计理想蛋白质,因此,除不断加强FAE晶体结构及其作用机理研究外,还可联合上述计算机算法来指导优质酶的筛选和突变。此外,进一步深入研究稳定且低成本的酶固定化技术也可以提高FAE产品在多个降解循环中的可利用性。

