不同位置动脉瘤破裂所致迟发性脑缺血的空间分布研究
曾以勒
福建医科大学附属第二医院神经外科,泉州 362000
迟发性脑缺血(delayed cerebral ischemia,DCI)是动脉瘤蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)后的严重并发症之一,是预测急性出血患者发病率和病死率的最重要因素[1]。DCI通常发生在初次出血后4~10 d。临床表现为新出现的神经功能缺损或突发意识障碍,可导致继发性脑梗死和永久性残疾[2-3]。DCI 是包括脑血管痉挛(cerebral vasosption,CVS)在内多种机制的结果,其病理生理机制目前尚不完全清楚。CVS 是一种以动脉血管收缩为特征的脑血管病,CVS 的患者中约30%出现弥漫性皮层去极化、炎症和微血栓形成,是DCI 的重要病因[4-6]。DCI 的治疗包括全身应用尼莫地平和动脉瘤治疗后维持中度高血压[7]。因此早期预测并识别aSAH 后易于出现CVS、DCI的脑区对于早期治疗,取得良好预后具有重要的意义。
目前对DCI 高风险脑区早期监测、预警的认识较为缺乏。由于DCI通常发生在出血事件后前2周,神经影像学筛查和多模态神经监测是早期发现DCI 的有效工具,特别适用于神经状况差、需要长时间插管镇静而不配合完成神经系统检查的患者[8-11]。因此,根据动脉瘤的位置寻找DCI高位脑区更具有实际应用及指导价值。然而,很少有系统的临床研究明确 aSAH 后 DCI 发病高风险区域[12-13]。因此,本研究旨在分析aSAH 后患者DCI相关梗死空间分布,并评估这些患者中破裂动脉瘤的位置和血管区域之间的关系。以期望对aSAH患者高风险脑区完成CVS早期预警、避免进展为DCI,从而改善患者临床预后。
资料与方法
1、一般资料
回顾性分析福建医科大学附属第二医院神经外科2018 年 1 月到 2021 年 12 月治疗的所有 aSAH 患者 150 例。其中女 90 例,男 60 例。患者平均年龄为 55 岁(SD=13.4)。入院时临床状况良好(WFNS I-III)占50%(75/150),较差(WFNS IV-V)占50%(75/150)。半数患者出现Fisher IV 级aSAH[50%(75/150)],Fisher III级30%(45/150),13.7%(21/150)患者 aSAH 表现为 Fisher I 级或 II 级。20%(30/150)患者在出院时获得了良好的结果。共有22.1%(33/150)患者失访,定义为预后不良。中位随访时间为出院后4 个月(Q1=3,Q3=5)。
2、纳入标准与排除标准
(1)纳入标准:根据 Vergouwen 等[14]制定的 DCI 影像学定义:为aSAH 后2~6 周可见的脑缺血灶。患者知情同意的基础上,动脉瘤治疗后24~48 h 至少进行一次颅脑CT(cranial computer tomography,CCT)扫描,以及出血事件后至少14 d 再次扫描发现的DCI。(2)排除标准:动脉瘤治疗后24~48 h 在CT 上出现缺血灶;颅内压升高、手术或血管内治疗并发症所引起的脑缺血;出血事件发生后14 d 内死亡的患者;CT 资料不全的患者,多发动脉瘤患者暂不纳入本次研究。
3、研究方法及观察指标
(1)研究方法:①明确DCI 诊断。在aSAH 发生后2~6 周进行 CCT 扫描,此外,aSAH 后第 5、10、15 天行 CT 血管造影(computed tomographic angiography,CTA)及灌注扫描。②评估CVS。对于可疑CVS 的患者进一步行数字减影血管造影(digital subtraction angiography,DSA),对于狭窄50%的患者,被认为存在严重的CVS,采用间歇性或连续动脉内尼莫地平治疗。对所有患者预防性给予口服或静脉注射尼莫地平治疗。(2)观察指标:①临床基线资料包括年龄、性别、动脉瘤位置、治疗方法、世界神经外科联合会评分(World Federation of Neurosurgery Score,WFNS)、Fisher 评分和扩展格拉斯哥预后评分(Extended Glasgow Outcome Scale,eGOS),由不了解患者检查结果的神经外科医生收集。入院时确定WFNS 评分,分为良好(I~III 级)和差(IV+V 级)。Fisher 评分根据首次 CCT 扫描,分为 3 组(I+II 级,III 级,IV级)。出院及3~12 个月随访完成eGOS 评分,分为预后良好(5~≤8 分)或预后不良(1~<5 分)。失访患者定义为预后不良。②CCT评估是否存在缺血:重点关注动脉瘤治疗后24~48 h在CCT上有无缺血,且缺血不是DCI以外的原因所致的病例,分析DCI 发生的位置。③收集动脉瘤的位置信息:动脉瘤位置定义为大脑前动脉(anterior cerebral artery,ACA,A1,A1/A2 外侧,大脑前动脉 A2 段),前交通动脉(anterior communicating artery,AcomA)、大脑中动脉(middle cerebral artery,MCA)、颈内动脉(internal carotid artery,ICA)或后交通动脉(posterior communicating artery,PcomA)、基底动脉(basilar artery,BA)、大脑后动脉(posterior cerebral artery,PCA)、椎动脉(vertebral artery,VA)、小脑上动脉(superior cerebellar artery,SCA)或小脑下后动脉(posterior inferior cerebellar artery,PICA)。④分析血管供应区域:MCA 和/或 ACA 动脉瘤为 ICA 区域,ACA 或 AcomA 动脉瘤为 ACA 区域,MCA 动脉瘤为 MCA 区域,BA 和 VA/PICA/SCA动脉瘤为PCA 和/或后颅窝(脑干,小脑)区域。⑤评估血管供应区域与DCI 发生区域的相关性:载瘤的ACA、MCA、PCA和后颅窝的血管区域是否发生DCI,并根据动脉瘤的位置将DCI 分为“同侧”或“对侧”。对于中线动脉瘤(AcomA/BA),右半球定义为同侧,左半球定义为对侧。
4、统计学方法
数据的正态性分布以Shapiro-Wilk 检验完成,采用IMB SPSS 22.0 进行数据整理和统计学分析,计量资料采用均数±标准差()表示,采用t检验;多次测量的计量资料采用重复测量方差分析,两两比较采用LSD 法;计数资料采用率(%)进行表示,若理论频数(T)≥5,采用χ2检验;1≤T<5,采用校正χ2检验;若 T<1,采用 Fisher 精确概率法,以P<0.05表示差异有统计学意义。
结 果
1、动脉瘤位置信息分析
破裂动脉瘤最常见的部位是MCA,本组占26.0%(39/150),ACA 次之[22.0%(33/150)],ICA 为21.3%(32/150),AcomA为 20.0%(30/150),BA 为 4.0%(6/150),VA/PICA/SCA 为6.7%(10/150)。关于动脉瘤部位的详细信息见表1。动脉瘤的治疗根据位置不同差异有统计学意义(χ2=20.71,P<0.001)。在所有的动脉瘤中,41.3%(62/150)位于右侧,34.0%(51/150)位于左侧,24.7%(37/150)位于中线(AcomA或BA)。有证据表明52.7%(79/150)的患者有血管痉挛。32.0%(48/150)因严重血管痉挛而给予尼莫地平治疗。

表1 150例动脉瘤患者位置分布信息
2、迟发性脑缺血(delayed cerebral ischemia,DCI)
18.0%(27/150)的患者发生了DCI。女性罹患DCI 的比例略高于男性[21.1%(19/90)比13.3%(8/60)]。年龄与DCI的发生无关(95%CI-3.50~3.79,χ2=0.95,P>0.05)。血管痉挛与DCI 的发生紧密相关(χ2=42.53,P<0.05)。在所有出现DCI的患者中,88.9%(24/27)伴有血管痉挛。DCI与出院时和随访时的不良结局显著相关,出院时预后良好的群体中,仅有11.5%的患者发生了DCI,在随访的数据中,预后的良好的组群中仅3.2%患者发生了DCI。见表2。
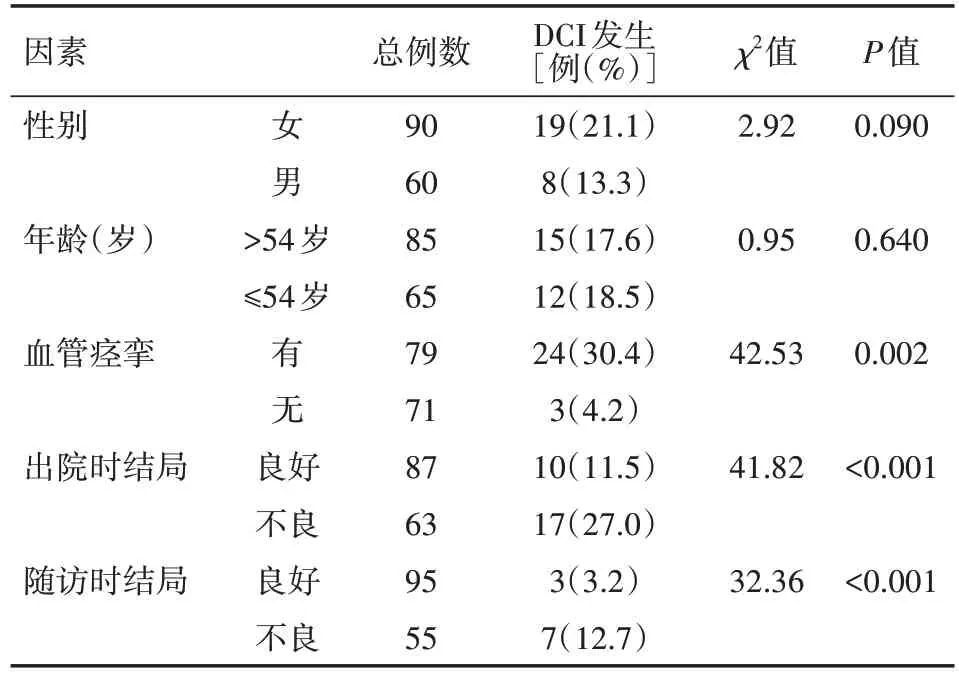
表2 150例动脉瘤患者DCI发生及预后的危险因素分析
3、DCI与颅内破裂动脉瘤位置关系分析
动脉瘤位置对迟发性脑梗死发生率无影响(χ2=2.57,P=0.77)。前循环动脉瘤和后循环动脉瘤发生DCI 的频率差异无统计学意义[18.7%(25/134)比12.5%(2/16),χ2=0.15,P=0.61]。见表3。DCI 的患者中,最常受影响的区域是同侧MCA 区域[32.0%(8/25)],其次是ACA 区域[28.0%(7/25)]。PCA区域受影响较少,为7.4%。

表3 27例动脉瘤患者位置分布的DCI发病率
4、DCI区域与动脉瘤位置的关系分析
我们发现74.1%(20/27)的DCI 位于载瘤动脉的血供区域。AcomA 动脉瘤患者在右侧ACA 区域显示DCI 的占93.8%,其次ICA动脉瘤88.0%(22/25)显示同侧ICA区域的DCI。
讨 论
动脉瘤破裂出血后所伴随DCI,是否与动脉瘤的位置高度相关目前尚不清楚,虽然有医生提出经验性的结论,但缺乏临床数据的支撑。本组数据重点探讨动脉瘤的位置与DCI部位发生的相关性,以及DCI与患者预后的相关性。
载瘤动脉与脑缺血关系的研究关系着患者预后,虽有个别报道但尚未充分明确。一项电极监测载瘤动脉血供区域的研究发现,无论有无CVS 及DCI,均表现出血供区域的异常放电[15]。另一项研究显示,在79.0%的单一梗死病例中,梗死部位与动脉瘤载瘤血管有相关性,但在多发梗死患者中没有发现类似的相关性,多发脑梗死往往发生在责任血管以远的区域[16-18]。我们的研究识别出DCI 风险最高的区域,除了基底动脉动脉瘤,在8 个可能的血管区域中有6 个区域显示DCI 的发生率较为相近,且高于60.0%。尽管在我们的研究中动脉瘤位置与DCI 发生率之间未见明显的统计学相关。但我们的数据仍然显示74.1%DCI 发生在载瘤动脉供血区域,在前循环动脉瘤中DCI 的比例更高达92.6%。这可能与我们纳入了更多的MCA 动脉瘤病例,较少的纳入少见的后循环动脉瘤相关,目前也暂无大宗的临床数据分析动脉瘤位置与DCI 发生的相关性。因此,我们将继续均衡的纳入不同位置的动脉瘤,进一步分析其与DCI 的关系。我们分析且不考虑样本偏倚带来的结论性差异。
本研究从流行病学的角度更具有疾病群体的代表性。研究所呈现的aSAH 患者具有典型的特征。与其他类型的出血性或缺血性中风相比,患者的平均年龄相对较年轻,这也与其他研究具有类似的特点[19-21]。并且本项研究依然以女性患者居多[22]。在以往的研究中,DCI 与年龄之间存在关联,但在我们的研究中并没有发现[23-26]。与之前的研究相吻合的是,我们观察到女性更易于受到DCI 影响,且DCI显示与短期和长期不良预后密切相关[27-30]。
本研究我们分析供血区域与DCI 的关系,发现ICA、MCA 或VA/PICA/SCA 血供区域动脉瘤患者最可能出现DCI,其中超过60.0%的病例发生在同侧MCA 区域,其次是ICA 和 MCA 动脉瘤的 ACA 区域。在 ACA、AcomA、ICA、MCA 和 VA/PICA/SCA 动脉瘤中,同侧 ACA 和同侧 MCA 区域常受动脉瘤的影响常出现DCI。另外,一些数据表明后循环动脉瘤破裂后DCI 发生率较低。这也有可能由我们纳入的后循环动脉瘤病人数量明显低于前循环动脉瘤的患者所致。分析了不同位置动脉瘤的与DCI 发生率的关系,重点发现MCA动脉瘤具有更高的DCI发生率。我们分析这可能是由于MCA动脉瘤本身具有较高的发病率,进而MCA所导致的DCI 的病例相应增加,MCA 相关的DCI 占比增高。另一方面,MCA的解剖位置是动脉瘤破裂后脑室、脑池血凝块出现的最常见位置,MCA供血区域更易于受到累及,更易于出现CVS,也更多的出现DCI。在分析累及中线动脉瘤中,右半球被定义为“同侧”,因为脑实质内探头通常被放置在假定为非优势的右侧,也因此右半球被定义为“同侧”已经作为日常临床常规方法。在ACA 和AcomA 动脉瘤,患者多为双侧DCI,分析其原因可能是该部位的动脉瘤破裂,往往伴随两侧血管受到出血的同等程度上的刺激、侵袭。
总之,我们的研究阐明了动脉瘤的位置信息对破裂出血的动脉瘤伴随的DCI 的空间分布特征,提示我们易于受损脑区的DCI 可能是解释患者不良临床预后的关键因素。因此加强易于受损伤脑区的实时监测可能有利于患者最终预后。

