儿童急性淋巴细胞白血病化疗前后肠道菌群变化特点
陈森敏 刘四喜 陈芬 王春艳 麦惠容 袁秀丽 文飞球
(深圳市儿童医院血液肿瘤科,广东深圳 518038)
人体微生物群落主要分布于黏膜器官,包括肠道、口腔和阴道。肠道菌群在人体许多生理过程中发挥重要作用,包括协助宿主免疫功能的成熟及发育、抵抗病原微生物的过度生长、影响宿主细胞的增殖和新生血管形成等。因此,肠道菌群被认为是早期生命发育和终生健康的关键因素。肠道菌群在多种疾病中可能起推动或阻碍的作用[1]。研究发现,影响免疫细胞的疾病,如急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)、炎症性肠病和幼年特发性关节炎与肠道微生物组成的变化(生态失调)有关[2-4]。但肠道菌群在ALL发病时及化疗前后的变化研究尚不充分,且存在不一致的研究结果[5-7]。因此,本研究采集ALL患儿粪便标本检测肠道菌群的微生物组成,探讨化疗对ALL患儿肠道菌群的影响,以期能在ALL及其化疗相关并发症的诊治中发现新的靶点。
1 资料与方法
1.1 研究对象与分组
前瞻性选取2018 年1~9 月在深圳市儿童医院确诊的ALL 患儿40 例纳入ALL 组;另选取ALL 患儿的健康同胞10 例纳入健康对照组。两组研究对象的体重指数均在正常范围内,年龄1~10 岁,在取样前2个月内均未使用益生菌,且在取样前1个月内均无腹泻。ALL 组患儿纳入标准:初次诊断ALL;入组前未化疗。排除标准:复发的ALL;合并有营养不良或肥胖等其他疾病的患儿。健康对照组儿童均无胃肠道疾病,采集样本前1个月内无抗生素接触史。
收集ALL组患儿化疗前、化疗后2周、化疗后1 个月及化疗后2 个月4 个时间点的粪便;同期采集ALL患儿的健康同胞粪便1次。
本研究已获得深圳市儿童医院伦理委员会的批准,并获得所有参与实验研究的儿童监护人的知情同意。
1.2 ALL的诊断、化疗方案及危险度分级
ALL的诊断基于形态学、免疫学、细胞遗传学及分子生物学标准[8]。根据广东地区ALL-GD-2008方案(以BFM2002为基础)[9]按序化疗。以初诊时年龄、白细胞总数、免疫分型、口服泼尼松第8天外周血幼稚细胞数及治疗第15天、第33天骨髓象作为早期化疗敏感性评估指标,分为标危、中危、高危3组。标危及中危组化疗阶段分为VDLD诱导缓解、CAM 巩固治疗、MTX 巩固治疗、VALD 再诱导缓解及CAM巩固治疗。高危组将MTX巩固治疗换为Block1、Block2及Block3强化治疗。化疗第15 天开始所有患者均予复方磺胺甲噁唑口服预防卡氏肺孢子虫病。各阶段化疗药物及时间见表1。
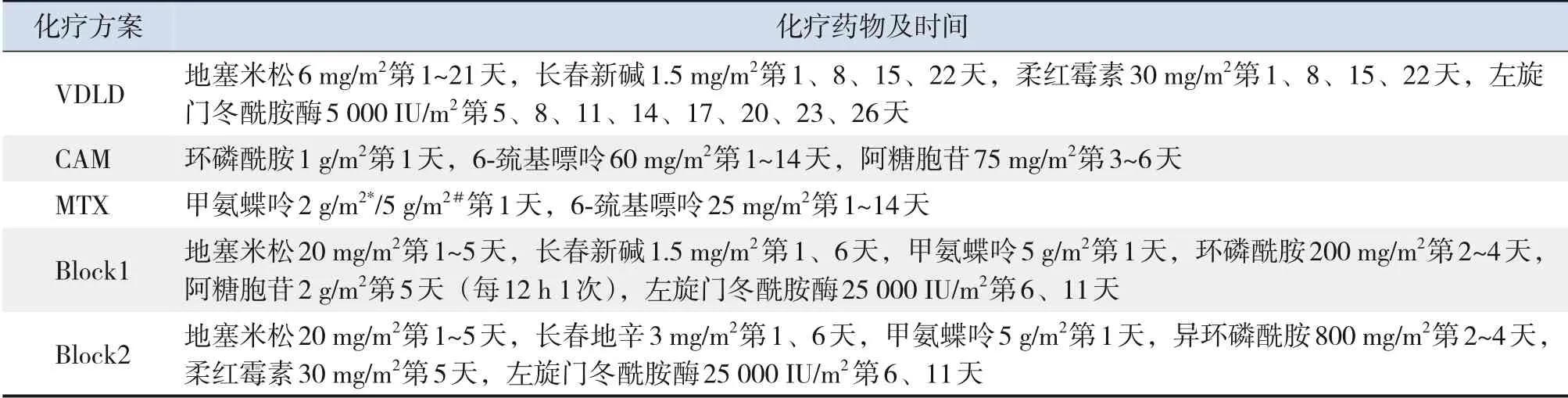
表1 化疗方案、药物及时间

表1 (续)
1.3 粪便DNA提取
采集ALL 患儿及健康对照组儿童的新鲜粪便至少2 g,放入灭菌的一次性大便常规管内,置于冰盒中转运至实验室分装后转移入-80℃冰箱保存。用粪便DNA 提取试剂盒(Omega Bio-Tek,美国)从粪便样本中分离提取DNA。
1.4 16S rDNA基因的扩增及测序
采用荧光定量PCR 扩增16S rDNA 基因的V3~V4 区,选择特异性引物(前端引物为:338F-5'-CTACGGGAGGCAGCAG-3';后端引物为:806R-5'-GACTACHVGGGTWTCTAAT-3')。 反 应 体 系(25 μL): Pusion Hot Start Flex 2×Master Mix(NEB,美国)12.5 μL、Forward Primer(1 μmol/L)2.5 μL、 Reverse Primer (1 μmol/L) 2.5 μL、Template DNA 50 ng,加入ddH2O 至总体积为25 μL。反 应 条 件:98℃30 s;98℃10 s,54℃30 s,72℃45 s,35 个循环;72℃10 min。随后将PCR 扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收后使用AMPure XP beads 回收试剂盒(Beckman,美国)进行纯化。使用MiSeq 测序仪(Illumina,美国) 进行2×300 bp 的双端测序,相应试剂为MiSeq Reagent Kit V3(Illumina,美国),获得各模板DNA 片段的测序序列,即读数。
1.5 生物信息分析
去除原始数据中低质量的Reads,通过97%相似度的标准聚类,得到操作分类单元(operational taxonomic units,OTU)。然后使用Mothur 软件,构建稀释性曲线。分别从每个聚类单元挑选1条代表性序列,以Greengene13.8的数据库为模板注释物种名称组成OTUs。归类后根据每个OTU 中序列的条数计算OTU丰度表,根据该物种丰度表进行α多样性分析、β多样性分析及物种分类与丰度分析。根据分类学组成对样本按照不同的分组条件用LEfSe软件进行线型判别分析,找出有显著性差异的类群。
1.6 统计学分析
采用SPSS 20.0统计软件对数据进行统计学分析。符合正态分布计量资料采用均数±标准差(±s)表示,两组间比较采用两样本t检验;ALL患儿化疗前后比较采用配对样本t检验。不符合正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用两独立样本Wilcoxon秩和检验,ALL患儿化疗前后比较采用Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
40 例ALL 患儿,男25 例,女15 例,男∶女1.7∶1;T系4例(10%),B系36例(90%);标危8 例(20%),中危21 例(52%),高 危11 例(28%);初诊时平均年龄(5.2±2.4)岁。对照组中,男6例,女4例,平均年龄(5.8±2.1)岁。两组之间男女比例及年龄比较差异无统计学意义(P>0.05)。
2.2 粪便样本菌群测序结果分析
本研究总共收集了122个粪便样本,总共获得3907880个读数,平均每个样品为32032个读数,最小值和最大值分别为13531和57106,中位读数为33092。化疗后2 周组30 个样品共1048652 个读数,化疗后1 个月组35 个样品共1046014 个读数,化疗后2 个月组15 个样品共405956 个读数,化疗前组32 个样品共1134937 个读数,健康对照组10个样品中共272321个读数。
2.3 ALL 患儿不同时期肠道菌群的丰度及多样性分析
基于高通量测序数据,对每组样本的菌群丰度和多样性进行进一步检测。其中,丰度由OTU数目和Chao1值体现,多样性由PD值、Shannon指数和Simpson 指数体现,覆盖率指数由Good's coverage值体现。
各样本Good's coverage 值均在0.98 以上,覆盖率较好,测序结果可代表各样本肠道菌群实际组成。与健康对照组相比,ALL 组化疗前肠道菌群OTUs、Chao1及PD值差异无统计学意义(P>0.05),但Shannon 指数及Simpson 指数明显降低(P<0.05);ALL 组化疗后1 个月及2 个月的肠道菌群OTUs、Chao1及PD值显著下降(P<0.05),在化疗后2 周、1 个月、2 个月Shannon 指数及Simpson指数仍明显低于健康对照组(P<0.05)。见表2~5。
表2 化疗前ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)

表2 化疗前ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
组别健康对照组化疗前ALL组t值P值n 1032 OTUs 754±418723±5040.1770.860 Good's coverage 0.986±0.0040.990±0.005-1.9850.054 Chao11183±5671122±7020.2460.806 PD 46±1744±220.1880.852 Shannon 5.0±1.04.0±1.82.2660.032 Simpson 0.90±0.070.75±0.243.1300.003
表3 化疗后2周ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)

表3 化疗后2周ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
组别健康对照组化疗后2周ALL组t值P值n 1030 OTUs 754±418586±3431.2740.210 Good's coverage 0.986±0.0040.991±0.004-3.2960.002 Chao11183±567918±5311.3420.187 PD 46±1737±171.3990.169 Shannon 5.0±1.03.8±1.52.3350.025 Simpson 0.90±0.070.77±0.212.8360.007
表4 化疗后1个月ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
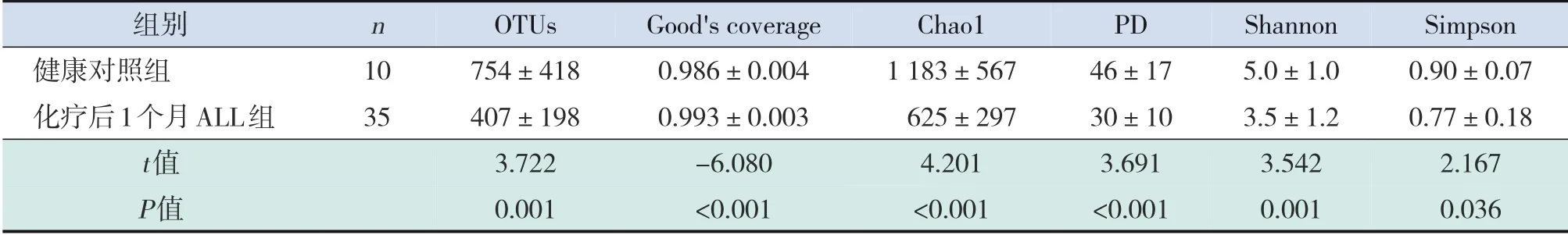
表4 化疗后1个月ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
组别健康对照组化疗后1个月ALL组t值P值n 1035 OTUs 754±418407±1983.7220.001 Good's coverage 0.986±0.0040.993±0.003-6.080<0.001 Chao11183±567625±2974.201<0.001 PD 46±1730±103.691<0.001 Shannon 5.0±1.03.5±1.23.5420.001 Simpson 0.90±0.070.77±0.182.1670.036
表5 化疗后2个月ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
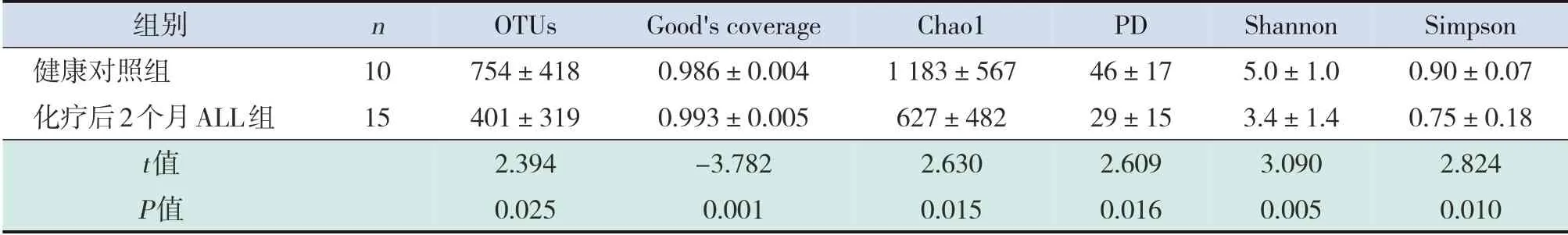
表5 化疗后2个月ALL患儿肠道菌群丰度和多样性与健康对照组比较 (±s)
组别健康对照组化疗后2个月ALL组t值P值n 1015 OTUs 754±418401±3192.3940.025 Good's coverage 0.986±0.0040.993±0.005-3.7820.001 Chao11183±567627±4822.6300.015 PD 46±1729±152.6090.016 Shannon 5.0±1.03.4±1.43.0900.005 Simpson 0.90±0.070.75±0.182.8240.010
和化疗前相比,ALL 组化疗后1 个月及2 个月的肠道菌群Chao1 及PD 值显著下降(P<0.05),尽管化疗后2 个月OTUs 差异无统计学意义(P=0.066),但仍有下降趋势;总体趋势来看,ALL患儿肠道菌群物种丰度在化疗后2个月最低,其次是化疗后1个月和2周。见表6~8。
表6 ALL患儿化疗前与化疗后2周肠道菌群丰度和多样性比较 (±s)
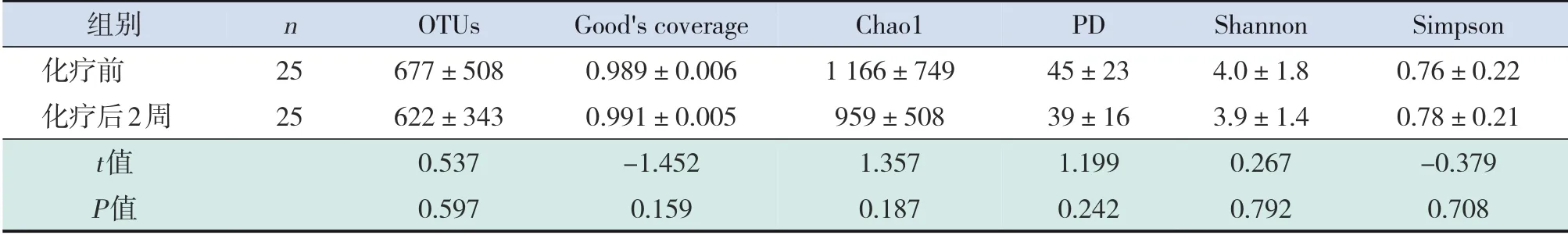
表6 ALL患儿化疗前与化疗后2周肠道菌群丰度和多样性比较 (±s)
组别化疗前化疗后2周t值P值n 2525 OTUs 677±508622±3430.5370.597 Good's coverage 0.989±0.0060.991±0.005-1.4520.159 Chao11166±749959±5081.3570.187 PD 45±2339±161.1990.242 Shannon 4.0±1.83.9±1.40.2670.792 Simpson 0.76±0.220.78±0.21-0.3790.708
表7 ALL患儿化疗前与化疗后1个月肠道菌群丰度和多样性比较 (±s)

表7 ALL患儿化疗前与化疗后1个月肠道菌群丰度和多样性比较 (±s)
组别化疗前化疗后1个月t值P值n 2929 OTUs 668±485386±1863.1500.004 Good's coverage 0.990±0.0060.993±0.003-3.1290.004 Chao11122±715632±3053.942<0.001 PD 44±2230±103.6800.001 Shannon 4.0±1.83.5±1.31.3550.186 Simpson 0.74±0.250.76±0.20-0.3480.731
表8 ALL患儿化疗前与化疗后2个月肠道菌群丰度和多样性比较 (±s)

表8 ALL患儿化疗前与化疗后2个月肠道菌群丰度和多样性比较 (±s)
组别化疗前化疗后2个月t值P值n 1212 OTUs 609±467374±246-2.0340.066 Good's coverage 0.991±0.0050.993±0.004-1.5330.154 Chao1976±689578±3492.2060.050 PD 40±2228±132.2800.044 Shannon 3.4±1.73.4±1.3-0.0950.926 Simpson 0.66±0.260.75±0.19-1.1410.278
基于weighted unifrac距离算法对所有样品进行主坐标分析(principal co-ordinates analysis,PCoA分析)。尽管化疗前及化疗后2周、1个月、2个月ALL 组与健康对照组的样本差异有统计学意义(R=0.035,P=0.041),但各组的肠道菌群结构总体分离不明显。如图1所示。
2.4 ALL患儿肠道菌群组成分析及比较
在门水平上,处于前5位的肠道菌群分别为厚壁菌门、放线菌门、变形菌门、拟杆菌门、疣微菌门(图2)。分析ALL 组与健康对照组及ALL 患儿化疗前后肠道菌群相对丰度的统计学差异。与健康对照组相比,ALL患儿化疗前变形菌门的相对丰度有升高趋势,并在化疗后1个月及2个月显著升高(P<0.05);ALL 患儿化疗前放线菌门的相对丰度有降低趋势,并在化疗后2 周、1 个月及2 个月显著降低(P<0.05);ALL 患儿仅在化疗后1 个月拟杆菌门的相对丰度明显降低(P=0.009)(表9~12)。与化疗前相比,ALL 患儿化疗后放线菌门的相对丰度有降低趋势,变形菌门的相对丰度有升高趋势,但差异均无统计学意义(P>0.05);疣微菌门的相对丰度在化疗后1 个月显著降低(P=0.001)(表13~15)。

表9 化疗前ALL患儿肠道菌群前5门相对丰度与健康对照组比较 [M(P25,P75)]

表10 化疗后2周ALL患儿肠道菌群前5门相对丰度与健康对照组比较 [M(P25,P75)]
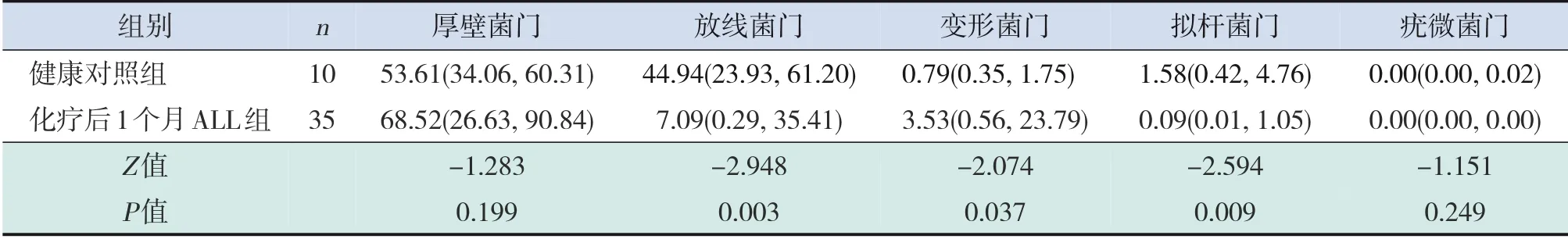
表11 化疗后1个月ALL患儿肠道菌群前5门相对丰度与健康对照组比较 [M(P25,P75)]
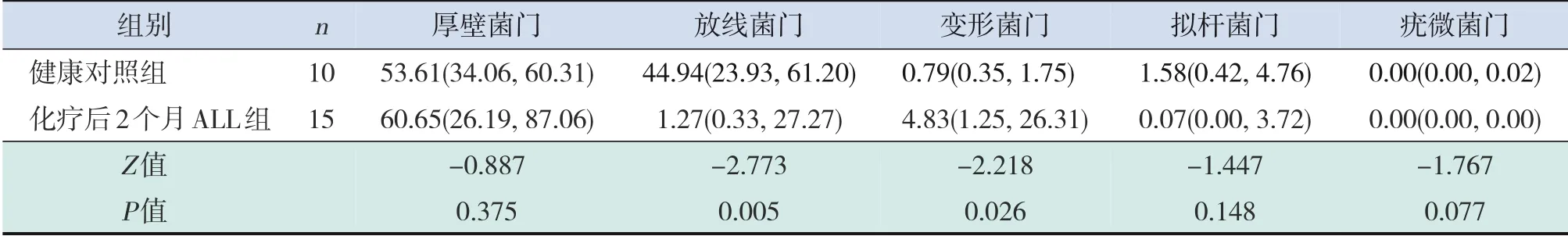
表12 化疗后2个月ALL患儿肠道菌群前5门相对丰度与健康对照组比较 [M(P25,P75)]

表13 ALL患儿化疗前与化疗后2周肠道菌群前5门相对丰度比较 [M(P25,P75)]

表14 ALL患儿化疗前与化疗后1个月肠道菌群前5门相对丰度比较 [M(P25,P75)]

表15 ALL患儿化疗前与化疗后2个月肠道菌群前5门相对丰度比较 [M(P25,P75)]
在属水平上,处于前7位的肠道菌群分别为双歧杆菌属、肠球菌属、链球菌属、埃希氏菌-志贺氏菌属、活泼瘤胃球菌属、克雷伯菌属和Faecalibacterium(图3)。分析ALL组与健康对照组及ALL 患儿化疗前后肠道菌群相对丰度的统计学差异。与健康对照组和ALL患儿化疗前相比,ALL患儿化疗后2 周、1 个月和2 个月肠球菌属、链球菌属和克雷伯菌属的相对丰度有增加趋势,双歧杆菌属、Faecalibacterium相对丰度有降低趋势。双歧杆菌属相对丰度在ALL 患儿化疗后2 周、1 个月及2 个月均较健康对照组显著降低(P<0.05)。克雷伯菌属相对丰度在ALL患儿化疗后1个月及2个月均较健康对照组显著升高,并且在化疗后1个月时较化疗前显著升高(P<0.05);尽管在化疗后2个月与化疗前比较差异无统计学意义(P=0.069),但仍有升高趋势。 与健康对照组比较,Faecalibacterium相对丰度在ALL患儿化疗前后均显著降低,并且在化疗后2周及1个月时相对丰度显著低于化疗前(P<0.05)。肠球菌属相对丰度在ALL 患儿化疗后1 个月及2 个月较健康对照组及化疗前均明显升高(P<0.05)。链球菌属仅在化疗后2周时较化疗前明显升高(P=0.021)。见表16~22。

表16 化疗前ALL患儿肠道菌群前7属相对丰度与健康对照组比较 [M(P25,P75)]

表17 化疗后2周ALL患儿肠道菌群前7属相对丰度与健康对照组比较 [M(P25,P75)]
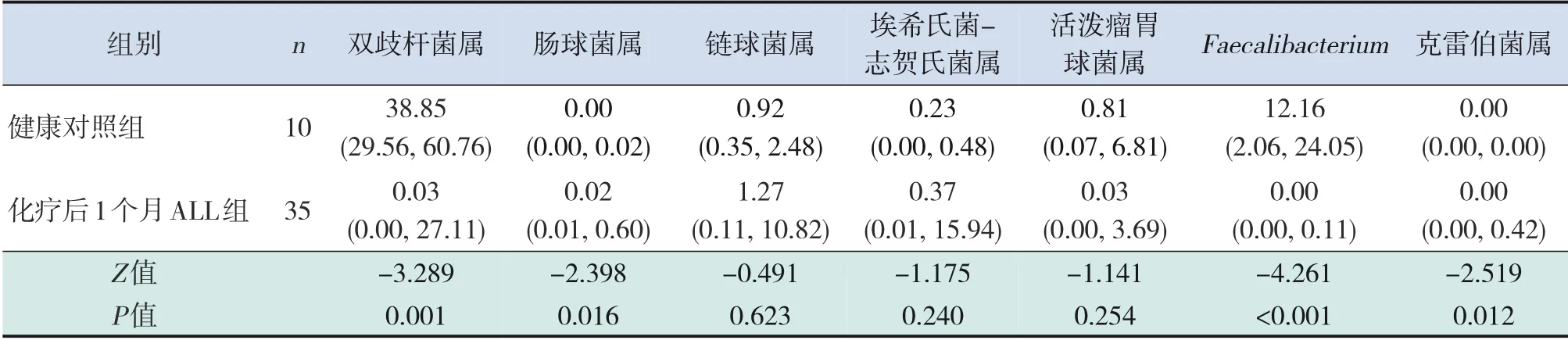
表18 化疗后1个月ALL患儿肠道菌群前7属相对丰度与健康对照组比较 [M(P25,P75)]

表19 化疗后2个月ALL患儿肠道菌群前7属相对丰度与健康对照组比较 [M(P25,P75)]

表20 ALL患儿化疗前与化疗后2周肠道菌群前7属相对丰度比较 [M(P25,P75)]

表21 ALL患儿化疗前与化疗后1个月肠道菌群前7属相对丰度比较 [M(P25,P75)]

表22 ALL患儿化疗前与化疗后2个月肠道菌群前7属相对丰度比较 [M(P25,P75)]
2.5 ALL 患儿化疗前后不同时间点粪便中特异性差异肠道菌群
LEfSe 分析发现在ALL 患儿化疗不同时间点的部分肠道菌群在相对丰度上存在一定差异(图4)。化疗前、化疗后2 周、1 个月和2 个月从门到种水平上的特异性肠道菌群分别有37、22、11 和20个。化疗前相对丰度较高的肠道菌群分布在放线菌门、放线菌纲、双歧杆菌属等。化疗后2周时相对丰度较高的肠道菌群分布在有乳杆菌目、极小韦永氏球菌种、瘤胃球菌属等。化疗后1个月时相对丰度较高的肠道菌群分布在s_Streptococcus_sanguinis_SK36、g_Fusicatenibacter 等。化疗后2 个月时相对丰度较高的肠道菌群分布在丹毒丝菌目、丹毒丝菌科、葡萄球菌属等。
3 讨论
近年来的研究表明,肿瘤的发生发展可能与菌群的多样性和稳定性失调有关。影响免疫细胞的疾病,如ALL、炎症性肠病和幼年特发性关节炎与肠道微生物组成的变化有关,其发生的原因是微生物多样性的减少[2-4]。本研究发现,和健康对照组比较,ALL 患儿化疗前、化疗后1 个月及2 个月肠道菌群alpha 多样性均低于健康对照组,与先前的研究结果一致[6-7]。已发表的几项研究发现,ALL患儿的粪便菌群中富含拟杆菌门、肠球菌科和卟啉单胞菌科等细菌,而缺乏厚壁菌门、毛螺菌科和梭菌门等细菌[2]。本研究对ALL 患儿化疗前粪便样本的肠道菌群分析结果与上述报道不完全一致,可能与人种、地域、饮食结构等因素不同有关。
Zwielehner 等[10]发现化疗后肠道菌群组成发生了改变。一项小鼠模型研究发现经腹腔注射环磷酰胺后肠道细菌多样性减少,并诱导了肠杆菌科、假单胞菌科(变形菌门)和肠球菌科(厚壁菌门)等潜在致病菌群优势生长[11]。有研究发现儿童ALL 患者在强化诱导和再诱导化疗后肠道菌群多样性显著下降[12]。在本研究中,ALL 患儿粪便微生物在化疗后物种丰富度降低,但化疗前和化疗后的alpha 多样性差异无统计学意义,这与上述报道不一致,可能与样本量小有关。但我们观察到化疗后不同时间点肠道菌群的微生物组成与化疗前存在不同,与以往研究结果一致[2]。
通过分析ALL 患儿化疗后与化疗前的肠道菌群相对丰度差异,我们发现变形菌门的相对丰度有升高趋势,放线菌门的相对丰度有降低趋势。属水平上,双歧杆菌和Faecalibacterium相对丰度在ALL 患儿化疗后显著降低,克雷伯菌相对丰度升高。Faecalibacterium prausnitzii可发酵膳食纤维,是有益的短链脂肪酸丁酸盐的主要来源,并具有改善结肠炎的抗炎特性,因此是一种保护性细菌,对肠道健康不可或缺[13]。Faecalibacterium的相对丰度在儿童ALL 患者成年后仍降低,并与炎症标志物IL-6 和C 反应蛋白呈负相关[10]。双歧杆菌对人体健康的有益作用主要是防治肠道疾病和免疫紊乱[14]。而克雷伯菌为公认的人类病原体。因此,本研究结果提示,化疗部分降低了患者肠道有益菌的丰度,引起了ALL 患儿肠道有益菌和有害菌的失衡。
对ALL 化疗前后肠道菌群的结构分析表明,来源于同一个病人的肠道菌群在化疗前后各时间点的分布较分散(存在明显的差异)。虽然化疗前后各组样本分布总体上分离不明显,但肠道菌群结构差异存在统计学意义。属水平上,ALL患儿化疗前相对丰度较高的差异物种为双歧杆菌,化疗后2 周、1 个月和2 个月相对丰度较高的差异物种分别为瘤胃球菌、g_Fusicatenibacter 和葡萄球菌属。
本研究中ALL 患儿化疗后样本采集时间均在化疗后2个月以内,对应的化疗阶段是在VDLD诱导缓解与巩固治疗之间,均处于较强的化疗期。化疗后2周均在VDLD期间,化疗后1个月均在第1个CAM 期间,多数患者的化疗后2 个月在第2 个CAM方案后。本研究对象大部分在化疗后2周进入骨髓抑制期,故化疗后1个月和2个月的时间点基本可以代表化疗后骨髓抑制的状态,在化疗后2个月时都有抗生素治疗史。故本研究中ALL 患儿化疗后肠道菌群的变化除与化疗有关外,还可能受到宿主免疫状态及抗生素的影响。
本研究结果发现,ALL患儿肠道菌群多样性明显低于健康儿童,化疗后肠道菌群丰度显著降低,部分有益菌丰度下降、病原菌丰度增加。但肠道菌群作为一个动态整体,受各种因素的影响,如年龄、压力、饮食、健康状态等[15]。对于ALL 患者的肠道菌群及其调节因素及对化疗效果的影响,我们的认识依然有限。本研究分析了10 例健康儿童样本和40 例ALL 患儿在化疗前后不同时间点的粪便样本,未来尚需增加样本并按疾病危险度、免疫分型等因素继续分层对肠道菌群进行分析研究并构建动物模型验证。

