细胞因子组合对体外扩增造血干/祖细胞分裂模式选择的影响1
朱雪君, 蔡海波, 谭文松
(华东理工大学 生物反应器工程国家重点实验室, 上海 200237)
1 前 言
造血干/祖细胞(hematopoietic stem/progenitor cells,HSPCs)数量不足已成为限制其临床应用的主要瓶颈[1-2]。由于HSPCs 主要有3 种分裂模式,分别为自我更新的对称分裂、分化的对称分裂和不对称分裂,体外扩增时HSPCs 以何种分裂模式进行增殖将决定HSPCs 是扩增还是分化,从而影响HSPCs 的命运[3-4],因此,在体外扩增过程中采用适合HSPCs 进行自我更新的对称分裂模式的工艺条件,才能实现HSPCs的体外有效扩增。
细胞因子及组合是HSPCs 体外扩增中最重要的因素。目前已有多种细胞因子被证实可用于调控HSPCs 的扩增和功能,如干细胞因子(stem cell factor,SCF)、血小板生成素(thrombopoietin, TPO)、FMS-样酪氨酸激酶-3 配体(fms-like tyrosine kinase-3 ligand,FL)、白介素3(interleukin-3, IL-3)、白介素6(interleukin-6,IL-6)、促红细胞生成素(erythropoietin,EPO)、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)、粒细胞-巨噬细胞集落刺激因子(granulocyte -macrophage colony stimulating factor,GM-CSF)等[5-6]。常用于 HSPCs 体外扩增的细胞因子组合主要有 SCF+TPO+FL(STF)、SCF+TPO+FL+IL-6(STF6)和SCF+IL-3+IL-6(S36)等[7-10]。
CD48、Numb 和Musashi-2 在HSPCs 中的表达或分布均可作为评价HSPCs 分裂模式的指标。其中,CD48 在HSPCs 中不表达,但广泛表达于各种成熟的造血细胞中[11]。根据这个特性,若HSPCs 分裂后的子细胞均不表达CD48,则为自我更新的对称分裂;若子细胞均表达CD48,则为分化的对称分裂;若子细胞中只有一个表达CD48,则为不对称分裂。因此,可用扩增后细胞中CD34+CD48-细胞的比例表征HSPCs 自我更新的对称分裂的比例。Numb 蛋白是一种进化保守的蛋白,在HSPCs 中低表达,在分化的成熟细胞中高表达。根据扩增后HSPCs 中Numb 蛋白的表达水平的高低,可表征HSPCs 的分裂模式是对称还是不对称[12]。Musashi 家族的Musashi-2 (Msi2)作为一类进化保守的RRM RNA 结合蛋白,在HSPCs 中高水平表达,而在分化的成熟细胞中低水平表达,因此Msi2 也可以作为HSPCs 分裂模式的检测指标[13]。
尽管已有大量文献报道了细胞因子对HSPCs 体外扩增和功能的影响,但其对HSPCs 分裂模式选择的影响却鲜有关注。为此,本研究以CD34+细胞为对象,在无血清培养体系中采用STF、S36 和STF6 3种细胞因子组合,以CD34+细胞扩增倍数、扩增后CD34+细胞的集落形成能力、代表HSPCs 分裂模式的numb 和musashi-2 在扩增后细胞中的表达水平以及Numb 在子细胞中的分布为评价指标,从体外扩增过程中HSPCs 分裂模式选择的角度,探究细胞因子组合对HSPCs 体外扩增的影响,为优化HSPCs 的体外扩增工艺提供依据。
2 实验材料与方法
2.1 实验材料
RPMI 1640 和IMDM 购于美国Gibco 公司,无血清培养基StemSpan®-SFEM 购于加拿大StemCell 公司。人CD34+细胞免疫磁珠分选试剂盒购于德国Miltenyi Biotech公司。SCF 购于北京义翘神州公司,TPO、FL、IL-3、IL-6、GM-CSF、G-CSF 和EPO 购于美国Pepro Tech 公司。鼠抗人FITC-CD38 抗体和PE-CD34 抗体购于美国Becton Dickinson (BD)公司。同步化试剂诺考达唑(Nocodazole)购于美国Sigma 公司。免疫荧光染色所用抗体购于英国Abcam 公司。RT-PCR 分析所用试剂购于上海天根公司,所用引物购于上海生工公司,引物序列如表1 所示。

表1 RT-PCR 中使用的基因引物序列Table 1 Primer sequence of genes used in RT-PCR
2.2 实验方法
2.2.1 CD34+细胞的培养
依次利用密度梯度离心法和免疫磁珠分选法从脐血中分选出CD34+细胞,分离得到的CD34+细胞纯度在95% 以上。CD34+细胞以5×104cells·mL-1的密度接种于SFEM 无血清培养基中,分别采用S36、STF和STF6 三种细胞因子组合进行体外培养。细胞培养在48 孔细胞培养板中进行,其装液量为1 mL,孔板置于CO2体积分数为5%、37 ℃的饱和湿度培养箱中,在4 d 时进行半量换液,培养周期为7 d。细胞因子质量浓度分别为50 ng·mL-1SCF,20 ng·mL-1TPO,50 ng·mL-1FL,10 ng·mL-1IL-3,20 ng·mL-1IL-6。
2.2.2 细胞表型分析
将细胞平均分成2 份,实验组加入FITC-CD38 和PE-CD34 抗体,对照组加入相应IgG 同型抗体后置于4 ℃孵育30 min,并用FASC Callibur (美国BD 公司)和FlowJo 软件进行检测和结果分析。
2.2.3 集落形成能力测定
扩增后的CD34+细胞以1 000 cells·mL-1的密度接种于装有300 μL 体积分数为20% 的FBS、50 ng·mL-1SCF、2 U·mL-1EPO、20 ng·mL-1IL-6、20 ng·mL-1G-CSF、20 ng·mL-1IL-3、14 ng·mL-1GM-CSF 及5×10-5mol·L-1β-巯基乙醇的半固体培养基的48 孔板中,于体积分数为5% 的CO2、37 ℃的饱和湿度培养箱中培养14 d 后对集落进行计数,并以单位细胞数量(每104个CD34+细胞)形成的集落数表示集落形成能力。
2.2.4 分裂模式测定
2.2.4.1 CD34+CD48-细胞含量测定
采用流式细胞术测定总细胞中CD34+CD48-细胞含量。使用FITC-CD48 抗体和PE-CD34 抗体对细胞进行标记,并用相应的软件对结果进行检测分析。
2.2.4.2 子细胞中Numb 蛋白表达测定
采用免疫荧光法测定Numb 在子细胞中的表达情况。首先将细胞在含75 nmol·L-1Nocodazole 的培养基中孵育22 h。之后将细胞以2×106cells·mL-1的密度黏附在多聚赖氨酸包被的玻片上进行固定、透膜后,加入一抗(goat anti-Numb 和rabbit anti-CD34)孵育过夜后加入二抗(donkey anti-goat Alexa Fluor®647 和donkey anti-rabbit Alexa Fluor®488)室温孵育1 h,最后加入DAPI 进行细胞核染色,并用激光共聚焦显微镜观察子细胞中CD34 和Numb 的表达鉴定细胞分裂模式,使用Image J 软件对成对子细胞中CD34 和Numb 的表达情况进行统计并计算相应比例。其中,成对子细胞均为CD34+Numb-细胞为自我更新的对称分裂,成对子细胞均为CD34-Numb+细胞为分化的对称分裂,成对子细胞中只有一个为CD34+Numb-细胞,则为不对称分裂。
2.2.4.3 qRT-PCR 测定胞内numb 与musashi2(msi2)基因表达水平
采用实时荧光定量PCR 对细胞内的numb 与msi2 基因mRNA 表达水平进行测定,主要包括总RNA提取、反转录和实时荧光定量PCR 3 个步骤,以上步骤均按照试剂盒说明书操作。numb 和msi2 基因表达差异的判断依据是:当两组细胞中numb 和msi2 基因的相对表达量小于0.5 或大于2 倍时,numb 和msi2 基因表达显著下调或上调,否则numb 和msi2 基因表达无差异。
2.2.5 统计学分析
采用SPSS 统计分析软件对实验结果进行统计学分析,数据以平均值±标准差(Mean ±SD)的形式表示,显著性水平p<0.05 表示存在显著性差异。
3 结 果
3.1 细胞因子组合对HSPCs 体外扩增特性的影响
本研究首先考察了SCF+IL-3+IL-6(S36)、SCF+TPO+FL(STF)和SCF+TPO+FL+IL-6(STF6)3 种细胞因子组合对HSPCs 体外扩增的影响。培养7 d 后总细胞扩增倍数如图1 所示,STF6 组总细胞扩增倍数为(11.0±0.6)倍,与STF 组的(9.8±3.1)倍相近,均显著高于S36 组的(8.3±3.1)倍(p<0.05)。
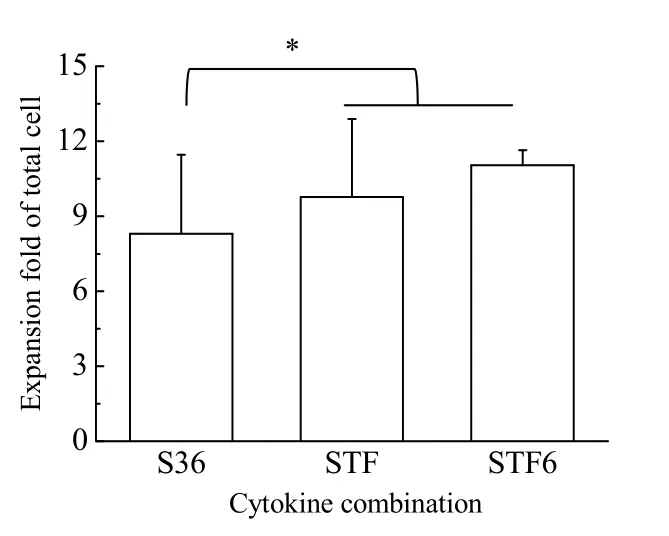
图1 总细胞扩增倍数(n=4)Fig.1 Expansion folds of total cells (n=4)*: p<0.05
细胞因子组合对培养物中HSPCs 细胞比例的影响如图2 所示。STF 组的 CD34+细胞比例为(57.0±10.6)%,明显高于 S36 组的(47.0±8.0)% 和STF6 组的(44.3±5.6)% (p<0.05) (图2(a))。相对应的STF 和STF6 组的CD34+细胞的扩增倍数也明显高于S36 组(图2(b))。采用3 组细胞因子组合扩增后的CD34+细胞的集落形成能力的比较结果如图2(c),STF 和STF6 组扩增CD34+细胞的集落形成能力也显著高于S36组,表明采用STF 和STF6 细胞因子组合扩增CD34+细胞,更有利于维持扩增后CD34+细胞的生理功能。

3.2 细胞因子组合对HSPCs 分裂模式选择的影响
采用流式细胞术检测培养物中CD34+CD48-细胞的比例,利用免疫荧光染色法标记扩增后CD34+细胞中Numb 蛋白的表达以及应用RT-PCR 技术测定扩增后CD34+细胞中numb 和musashi-2 的基因表达水平,考察细胞因子组合对HSPCs 分裂模式选择的影响。
采用3 组细胞因子组合体外扩增CD34+细胞7 d 后,总细胞中CD34+CD48-细胞比例如图3 所示,STF 组和STF6 组的CD34+CD48-细胞比例分别为(42.62±0.55)% 和(36.43±5.73)%,显著高于S36 组(27.16±2.18)% (p<0.05)。

图3 总细胞中CD34+ CD48- 细胞含量(n=4)Fig.3 Percentages of CD34+ CD48- cells in total cells (n=4)
而从图4 的成对子细胞中均为CD34+Numb-细胞的比例结果可知,STF 组和STF6 组成对子细胞均为CD34+Numb-细胞的比例分别为(40.89±3.92)% 和(41.34±4.43)%,均显著高于S36 的(30.74±1.84)% (p<0.05)。

图4 免疫荧光法测定CD34+中自我更新的对称分裂比例(n=4)Fig.4 Percentages of self-renewal symmetric division in CD34+ cells analyzed by immunofluorescence (n=4)
图5 为扩增后的CD34+细胞中numb 和msi2 的基因表达水平。从图中结果可知,与S36 组相比,STF组和STF6 组CD34+细胞中的numb 的mRNA 表达水平均显著下调,msi2 基因的mRNA 表达水平均显著上调,而STF6 组CD34+细胞中numb 和msi2 基因的mRNA 表达水平与STF 组CD34+细胞中无差异。以上结果表明与S36 组相比,STF 组和STF6 组中进行自我更新的对称分裂的细胞更多。
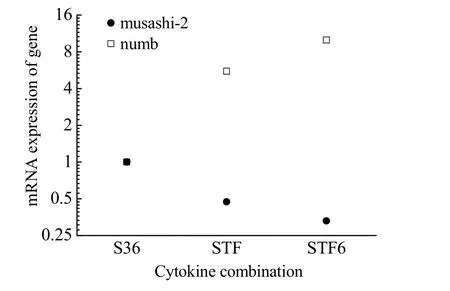
图5 CD34+细胞中numb 和musashi-2基因表达(n=4)Fig.5 Gene expression of numb and musashi-2 in CD34+ cells (n=4)
综合以上结果可知,与S36 组相比,采用STF 和STF6 细胞因子组合扩增CD34+细胞时,更有利于细胞进行自我更新的对称分裂。
进一步分析CD34+细胞自我更新对称分裂和总细胞扩增倍数及CD34+细胞扩增倍数间的关系,结果如图6 所示。从图中可以看出,CD34+细胞自我更新对称分裂和总细胞扩增倍数之间没有相应关系,即总细胞扩增倍数不会随着CD34+细胞自我更新对称分裂的增多而增加。而CD34+细胞自我更新对称分裂与CD34+细胞扩增倍数呈正相关,即CD34+细胞自我更新的对称分裂比例越多,CD34+细胞的扩增倍数也越高。

图6 CD34+ 细胞自我更新对称分裂与扩增倍数间的关系Fig.6 Relationship between self-renewal symmetric division and expansion fold of CD34+ cells
4 讨 论
细胞因子添加法是HSPCs 体外扩增的主要方法之一。多种细胞因子的协同作用更有利于HSPCs 的扩增。尽管不同的细胞组合均可以促进HSPCs 的体外扩增,但目前扩增效果好的细胞因子组合中通常包括SCF、TPO 和FL[14-15]。本研究以CD34+细胞为对象,以总细胞扩增倍数、CD34+细胞比例和扩增倍数、扩增后 CD34+细胞的集落形成能力为指标分析了无血清培养体系中不同细胞因子组合S36、STF 和STF6 作用下HSPCs 的扩增和功能特性。结果发现,与细胞因子组合S36 相比,细胞因子组合STF 和STF6 均能够显著提高HSPCs 的体外扩增和集落形成能力。并在此基础上,从HSPCs 分裂模式选择的角度出发,通过检测总细胞中CD34+CD48-细胞的含量、总细胞中成对子细胞均为CD34+Numb-细胞的比例以及CD34+细胞中numb 和musashi-2 基因的表达能力等,考察了3 种细胞因子组合对HSPCs 分裂模式选择的影响,结果表明,与细胞因子组合S36 相比,在细胞因子组合STF 和STF6 作用下更多的HSPCs 选择自我更新的对称分裂。此外,本研究进一步分析了HSPCs 自我更新的对称分裂比例和细胞扩增倍数间的关系,结果表明总细胞扩增与HSPCs 选择自我更新的对称分裂无关,HSPCs 分裂模式的选择不会影响细胞的分裂速率。而CD34+细胞的扩增倍数与HSPCs 选择自我更新的对称分裂呈正相关,即选择自我更新对称分裂的HSPCs数量越多,CD34+细胞的扩增倍数也越高。Wang 等[10]在研究细胞因子组合对外周血HSPCs 体外扩增影响的过程中发现STF 组和STF6 组CD34+细胞的扩增倍数相当,而含IL-3 的实验组中CD34+细胞的比例显著降低,与本研究中的结果一致。Hinge 等[16]通过敲除RhoGTPase 胞内抑制蛋白P190-B 的基因提高HSPCs自我更新的对称分裂,结果发现P190-B 基因敲除组中HSPCs 数目也显著增加,他们的研究结果也表明HSPCs 自我更新的对称分裂的提高对应HSPCs 数量的增加,与本研究的结论一致。
5 结 论
体外培养过程中所采用的细胞因子组合通过影响HSPCs 分裂模式的选择而调控HSPCs 的扩增效果。在本研究所考察的S36、STF 和STF6 三种细胞因子组合中,后2 组更有利于促使HSPCs 选择自我更新的对称分裂模式,从而提高HSPCs 的体外扩增倍数和集落形成能力。
——《古对今》教学活动设计

