生物钟节律相关因素对女性HPV转阴影响的前瞻性队列研究
王福媛 王朝霞 赵乐 辛利清 和思敏 王彤
作者单位:030001 太原 1山西医科大学第一医院妇科;2山西医科大学公共卫生学院
高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染可引起宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),其中宫颈高度鳞状上皮内瘤变(high-grade squamous intraepithelial lesion,HSIL)被认为是宫颈癌的前期病变,而宫颈低度鳞状上皮内瘤变(low-grade squamous intraepithelial lesion,LSIL)大多会自然消退,仅少部分发展为高度病变甚至宫颈癌[1]。大量研究表明,由宫颈感染HPV到发生CIN,再发展为宫颈浸润癌,一般需要8~10年时间,因此及时发现宫颈癌癌前病变并进行针对性干预,可以有效预防宫颈浸润癌的发生[2-3]。
随着宫颈癌早期诊断工作的广泛开展以及筛查方法的不断改进,HPV感染患者数量越来越多,尤其是城市职业女性感染发现率逐渐升高,其中部分患者为一过性感染,部分患者为持续性感染并出现宫颈病变[4-5]。目前,HPV感染伴随的问题也越来越多,例如感染患者的焦虑状态、治疗与否的艰难抉择、对HPV性传播途径质疑导致的家庭夫妻问题、过度担心而误入非正规治疗导致的巨额经济损失等[6]。因此,如何筛选易感染HPV群体,针对HPV感染人群的合理干预及长期随访以及影响HPV清除的因素等越来越受到关注。
有文献报道,昼夜节律的紊乱与糖尿病、心脏代谢紊乱和癌症关系密切[7]。临床和临床前证据也显示生物钟与肿瘤发生密切相关[8]。轮班工作、时差、迟到等导致昼夜节律中断、夜间光照以及深夜暴饮暴食等与癌症发生风险增加有关[9-11]。本课题组前期的临床观察和初步调查问卷显示HPV持续感染人群大多有夜班、倒班、频繁起夜等历史[12],同时结合前期关于生物钟节律对女性生殖系统肿瘤影响的研究[13],本研究针对HPV感染和LSIL,严格按照纳入排除标准建立队列,分析生物钟节律相关影响因素对HPV感染和宫颈癌前疾病转归的影响,并基于调查问卷分析HPV感染人群焦虑等精神状态的改变,同时设置治疗干预和随访观察队列,分析临床干预对HPV感染人群的贡献效益以及对疾病转归的贡献度,旨在为指导女性群体规避HPV感染的生物钟节律相关危险因素做好预防,从而降低HPV感染率,提高HPV感染后清除率,减少CIN的发生,进而预防宫颈高级别病变以及宫颈癌的发生。
1 资料与方法
1.1 研究对象
本研究数据来源于山西医科大学第一临床医学院,选取2020年1月—2020年2月于本院就诊的HPV阳性患者中已通过子宫颈病理活组织学检查确诊为慢性宫颈炎合并HPV感染,CINⅠ级,且妇产科门诊体检既往无宫颈病变病史及肿瘤史的女性患者为研究人群并建立队列。纳入标准:⑴根据临床TCT和Aptima筛查HPV感染情况并经阴道镜下活检证实为单纯HPV感染或CINⅠ级的患者;⑵自愿参加本研究的患者。排除标准:⑴既往有HPV感染史的患者;⑵接种过HPV疫苗的患者;⑶并发精神疾病的患者;⑷由于言语、智力障碍等原因不能理解或不能完成问卷的患者;⑸并发其他危及生命疾病的患者。
1.2 研究方法
本研究采用面对面调查的方式,调查开始前对参与调查的人员进行培训,保证调查指导语、答疑句式等客观统一。调查前告知研究对象本次调查目的,获得患者及家属知情同意,并承诺严格保密调查内容。在发放病例组调查表时,调查员说明填写内容,确保获得的流行病学资料均为患病前资料。
研究对象基本情况采用自制的问卷进行调查,体育活动采用国际体力活动问卷(international physical activity questionnaire,IPAQ)测量[14],焦虑状态采用焦虑自评量表(self-rating anxiety scale,SAS)[15]评估,分别采用匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI)[16]和睡眠状况自评量表(self-rating scale of sleep,SRSS)对患者的长期和近期睡眠质量进行评估。其中自制问卷内容包括一般人口学特征(性别、年龄、文化程度、职业、婚姻状况、经济收入、居住情况等),生活方式(生活习惯、饮食习惯、食物摄取情况),健康状况(患病史、家族史、并发症等)和性生活状况(初次性生活年龄、避孕方式、性伴侣个数、性伴侣性活跃状况、妊娠次数、分娩方式)等。PSQI问卷由匹兹堡大学编制,包括睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物和日间功能障碍7个维度,每个维度按0~3分进行评分,共分为4级(好、较好、差、很差),各维度累计得分为PSQI总分,得分范围为0~21分,得分越高,代表睡眠质量越差。SRSS由中国心理卫生协会常务理事、中国健康心理学杂志执行主编李建明教授编制,并在全国协作组制定出中国常模(标准)。采用该量表评估患者近1个月的睡眠情况,得分范围10~50分,总分越低表示睡眠质量越好,以得分>23分表示近1个月睡眠质量差。
1.3 随访方法
根据研究纳入排除标准,共有511例受试者完整参与整个调查过程,研究于基线调查后,每4~6个月进行门诊随访,随访截至2020年12月,期间主要记录研究对象的HPV复查转阴情况。HPV E6/E7 mRNA检测所用技术为Aptima HPV检测技术,检测限于高危型HPV mRNA检测,不进行具体型别鉴定。门诊就诊患者可自主选择是否用药,研究纳入者为应用干扰素或女性抗毒洁阴复合剂(瑞贝生)或不用药3组患者,研究将用药情况作为协变量纳入研究模型,分析生物钟节律相关因素的影响。
1.4 统计学方法
采用EpiData 3.0软件录入数据,SPSS 21.0软件分析数据。计量资料以均数±标准差()表示,组间比较采用独立样本t检验;计数资料以例数(百分比)表示,组间比较采用χ²检验。对单因素比较差异有统计学意义的因素进行多因素logistic回归分析,确定各因素对HPV转阴的影响,并计算优势比(odds radio,OR)及其95%置信区间(95%CI)。以P<0.05为差异具有统计学意义。
2 结果
2.1 HPV感染后转阴的单因素分析
本研究共纳入511例受试者,平均年龄为(46.04±10.89)岁,其中HPV感染未转阴组267例(52.25%,267/511),转阴组244例(47.75%,244/511),生物钟节律的关键因素(年龄、焦虑状况和近期睡眠)、性生活频率、妊娠次数、工作状态以及药物干预与HPV感染后转阴有关(均P<0.05),其中转阴组中61.07%(149/244)的患者近期睡眠质量较差,未转阴组中81.27%(217/267)的患者报告近期睡眠质量较差,两组比较差异有统计学意义(P<0.001),见表1。
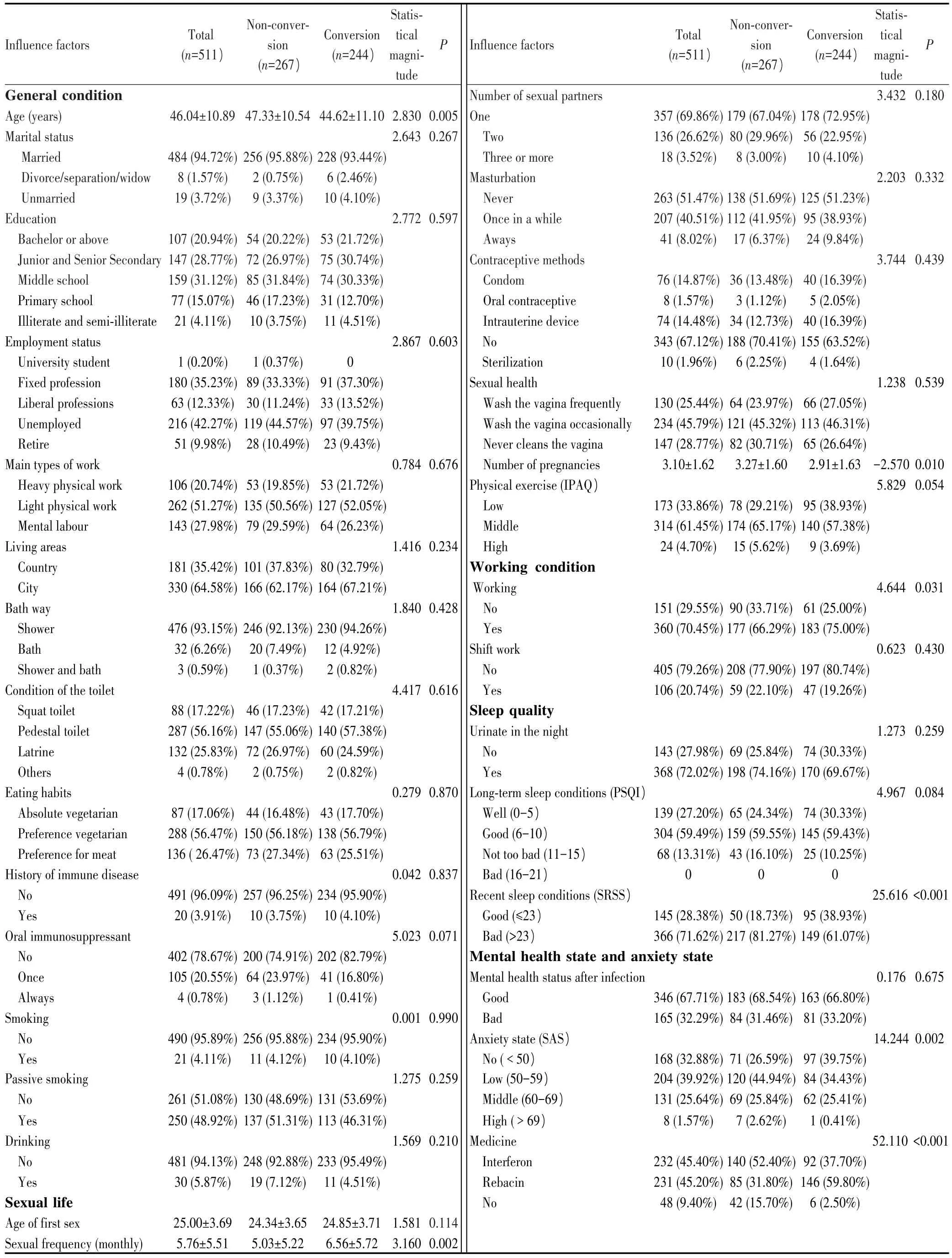
表1 HPV感染后转阴的单因素分析Tab.1 Univariable analysis of influencing factors of negative turn after HPV infection
2.2 HPV感染患者的睡眠质量评估结果
睡眠评估结果显示,511例患者总体近期睡眠状况较差,SRSS平均得分为(26.23±5.75)分,其中失眠后的生理心理反应、睡眠时间不足、入睡困难得分较高,分别为(3.66±1.20)分、(2.99±0.83)分、(2.95±1.01)分。中长期睡眠质量评估中,511例患者平均PSQI得分为(7.46±2.73)分,其中入睡时间、睡眠质量和日间功能障碍得分较高,分别为(1.76±0.86)分、(1.67±0.82)分、(1.36±0.63)分。
2.3 HPV感染后转阴的多因素分析
多因素logistic回归分析结果(表2)显示,近期睡眠质量和药物干预是HPV感染后转阴的独立影响因素,其中近期睡眠状况差是HPV持续感染的危险因素,睡眠质量好的患者在HPV感染后转阴的概率较睡眠质量差的患者升高1.861倍(OR=2.861,95%CI:1.735~4.715)。相较于未用药患者,应用瑞贝生(OR=0.444,95%CI:0.299~0.662)或干扰素(OR=0.080,95%CI:0.031~0.206)治疗更有利于HPV感染后转阴,相比较而言,瑞贝生效果更为理想。

表2 HPV感染后转阴的多因素logistic回归分析Tab.2 Multivariable logistic regression analysis of influencing factors of negative HPV infection
3 讨论
宫颈癌的发生发展与HPV持续感染密切相关[17]。HPV感染后,绝大多数机体可以自主清除,只有小部分人群为持续携带状态,继而发展为CIN,甚至发展为癌[18]。既往研究显示,内蒙古、山西、陕西等地是我国宫颈癌的高发地区,其中山西省的宫颈癌死亡率更是高居全国前列[19],因此探索本省HPV感染转归的影响因素尤为必要。
HPV长期以来以多种策略逃避人类免疫系统的识别和消除,具有独特生命周期的HPV超过真皮,远离免疫细胞[20-21],但影响机体免疫机能的因素如睡眠、体育锻炼等对HPV感染人群的疾病转归贡献度尚需深入探讨。生物钟是机体必不可缺的生物学功能,控制机体24 h昼夜节律性,也是影响生理学和行为学的重要功能。生物钟系统不仅在产生生物节律方面起重要作用,还参与细胞增殖和凋亡的周期过程[22],昼夜节律的改变与人类和其他哺乳动物的肿瘤形成有关[23]。夜班/倒班等昼夜节律紊乱的肿瘤患者,机体免疫性因子表达改变,整体处于免疫功能下降状态[24],与无节律异常的患者相比,临床分期更晚,恶性程度更高,预后更差[12,25]。节律紊乱患者术后的免疫相关蛋白表达也明显减少,这也证实生物钟节律紊乱会影响机体免疫功能从而影响肿瘤的发生发展[12,26]。生物钟节律在女性生殖系统肿瘤发生发展和治疗也有重要的调控作用。有研究指出昼夜节律周期、肿瘤大小和褪黑素水平可能影响宫颈癌对辐射的反应[27]。既往研究显示,内源性的昼夜节律改变会引起睡眠障碍,这可能是由生物钟调节或捕获机制的慢性变化引起的[28];碎片化和断断续续的睡眠会影响免疫系统,使其抗癌能力减弱[29]。在妇科肿瘤患者研究中发现该群体存在较明显的焦虑和抑郁情绪表现[30]。在乳腺癌患者中,细胞免疫功能减退可能与焦虑合并抑郁程度相关[31]。而有研究显示,睡眠障碍的存在可能足以改变免疫功能,即使在没有抑郁症的情况下也是如此,而这一过程反过来可能会促进宫颈疾病的进展[32]。在HIV+合并HPV感染女性的一项研究中,即使使用包括健康行为和医学控制变量的非常保守的中介模型,睡眠困难依然是影响HPV病毒感染后清除的重要中介因素,这一发现对研究此类患者睡眠障碍在病毒清除中的作用具有重要贡献[33]。但是目前生物钟节律相关影响因素对HPV感染转归的作用尚不明确,为此本研究基于本团队前期有关HPV持续感染人群特征以及生物钟节律与女性生殖系统肿瘤关系的相关研究结果,进一步分析了HPV感染人群的睡眠质量以及影响HPV转阴的因素,结果发现511例患者的总体睡眠状况较差,其中生理心理反应、睡眠时间不足、入睡困难表现较明显,而且未转阴组高达81.27%(217/267)的患者报告近期睡眠质量较差,明显高于转阴组的61.07%(149/244),由此可见,HPV感染患者普遍存在近期睡眠质量较差的现象。同时本研究的单因素分析发现生物钟节律关键因素(年龄、睡眠质量、焦虑状态)以及性生活频率、妊娠次数、工作状态等与HPV感染后转阴有关,多因素logistic回归结果显示,近期睡眠质量和药物干预是HPV感染后转阴的独立影响因素,其中近期睡眠质量好是HPV感染后转阴的一个独立保护因素,说明睡眠质量对HPV感染后的转归具有重要作用。本研究结果有助于指导女性群体规避HPV持续感染的危险因素,提高HPV感染后清除率从而预防宫颈病变的发生。同时本课题组目前正在开展生物钟节律对机体免疫机能影响的基础研究,今后将进一步揭示生物钟节律对宫颈病变发生发展的分子作用机制。

