神经轴突导向因子Netrins及其受体在恶性肿瘤中的研究进展
高星 叶甲舟 卢露 李永强 林燕 梁嵘
作者单位:530021 南宁 广西医科大学附属肿瘤医院1化疗一科,2肝胆胰外科
Netrins是一类自分泌蛋白和膜结合蛋白,通过与不同类型的受体结合,在轴突的导向和神经细胞的迁移、分化和凋亡等发挥吸引和排斥双重功能。当Netrins仅与结直肠癌缺失基因(deleted in colorectal carcinomal gene,DCC gene)受体结合时可介导轴突吸引作用,即传递吸引性信号,诱导轴突朝向Netrins高浓度的区域生长;而当Netrins单独与UNC5同源物(UNC5 homolog,UNC5H)受体结合时可介导短时程的排斥作用,诱导轴突朝向远离Netrins方向生长。当DCC受体与UNC5H受体共同存在时主要介导长时程排斥作用[1-2]。研究还发现,在大鼠大脑中动脉闭塞模型(middle cerebral artery occlusion,MCAO)中过表达Netrins1(NTN1)后可刺激JNK1/c-Jun信号通路的激活,诱导脑缺血后突触的形成与轴突再生,进而促进神经功能的恢复,提示Netrins对神经损伤具有一定的修复作用[3]。
除了在上述神经系统发育中的作用,Netrins还参与调节炎症以及心血管、肾脏和肿瘤等疾病的发生、发展。随着研究的不断深入,以Netrins为切入点探索肿瘤的分子机制研究取得了一定进展,并受到广大科研学者的青睐。目前研究证实,Netrins在人类多种恶性肿瘤中异常表达,且其表达水平与恶性肿瘤的发生、发展、转移以及恶性程度密切相关。肿瘤的发生、发展是一种多基因参与的复杂过程,涉及细胞的恶化、凋亡、迁移以及微环境的变化等。因此,研究Netrins在肿瘤发生、发展中的作用具有重要意义。本文就Netrins在调节各种肿瘤细胞生物活性等方面的作用及机制作一综述。
1 Netrins蛋白家族分类及结构特性
Netrins家族由ISHII等[4]于1992年首次发现,可在神经前体细胞、内皮细胞、上皮细胞、心肌细胞、肾小管细胞和肿瘤细胞中表达,属于分泌蛋白或膜结合蛋白,在神经系统发育过程中可作为趋化性因子,介导神经细胞和轴突的迁移。在哺乳动物中,Netrins家族目前已发现6个成员,包括4种分泌蛋白NTN1,Netrin-3(NTN3),Netrin-4(NTN4)和 Netrin-5(NTN5)以及2种糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定的膜蛋白 Netrin-G1(NTNG1)和 Netrin-G2(NTNG2)[5]。Netrin-2(NTN2)虽然是NTN3的直系同源物,但是仅存在于蠕虫和鱼类中[6]。NTN1和NTN3的N末端与层黏连蛋白γ链具有同源性,NTN4的N末端则与层黏连蛋白β链具有同源性。此外,NTN1、NTN3、NTN4的其他结构均由3个EGF样重复序列(V-1、V-2和V-3)的层黏连蛋白V结构域以及1个带正电的C末端域(NTR/C345C)组成。而NTN5缺少层黏连蛋白的同源性N末端,仅由层黏连蛋白V结构域和C345C结构域组成[6]。NTNG1/NTNG2的N末端与层黏连蛋白γ和β链均具有同源性,但与层黏连蛋白γ链同源性最强,其余部分由上述层黏连蛋白V结构域和一个C末端组成。与分泌型Netrins蛋白不同,Netrin-G蛋白的C端序列(称为域C′)是疏水的,并以GPI脂质接头结尾,可将蛋白质连接到细胞质膜的细胞外表面[7]。鉴于Netrins结构的复杂性与多样性,Netrins的受体可通过与其不同部位相结合,从而具有多重生物学功能,如细胞迁移、血管生成、免疫炎症和肿瘤发生等。
2 Netrins受体
2.1 分泌型Netrins蛋白受体
迄今为止,文献报道哺乳动物中与分泌型Netrins蛋白结合的主要受体包括DCC、neogenin(NEO1)、UNC5H、唐氏综合症细胞黏附分子(down syndrome cell adhesion molecule,DSCAM)、腺苷A2b受体以及整合素(integrin)[8]。其中,UNC5H是Netrins受体中最大的家族,由UNC5A、UNC5B、UNC5C和 UNC5D组成。
2.2 膜结合型Netrins蛋白受体
Netrin-G膜结合蛋白不与上述的分泌型Netrins蛋白受体相互作用,而是与Netrin-G受体(NGL,又称为LRRC4)结合来调节神经元之间的相互作用。其中,NGL1选择性与NTNG1结合,NGL2也仅与NTNG2相互作用[9]。NGL3均不与NTNG1和NTNG2结合,而是通过和跨膜受体酪氨酸磷酸酶相互作用来促进谷氨酸能的突触形成[10]。目前,所有已知的Netrins受体中除了A2b和整合素,均为单次Ⅰ型跨膜蛋白,属于免疫球蛋白超家族(immunoglobulin superfamily,Ig superfamily)成员,由胞外区、跨膜区与胞内区3个功能区组成。
Netrins受体可以执行2个独立的信号通路。当Netrins配体存在时,Netrins可通过与其受体结合激活经典的信号通路,提高细胞的存活率,有助于细胞存活、迁移和分化等。在Netrins配体缺乏的情况下,受体并不处于失活状态,而是启动下游的促凋亡信号通路,诱导细胞凋亡[11]。
在正常细胞中,Netrins配体含量较少而受体含量较多。而在肿瘤细胞中,Netrins配体表达水平上调,受体表达减少,配体与受体结合调控癌细胞存活以及分化,并抑制受体启动凋亡程序。其中,细胞凋亡紊乱是肿瘤形成的重要机制,如果细胞凋亡受到抑制,细胞死亡减少,细胞数目就会不断增加,表现为细胞呈增殖积聚,而这是肿瘤发生的重要基础。因此,研究Netrins及其受体相互作用在肿瘤发生、发展中的作用机制及其调控机制对肿瘤治疗具有重要意义。
3 Netrins及其受体在肿瘤中的作用
现有研究表明,Netrins作为潜在的癌基因或抑癌基因,调控多种肿瘤发生、发展,并具有诊断和评估预后价值,其作用机制是错综复杂的生物学过程,受到众多肿瘤因子及信号通路调节(图1)。
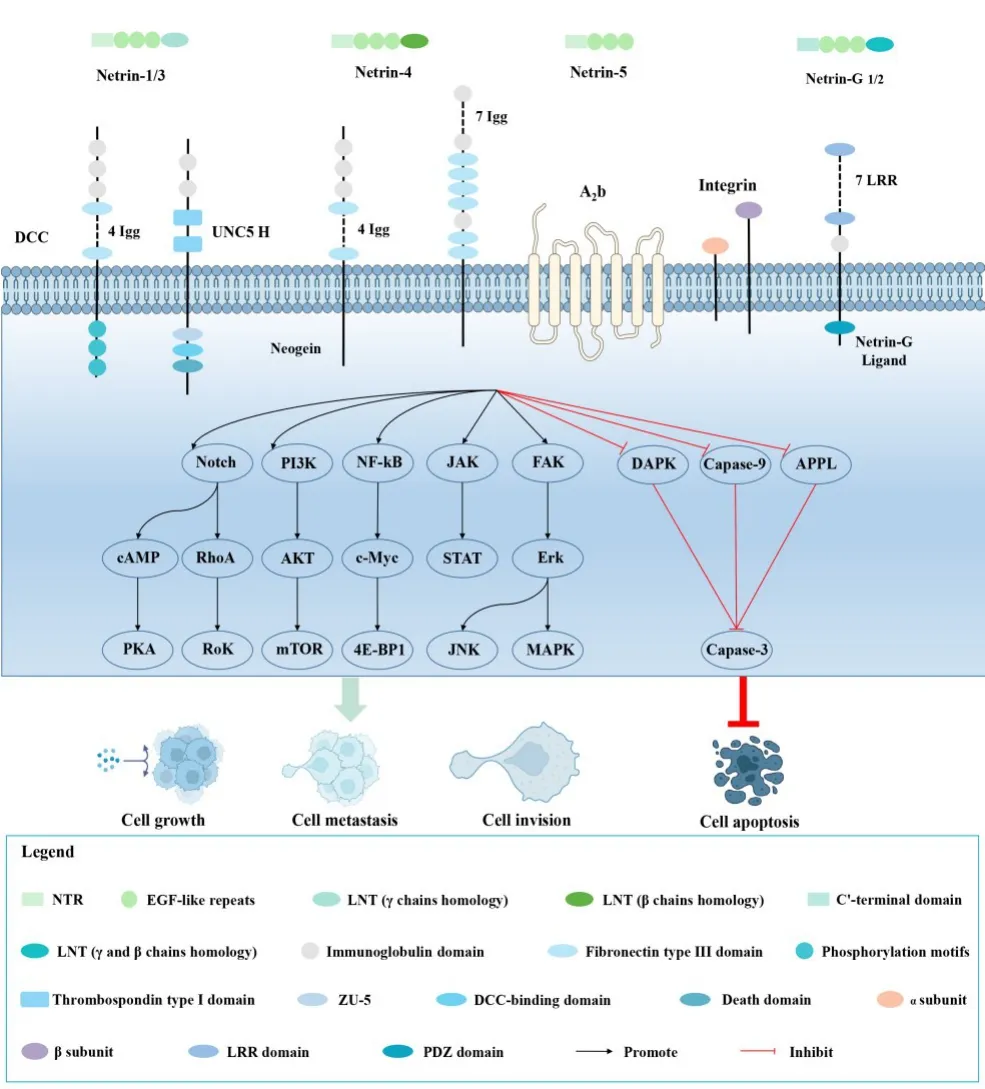
图1 Netrins及其受体在肿瘤中的信号通路图Fig.1 Signaling pathway of Netrins and its receptors in tumors
3.1 Netrins与神经母细胞瘤
神经母细胞瘤(neuroblastoma,NB)患者可分为5个阶段,即1、2、3、4和4S阶段[12],DELLOYE-BOURGEOIS等[13]在儿童第4阶段的NB组织中发现NTN1表达上调,且NTN1的表达水平与第4阶段患者的总生存期呈负相关。此外,该研究还发现沉默NB细胞中NTN1的表达,不仅抑制了肿瘤转移,还诱导了继发部位转移病灶的消退。近年来,JIANG等[12]在NB细胞和组织中同样检测到NTN3的表达,并且NTN3在NB患者第4阶段中表达最高,与患者的总生存时间呈负相关;进一步提取ZHANG等[14]已公布的498例NB患者的数据进行验证,同样证实了NTN3高表达是NB预后不良的标志。因此认为,NTN1和NTN3对NB细胞存活和肿瘤的发生具有重要作用。
研究还发现,Netrins参与NB发生的这一过程中受到肿瘤明星分子及信号通路的调节。DELLOYEBOURGEOIS等[13]在NB细胞中敲低NTN1的表达,发现UNC5H/DAPK信号通路被激活,细胞凋亡的数目增加,同时抑制了裸鼠体内肿瘤细胞的扩散和转移。MYCN被认为是影响患者生存的基因之一,与癌症侵袭性相关。随后,JIANG等[12]进一步研究发现在MYCN扩增的NB患者中,NTN3表达升高,NB患者预后较差;而沉默MYCN后,NTN3表达则显著降低。在无MYCN扩增的患者中,NTN3则不具备预后预测能力。此外,NTN3启动子基因座中还存在MYCN的结合位点,提示NTN3是MYCN的靶基因。因此,深入研究并揭示Netrins及其受体在NB中的分子生物学机制,可能为NB的靶向治疗提供新的方向。
3.2 Netrins与胶质母细胞瘤
胶质母细胞瘤(glioblastoma multiforme,GBM)是中枢神经系统中最常见、最具侵略性的脑恶性肿瘤[15]。有研究报道,在GBM患者的肿瘤组织中NTN1呈高表达,且其表达水平与Ki-67、肿瘤分级、肿瘤恶性程度呈正相关,提示NTN1在GBM诊断及预后评估中具有一定的应用前景[16]。HU等[17]对TCGA数据库中的425例GBM患者数据进行分析,发现NTN4在GBM患者的肿瘤组织中呈低表达,且NTN4低表达预示患者预后较差。
替莫唑胺(temozolomide,TMZ)是目前治疗GBM的一线化疗药物,通过触发DNA损伤诱导GBM细胞凋亡和衰老,从而发挥作用[18]。研究发现,NTN4可与整联蛋白 β4(integrin β4,ITGB4)共同作用,诱导PI3K-AKT-mTOR信号通路的激活,刺激AKT和mTOR磷酸化水平增加,进而保护细胞免于TMZ诱导的细胞衰老,提高GBM细胞对TMZ的耐药性[17,19]。LI等[20]进一步的GBM细胞测序结果发现,NTN4与EGFR表达呈正相关,与使用TMZ治疗的GBM患者预后呈负相关。而用EGF刺激GBM细胞后发现,NTN4的表达上调,ERK、AKT、Src和mTOR磷酸化水平升高,导致GBM细胞中的DNA损伤减少[20]。因此,EGF/EGFR调节了NTN4的表达,靶向EGFR/NTN4轴的组合方法在GBM治疗中可能是有效的干预策略。此外,NTN1还可通过激活NTN1/NEO1/FAK/Intergrin β1和NTN1/UNC5B/NEO1/Gsk3α/Gsk3β两条信号通路调节c-Myc表达,从而参与对GBM新生血管形成过程的控制,进而促进GBM细胞的增殖、侵袭和迁移[21]。总体来说,Netrins在GBM细胞中的复杂功能由不同受体和多种信号通路介导,因此阐明其关键分子机制,可能为GBM的靶向治疗提供有效靶点。
3.3 Netrins与乳腺癌
乳腺癌(breast cancer,BC)是威胁女性健康的主要恶性肿瘤之一[22]。WISCHHUSEN等[23]使用USMI对NTN1差异表达的裸鼠模型进行检测,发现NTN1高表达裸鼠的USMI信号更强,而NTN1低表达裸鼠的USMI信号减弱。因此,NTN1为BC的诊断和基因治疗提供了新思路,可能成为BC患者分层诊断的辅助诊断方法。此外,LARRIEU-LAHARGUE等[24]通过裸鼠模型发现过表达NTN4促进了乳腺癌肿瘤细胞内信号转导分子AKT、ERK和S6的磷酸化,诱导了肺部肿瘤转移灶明显增多及肿瘤血管生成,进而加速了小鼠的死亡,提示NTN4在BC中扮演癌基因的角色。随后,又有研究发现过表达NTN4可诱导EMT相关蛋白N-cadherin和vimentin表达下调,进而减弱BC细胞的迁移和侵袭能力[25],说明NTN4在BC中亦是抑癌因子。由此可见,在同种肿瘤的发展过程中,NTN4可能发挥不同的调控作用。
在乳腺癌细胞中Netrins依赖性受体对肿瘤细胞的凋亡也具有调控作用。DCC的第5个纤连蛋白Ⅲ型结构域DCC-5Fbn,可通过NTN1触发受体多聚化的能力,进而影响NTN1的活性和抗凋亡作用。FITA-MANT等[26]将 DCC-5Fbn 添加到人乳腺癌T47D和SKBR7细胞中发现细胞无显著变化;而将DCC-5Fbn注射到BALB/C小鼠中,小鼠显示出肺转移的肿瘤显著减少,提示NTN1可自分泌表达,当抑制DCC/NTN1或UNC5H2/NTN1的多聚化能力后,赋予了转移性BC肿瘤细胞存活的选择性优势。总体来说,未结合Netrins配体的促凋亡活性受体已被认为是一种消除肿瘤细胞的机制,失去其依赖性受体的促凋亡活性将有利于肿瘤细胞的存活,并且可以通过至少2种机制来实现:⑴降低受体水平;⑵抑制下游促凋亡信号通路的激活。以上研究表明,Netrins及其受体在BC的发生和发展过程中起协同作用。
3.4 Netrins与胃癌
胃癌(gastric cancer,GC)是消化系统最高发的癌症之一,近年来学者们不断探索标志物对胃癌诊断及预后的价值。CHEN等[27]研究显示,在GC组织中NTN1蛋白的表达与Ki-67、浸润深度、淋巴转移和远处转移呈正相关。进一步敲低GC细胞中NTN1的表达,发现GC细胞的侵袭和迁移能力降低,裸鼠成瘤能力削弱[28]。此外,LV等[29]发现在GC患者的肿瘤组织和血清中NTN4也呈高表达,且与病理分期的严重程度呈正相关,与患者的OS呈负相关。因此,NTN1和NTN4可能是GC患者的肿瘤标志物。
Netrins受体在GC不同时期的表达水平也具有明显差异性。在早期胃癌中,DCC和UNC5C基因均发生异常的甲基化现象导致自身的基因转录水平升高,而在晚期胃癌中,这种现象又逐渐消失,并且发现NTN1水平会进一步升高[30-31]。研究还发现,NTN1和NTN4可通过结合其受体NEO1,刺激Jak/Stat、PI3K/AKT或ERK/MAPK等信号通路的激活,进而促进体内外GC细胞的生长和转移[29,32]。以上结果提示,NTN1和NTN4在GC发生和发展中作为一种新型肿瘤诱导剂发挥作用。此外,Netrins通过其受体NEO1调节GC细胞增殖和侵袭的关键机制还为GC的治疗提供了新的切入点。
3.5 Netrins与胰腺癌
胰腺癌(pancreatic adenocarcinoma,PAAD)是消化系统常见的肿瘤,恶性程度极高。研究显示在早期(Ⅰ/Ⅱ期)胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)患者的肿瘤组织中,NTN1低表达且与低分化PDAC患者的预后不良呈正相关[33]。在胰腺癌细胞系PANC-1和CFPAC-1中过表达NTN1后,Mdm2表达水平上调,p53蛋白泛素化增强,表达量下降,导致p21、p27表达升高,Cyclin D1表达下降,促进了PAAD细胞的体外增殖[34]。提示NTN1可作为PAAD的肿瘤标志物,并通过调节Mdm2和p53信号通路,促进PAAD的发生、发展。
Netrins在泛癌的生信研究中,PAAD患者血液中NTN4的表达较高而NTNG2的表达较低,且NTN4高表达和NTNG2低表达的PAAD患者预后均较差[5]。随后,FRANCESCONE等[35]通过实验证实,NTNG1在PDAC组织中呈高表达,其表达水平与生存时间呈负相关。敲低NTNG1的表达,发现裸鼠体内的成瘤能力减弱。此外,过表达NTNG1还可增强低营养条件下PDAC细胞的存活能力,减少了自然杀伤细胞诱导的死亡;同时激活成纤维细胞中AKT/4E-BP1和p38/FRA1信号通路,从而产生免疫抑制作用,进而促进PDAC 的进展[35]。以上研究提示,Netrins可作为PAAD新的治疗靶标,具有潜在的临床应用价值。
3.6 Netrins与结直肠癌
近年来,学者们不断探索标志物在结直肠癌(colorectal cancer,CRC)患者复发和预后中的价值。LI等[36]在CRC受试者的血清中发现,NTN1呈高表达且NTN1高表达的晚期腺瘤患者进展为CRC的风险更高。此外,EVENO等[37]研究证实,NTN4过表达降低了结直肠肺转移及其相关的淋巴结受累的风险,减少腹水的形成及术后的复发和转移概率。该研究结果表明,NTN4可能是CRC及主要部位转移瘤的治疗靶标,具有临床应用潜力。随后,SHO等[38]通过生信分析发现,在CRC患者中NTNG1存在高甲基化突变的现象,且其EGF结构域的EGF-3(V3)位点处的突变频率最频繁。与未突变组相比,NTNG1突变组的患者存在高复发风险且预后更差。因此,在CRC中检测Netrins的表达水平有助于评估CRC患者的预后。
与GC类似,UNC5C的失活主要发生在结直肠癌形成的早期阶段,而DCC缺失则主要发生在CRC晚期[39]。在DCC缺陷型CRC细胞中,NTN1激活了cAMP/PKA和Rho/ROK信号通路,细胞的侵袭能力增强;而在野生型(DCC过表达)CRC细胞中,NTN1与DCC相互作用,细胞凋亡数量增多,侵袭和迁移能力减弱[40]。其机制可能是DCC主要调控细胞周期和凋亡途径相关基因的表达,而Netrins则对与细胞表面信号传导和细胞黏附、运动和细胞外基质相关的基因表现出更大的选择性影响。此外,NTN1与DCC和UNC5B直接结合,还可激活Hippo信号通路促进转录共激活因子(yes-associated protein,YAP)去磷酸化,导致YAP泛素化和降解减少,细胞核中YAP蓄积增加,进而促进CRC细胞的增殖和迁移[41]。上述研究从不同的角度提示,Netrins及其受体相互作用,调控CRC细胞的增殖和凋亡。
3.7 Netrins与肺癌
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最主要的病理类型。DELLOYE-BOURGEOIS等[42]对 92例NSCLC(45例腺癌和47例鳞状细胞癌)患者的临床样本进行检测发现,NTN1在这两种肺癌中均呈高表达,且NTN1表达水平与NSCLC细胞的浸润和转移能力呈正相关,而与预后呈负相关。此外,在小细胞肺癌(small cell lung cancer,SCLC)组织中还检测到NTN3呈高表达;敲低NTN3的表达可减弱裸鼠的成瘤能力[12]。HAO等[5]基于数据挖掘和深层生物学信息分析发现,NTNG1在肺腺癌和肺鳞状细胞癌中差异表达,肺腺癌中NTNG1的低表达和肺鳞状细胞癌中NTNG1的高表达均与较差的生存率相关,表明NTNG1也参与了肺癌的发生发展过程。随后,有研究[43-44]证实,NTN1过表达可诱导NSCLC细胞EMT的发生,细胞侵袭、迁移及血管生成拟态(VM)的能力增强;而敲低NTN1则达到相反的效果。此外,NTN1还可促进PI3K/AKT和ERK信号通路的激活。用拮抗剂LY294002或U0126阻断上述信号通路后,能逆转NTN1对肺癌细胞上述恶性表型的促进作用。总的来说,目前的研究结果突出了Netrins在缺氧条件下在NSCLC发展中的新作用,并为使用Netrins作为治疗靶点提供了进一步的证据,有望作为一种针对NSCLC治疗有前途的新药物。
3.8 Netrins与其他肿瘤
除了以上肿瘤外,还在膀胱癌、前列腺癌、黑色素瘤、肝癌和肾细胞癌的肿瘤细胞中发现NTN1呈高表达而UNC5B呈低表达[45-48]。在黑色素瘤细胞中敲低NTN1后诱导了UNC5B的表达增加,细胞的迁移和侵袭能力减弱[48]。在肝癌细胞中,NTN1与UNC5B结合可诱导YAP信号通路的激活,从而介导EMT的发生,进而促进肝癌细胞的侵袭和肿瘤血管的生成[47,49]。此外,在缺氧条件下敲低前列腺癌细胞中NTN1的表达后,抑制YAP的激活,细胞侵袭和迁移能力减弱,阻碍了EMT的发生[50]。但是,目前NTN4在肿瘤发生、发展中的作用仍然存在争议。如也有研究发现,在宫颈癌组织中NTN4呈低表达,敲低NTN4表达后宫颈癌细胞的增殖和迁移能力增强[51-52]。然而,在成纤维肉瘤细胞中NTN4呈高表达,且体内外研究结果表明NTN4有抑制成纤维肉瘤细胞增殖和促进迁移、侵袭的作用,且此作用可能受NEO1的介导[53]。综上所述,NTN4在调节肿瘤细胞恶性生长中的作用值得进一步研究。
4 小结与展望
Netrins是目前研究的一种热点蛋白,该蛋白能在神经迁移导向中发挥重要作用。作为一种重要的肿瘤参与基因,Netrins在很多恶性肿瘤细胞中均呈高表达,有望作为肿瘤诊断、治疗监测及预后判断标志物。分子靶向治疗是近年随着基础研究不断进展而发展起来的治疗领域。Netrins在肿瘤发生、发展中起关键调节作用,尤其是抗凋亡和促血管生成作用,这使Netrins可能成为肿瘤治疗的一个重要靶点。进一步研究Netrins在肿瘤细胞中的调控机制,发现Netrins可与其受体结合并通过相关信号传导通路调控肿瘤的增殖、迁移能力及肿瘤血管的形成,为研制抗肿瘤新药提供了可能性。
综上,Netrins可能是一种新的肿瘤标志物,并可能成为肿瘤治疗有前景的新靶点,但是由于Netrins调控机制和恶性肿瘤发生、发展的复杂性,仍需要进一步的基础和临床研究来阐明Netrins在恶性肿瘤中的作用和机制。相信随着对Netrins的深入研究,未来将进一步明确其作用机制,有望为肿瘤生物治疗提供新的策略。

