丙酮酸对Bacillomycin D合成的影响及调控
马文杰,钟 裔,陆兆新,张 平,陈诗蕾,秦 淼,吕凤霞,赵海珍,别小妹
(南京农业大学食品科技学院,江苏南京 210095)
Bacillomycin D是芽孢杆菌中产生的一类环状抗菌脂肽[1],属于Iturin家族[2],由一条含有14~17个碳原子的β-氨基脂肪酸链和一条七肽链缩合而成[3]。Bacillomycin D对黄曲霉菌、赭曲霉菌、念珠菌、禾木科镰刀菌等真菌的生长具有一定抑制作用[4-7],对肺泡腺癌、肾癌、结肠癌及胃癌等癌细胞有选择性毒性,能够诱导细胞凋亡[8-11]。此外,作为一种天然抗菌脂肽,Bacillomycin D具备安全、高效、易降解等多重优势[12],有望成为化学抑菌剂的良好替代品,在粮食贮藏、食品安全[13]、临床治疗、生物防治[14]方面具有极高的开发价值和应用前景。但天然抗菌脂肽的生产效率问题一直是制约其大规模生产和应用的关键因素,如何提高微生物源抗菌脂肽产率也是研究人员致力克服的一大问题。
在微生物发酵过程中,培养基优化是提高次级代谢产物产量的重要手段。目前对Bacillomycin D的培养基优化主要集中在碳源、氮源以及金属离子等三个方面。Qian等[15]发现以30 g/L菊糖代替葡萄糖作为碳源可使Bacillomycin D产量达到252.43 mg/L,L-gln能显著增强B.amyloliquefaciensfmbJ合成Bacillomycin D的能力,可将产量提高至199.72 mg/L[16],外源添加7 g/L L-乳酸钙可使Bacillomycin D产量达到322.88 mg/L[17]。何婷婷[18]采用包含蔗糖、谷氨酸钠、玉米浆、KH2PO4和MgSO4·7H2O等成分的培养基将Bacillomycin D的产量提升到了原始Landy培养基的2倍。李伟等[19]使用麦芽糖浆、尿素、玉米浆、MgSO4·7H2O、(NH4)2SO4、K2HPO4和MnSO4·H2O等组成的优化培养基将枯草芽孢杆菌M364的Bacillomycin D产量提高了50%。除此之外,在发酵培养基中添加相应的前体物质或前体合成所需底物是促进次级代谢产物合成最直接的方法,这一理论已经在一些脂肽的研究中得到了证实[20],但在Bacillomycin D的发酵生产中还没有相关尝试。
此外,通过基因工程的方法提高前体利用效率或者减弱前体竞争途径也是促进抗菌脂肽高效合成的重要方法。在Surfactin的生产中,通过基因编辑将pps和pks等脂肪酸前体的竞争途径失活,同时将外源硫酯酶(TE)过表达,间接地增加Surfactin合成反应中的脂肪酸前体供应,可以使得Surfactin的产量提升至对照组的6.4倍[21]。通过设计支链脂肪酸生物合成途径,增加前体支链脂肪酸的供应,也可以使得Surfactin产量有数倍乃至数十倍的提高[22]。由此可见,通过探究脂肽的合成途径,从基因水平上增加前体供应,构建基因工程菌将是进一步缩小成本、提高产量的潜在方向。
Bacillomycin D是在聚酮合酶-非核糖体肽合酶(Polyketide synthase-nonribosomal peptide synthase,PKS-NRPS)共同催化下合成的,以酰基辅酶A以及Asn、Tyr、Pro、Glu、Ser和 Thr等六种氨基酸为直接前体[23]。其中酰基辅酶A以乙酰辅酶A作为底物合成,理论上提高乙酰辅酶A的胞内含量可以促进Bacillomycin D合成前体供应,但乙酰辅酶A价格昂贵,直接在培养基中添加乙酰辅酶A即使能够提高Bacillomycin D的产量,也会导致其生产成本成倍增加,因而促进乙酰辅酶A的上游合成是提高其胞内含量的重要途径。丙酮酸是糖酵解反应的最终底物,是胞内乙酰辅酶A的主要来源之一,是菌体维持各项生理活动的重要中间物质[24],本文分别从外源添加和基因工程两方面增加丙酮酸或乙酰辅酶A的供应,期望能够促进Bacillomycin D的合成,从而找到提高Bacillomycin D产量的新方法。
1 材料与方法
1.1 材料与仪器
B.amyloliquefaciensfmbJ(菌种保藏号为CGMCC No.0943)、E.coliJM109、Aspergillus flavus南京农业大学酶工程实验室;E.coliJM110感受态细胞 北京金沙生物科技有限公司;丙酮酸 上海麦克林生化科技有限公司;细菌总RNA提取试剂盒TransZolTMUP Plus RNA Kit 北京全式金生物技术有限公司;反转录试剂盒HiScript III RT SuperMix for qPCR(+gDNA wiper)、Taq Pro Universal SYBR qPCR Master Mix、one step cloning kit 南京诺唯赞生物科技股份有限公司;LB培养基:胰蛋白胨 10 g/L,酵母提取物 5 g/L,NaCl 10 g/L,pH 调至 7.0~7.2,固体培养基每100 mL另外添加2 g琼脂;种子培养基:蛋白胨10 g/L,牛肉浸膏3 g/L,NaCl 5 g/L,pH调至7.0~7.2;基础 Landy培养基(发酵培养基):葡萄糖20 g/L,酵母浸膏 1 g/L,L-谷氨酸 5 g/L,KCl 0.5 g/L,KH2PO40.5 g/L,MgSO4·7H2O 0.5 g/L,CuSO4·5H2O 0.15 mg/L,FeSO4·7H2O 1.2 mg/L,MnSO45 mg/L,pH调至7.0。
PowPacTM HC164-5052高电流电泳仪、Micro-Pulser微生物电穿孔仪 美国Bio-Rad生命医学产品有限公司;ABI quant studio 5荧光定量PCR仪美国ABI公司;PTC-100TM PCR仪 MJ Research公司;Ultimate3000高效液相分析系统 美国Dionex公司;UV-2450紫外分光光度计、C18反相色谱柱日本岛津公司。
1.2 实验方法
1.2.1 丙酮酸外源添加 按照终浓度(体积分数)0.05%、0.075%、0.10%、0.15%、0.20%、0.25%、0.50%、0.75%、1.00%将丙酮酸添加到灭菌的发酵培养基中,用除菌的4 mol/L NaOH调整培养基pH至7.0左右。
1.2.2 菌株发酵 将-20 ℃保存的B.amyloliquefaciensfmbJ在LB固体培养基上划线,置于37 ℃恒温培养箱静置培养12~16 h,挑单菌落于LB培养基中37 ℃,180 r/min过夜活化。将活化后的菌液按照50倍稀释度接入种子培养基,37 ℃,180 r/min培养至OD600达到0.8~1.0。按照5%的接种量接种到各组发酵培养基中,33 ℃,180 r/min发酵120 h。
诱导型过表达菌株发酵的具体操作与上述基本相同,但菌株活化、发酵所用培养基均添加终浓度5 μg/mL的氯霉素,以保证发酵过程中无杂菌污染。在发酵液OD600达到0.8左右时向发酵液中添加IPTG溶液,设置IPTG终浓度梯度为0、50、100和200 mg/L。
1.2.3 Bacillomycin D提取及检测 发酵结束后,将发酵液转移至离心管中,8000 r/min离心20 min,收集上清液,6 mol/L HCl调整pH至2.0,4 ℃静置过夜。重复上述离心步骤,弃上清,收集沉淀于离心管底,按照100:2的比例加入甲醇使沉淀重悬,2 mol/L NaOH调整重悬液pH至7.0,置于超声清洗器中超声处理50 min,再次离心取上清获得Bacillomycin D粗提液。粗提液过直径0.22 μm的滤膜,通过HPLC对Bacillomycin D进行定量检测,检测波长为207 nm,检测条件见表1,其中流动相A为含1‰三氟乙酸的乙腈,流动相B为含1‰三氟乙酸的水。参照钱时权[17]报道的标准曲线进行Bacillomycin D产量计算:y=7.6396x-2.3576,R2=0.9999,x表示Bacillomycin D 浓度,mg/L;y 表示峰面积,mAU·h。
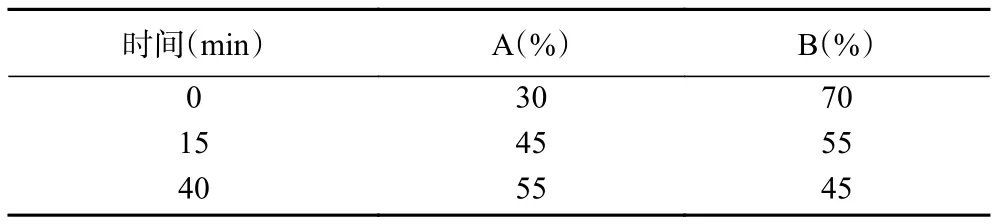
表1 HPLC检测条件Table 1 Detection conditions of HPLC
1.2.4 RT-PCR 分别取丙酮酸调控下fmbJ发酵24、36、48和60 h的菌液样品,采用TransZolTMUPPlus RNA Kit提取fmbJ的总RNA,具体步骤参照试剂盒说明书。然后按照HiScript III RT SuperMix for qPCR (+gDNA wiper)试剂盒说明书获取 cDNA。反应结束后采用NanoDrop 2000测定所得cDNA浓度,置于-20 ℃冰箱备用。
通过RT-PCR检测Bacillomycin D合成基因bamA、bamB、bamC、bamD和TE,调控因子编码基因comA、comP、comQ、degU、degQ、spo0A、codY、rapC、rapI、sigH、sigM、sigV、abrB,以及编码丙酮酸和乙酰辅酶A合成相关酶的pyk和acs基因的表达量的变化。反应体系为上下游引物以及cDNA各 1 μL,Taq Pro Universal SYBR qPCR Master Mix 10 μL,并用 ddH2O 补充至 20 μL,将配制完成的反应液转移至RT-PCR仪上进行两步法扩增,反应程序参照文献[25]。以16S rRNA为内参基因,用2-ΔΔCt法分析目的基因的表达。引物序列如表2。

表2 RT-PCR所需引物Table 2 Oligonucleotide primers for RT-PCR
1.2.5acs、pyk基因过表达菌株构建
1.2.5.1 引物设计 根据B.amyloliquefaciensfmbJ全基因组测序结果,设计过表达载体构建所需引物序列如表3。
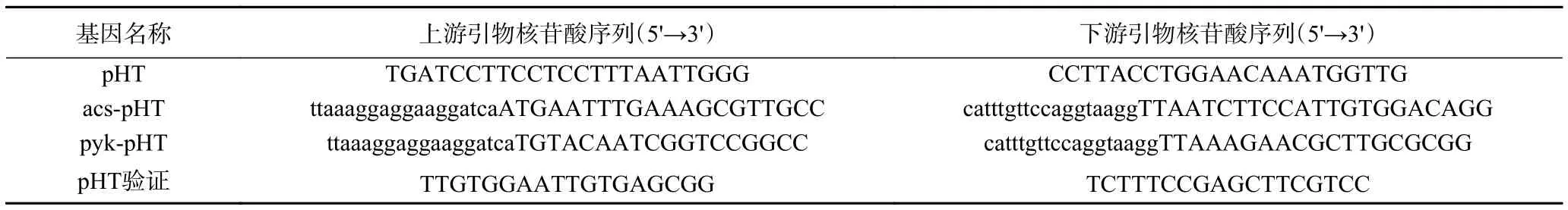
表3 过表达载体构建所需引物Table 3 Primers required for the construction of overexpression vectors
1.2.5.2acs、pyk过表达载体构建 采用无缝克隆的方法构建过表达载体。以pHT43质粒为模板,以pHT-F/R为上下游引物,通过PCR反应扩增载体框架pHT01。同时以B.amyloliquefaciensfmbJ基因组为模板,分别以acs-pHT-F/R、pyk-pHT-F/R为上下游引物,扩增得到目的基因acs、pyk,所得PCR反应产物经1%的琼脂糖凝胶电泳及GelRed染色检测,对条带大小正确的片段进行切胶回收。
在one step cloning kit的作用下,将pHT01线性载体框架分别与acs、pyk片段连接起来,并转化至E.coliJM109感受态细胞,挑取阳性转化子转接至含有氨苄青霉素(100 mg/mL)的LB液体培养基中,37 ℃,180 r/min 培养 12~16 h,按照质粒提取试剂盒说明书所述方法提取质粒pHT01-acs、pHT01-pyk。将验证正确的pHT01-acs、pHT01-pyk质粒继续转化至E.coliJM110感受态,挑取阳性转化子提取获得去甲基化的过表达质粒。质粒构建示意图如图1。
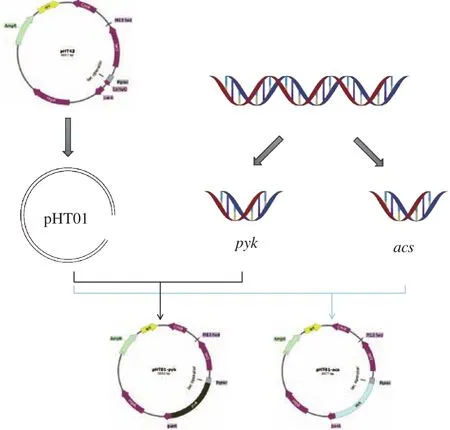
图1 pHT01-pyk和pHT01-acs的质粒构建示意图Fig.1 Schematic diagram of plasmid construction of pHT01-pyk and pHT01-acs
1.2.5.3acs、pyk过表达菌株构建 首先制备B.amyloliquefaciensfmbJ感受态,并通过电转化的方法将去甲基化的pHT01-acs、pHT01-pyk转入B.amyloliquefaciensfmbJ中,具体方法参照文献[25]所述。转化菌株涂布于含有氯霉素(5 μg/mL)的LB固体平板上,37 ℃倒置培养24 h。挑取长出的单菌落进行菌落PCR验证和测序验证,验证正确的转化子即为acs、pyk的诱导型过表达菌株,分别命名为fmbJ-acs、fmbJ-pyk。
1.3 数据处理
本文所涉实验重复3次,所有图形采用Graph-Pad Prism 9.0绘制,并采用SPSS 19进行数据处理。
2 结果与分析
2.1 丙酮酸对Bacillomycin D产量的影响
以B.amyloliquefaciensfmbJ菌株在基础Landy培养基中的发酵产物作为对照,分别测定了不同浓度丙酮酸对Bacillomycin D产量的影响,结果如图2。与对照组相比,当丙酮酸添加浓度为0.05%时,Bacillomycin D产量没有显著变化(P>0.05);在添加浓度为0.075%时,Bacillomycin D产量极显著提高(P<0.001),达到 485.85 mg/L,约为对照组(344.45 mg/L)的1.41倍;在添加浓度为0.10%时,处理组产量显著提高(P<0.01),达到 429.51 mg/L,为对照组产量的1.25倍,但显著低于0.075%丙酮酸处理组(P<0.05);当添加浓度增加至0.15%~0.50%,处理组产量与对照组差异不显著(P>0.05);当添加浓度达到0.75%时,Bacillomycin D 产量显著降低(P<0.001),而当丙酮酸添加浓度继续升高至1.00%,发酵产物的脂肽粗提液中基本检测不到Bacillomycin D,且各平行处理组间情况一致。由此可见,较低浓度的丙酮酸能够促进Bacillomycin D的合成,而高浓度的丙酮酸会抑制Bacillomycin D的合成。
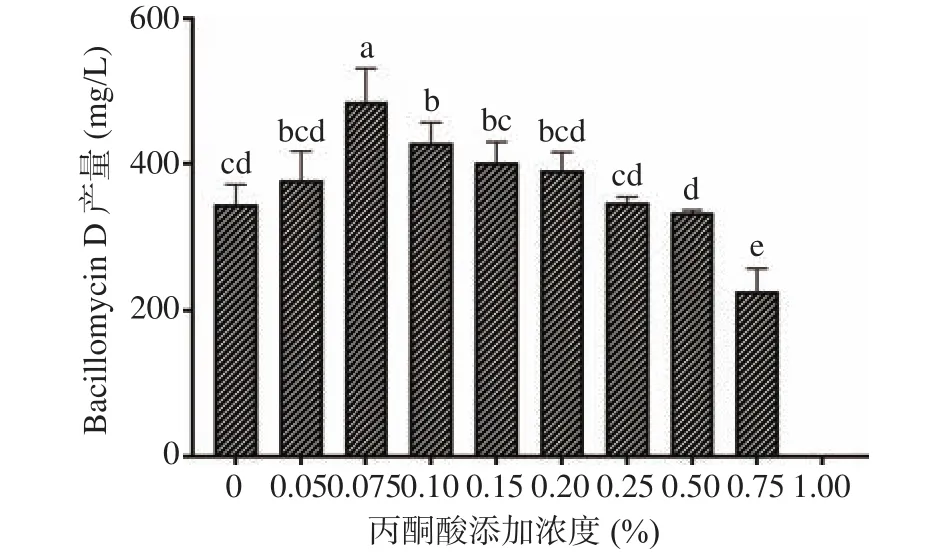
图2 丙酮酸对Bacillomycin D产量的影响Fig.2 Effect of pyruvate on the yield of Bacillomycin D
2.2 丙酮酸对Bacillomycin D合成基因表达的影响
结合上述结果,丙酮酸外源添加浓度为0.075%时,最大程度提高了Bacillomycin D的产量。为了进一步验证丙酮酸对Bacillomycin D合成的促进作用,本研究通过RT-PCR,分析了此条件下丙酮酸对Bacillomycin D合成基因表达的影响。
Bacillomycin D的合成操纵子包括4个ORF,即bamD、bamA、bamB和bamC[26],分别编码BamD、BamA、BamB和BamC四个亚基。其中,TE结构域(由TE基因编码)位于BamC的C末端,主要负责Bacillomycin D的环化和释放。本研究主要针对上述5个基因的表达量进行了检测,结果如图3。在发酵初期即发酵24~36 h,丙酮酸显著上调了bamD、bamA、bamB和bamC的表达(P<0.05),最大上调倍数分别可达对照组菌株的5.80、4.19、7.13和5.72倍。而在发酵 48和 60 h,bamD、bamA、bamB和bamC的表达均较对照组出现不同程度的下调。但TE的表达在发酵24~60 h内均呈现显著上调(P<0.05),上调倍数最大可达2.91倍。
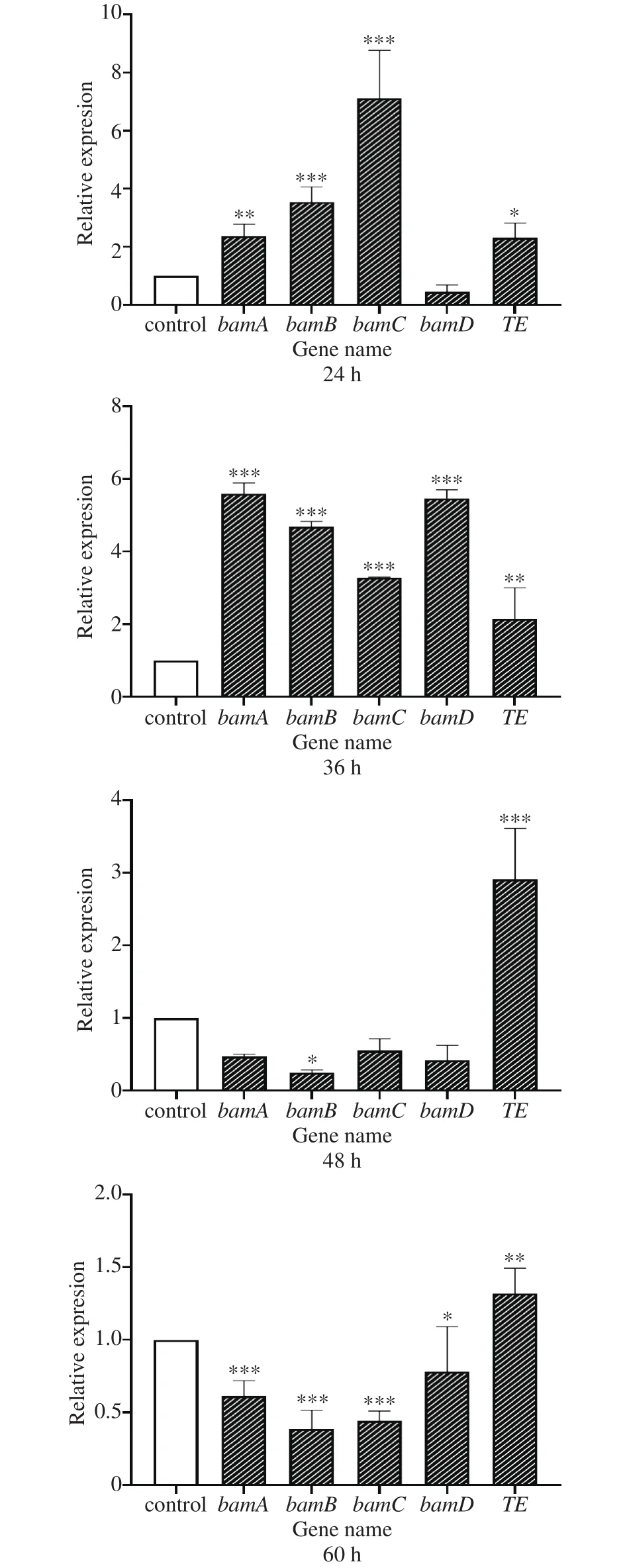
图3 丙酮酸对Bacillomycin D合成基因表达的影响Fig.3 Effects of pyruvate on the expression of Bacillomycin D synthetic gene
由此可见,丙酮酸可以在加速Bacillomycin D的合成装配,促进其环化及释放,并最终促进Bacillomycin D产量的提高。但这种促进作用主要体现在B.amyloliquefaciensfmbJ发酵前期,随着发酵时间的延长,丙酮酸逐渐被消耗殆尽,促进作用逐渐减弱,Bacillomycin D的合成趋于平稳。
2.3 丙酮酸对B.amyloliquefaciens fmbJ调控因子表达的影响
研究表明,部分调控因子对Bacillomycin D的合成具有明显的调节作用。因此,本研究继续检测了丙酮酸调控下,B.amyloliquefaciensfmbJ部分调控因子表达量的变化。所得结果如图4所示:在发酵24 h时,丙酮酸对调控因子表达的影响较显著,comA、comP、comQ、degU、degQ和spo0A的表达量显著(P<0.01 或P<0.001)) 上调,上调倍数分别可达对照组的 24.57、25.30、18.33、2.56、8.95和 7.14倍。在发酵36 h时,大多数调控因子的表达均有不同程度的下调,其中包括负调控因子abrB的表达显著下调(P<0.001),仅为对照组的0.47倍;当发酵时间达到48 h,degU、spo0A、rapI和sigV基因显著上调(P<0.05),上调倍数分别可达到对照组的2.18、1.83、5.83和2.25倍,与此同时,rapC的表达显著下调(P<0.05),仅能达到对照组的 0.16倍;在发酵60 h时,degU和sigH的表达显著上调(P<0.001),rapC的表达仍显著下调(P<0.05),并且自发酵48 h起,各调控因子表达开始与对照组趋近,这也与上述所得随着发酵时间延长,丙酮酸的调控效果逐渐减弱的结论是相符的。但值得注意的是,在发酵36 h时,多个调控因子均较对照组显著下调,这可能与丙酮酸的外源添加使得Bacillomycin D合成反应提前有关。有文献报道,Bacillomycin D产量在发酵36~48 h后才开始快速增加[17,27],但在本研究中,在fmbJ菌株发酵24 h时,多个调控因子以及Bacillomycin D合成基因的显著上调表明fmbJ在这一阶段的Bacillomycin D合成能力显著增强,这从基因水平上证明了丙酮酸调控下fmbJ中Bacillomycin D合成反应提前,而这所带来的营养物质消耗和菌体渗透压变化会使得一些转录调控因子表达量在达到一定水平后出现显著下降[28],从而导致图4中36 h所示结果,但随着Bacillomycin D的继续合成,在胞内应激反应调节下,各调控因子的表达会逐渐恢复正常,这也与本研究所得结果是一致的。
此外,由图4可见,在发酵24和36 h内,丙酮酸可以上调乙酰辅酶A合成酶的表达,这为胞内乙酰辅酶A含量的增加提供了积极条件。
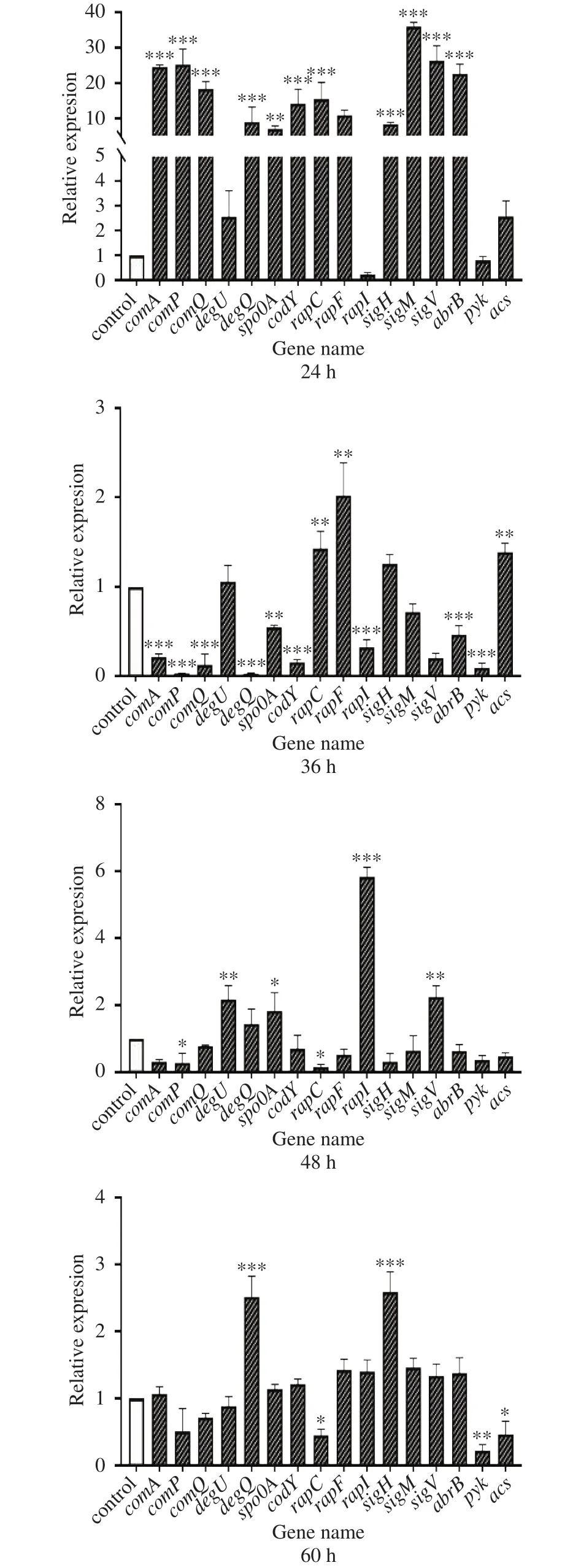
图4 丙酮酸对调控因子表达的影响Fig.4 Effects of pyruvate on the expression of regulatory factors
2.4 acs、pyk基因过表达载体构建
由以上结果可见,在发酵培养基中添加丙酮酸可以显著提高Bacillomycin D的产量,且丙酮酸的添加也在基因水平上促进了乙酰辅酶A合成酶的表达。然而利用基因工程的方法,直接促进丙酮酸和乙酰辅酶A的合成能否实现相同的效果仍有待进一步研究。因此,本研究分别构建了pyk和acs基因的诱导型过表达菌株。
首先以B.amyloliquefaciensfmbJ基因组为模板,扩增得到acs、pyk的基因片段,产物长度应分别为1719和1737 bp;同时以pHT43质粒为模板,扩增得到pHT线性载体,产物长度应为7858 bp。扩增产物的琼脂糖凝胶电泳结果如图5A,acs、pyk以及pHT线性载体产物条带大小与预期相符。经无缝克隆连接后,将连接产物转入E.coliJM109感受态细胞中,挑取PCR验证阳性的转化子提取质粒后继续转入E.coliJM110感受态细胞中,此时提取得到的质粒已完成去甲基化,将其通过电转化的方法转入B.amyloliquefaciensfmbJ中,平板上长出的单菌落首先通过 PCR验证,结果如图5B,pHT01-acs、pHT01-pyk阳性转化子PCR产物的理论值应分别为1891和1909 bp,琼脂糖凝胶电泳检测所得结果与之基本相符。同时,阳性转化子中过表达质粒上插入片段的测序序列也与预期完全一致,此时获得的阳性转化子即为诱导型过表达菌株B.amyloliquefaciensfmbJ-acs和 fmbJ-pyk。

图5 B.amyloliquefaciens fmbJ-acs和fmbJ-pyk的构建及验证Fig.5 Construction and verification of B.amyloliquefaciens fmbJ-acs and fmbJ-pyk
2.5 pyk和acs过表达对Bacillomycin D产量的影响
理论上,IPTG添加量越高,基因过表达程度越高。如图6可见,在fmbJ-pyk的发酵实验中,添加了50 mg/L IPTG的处理组Bacillomycin D产量为207.88 mg/L,较同批次对照组产量(155.02 mg/L)极显著提高(P<0.001),为对照组的1.34倍。但随着IPTG添加量的继续增加这种提高作用反而逐渐减弱,在fmbJ-acs的发酵实验中也出现了类似的情况:添加了50 mg/L IPTG的处理组Bacillomycin D产量为 200.42 mg/L,为对照组(172.84 mg/L)的 1.16倍(P<0.01),之后随着IPTG添加量的逐渐提高,产量开始降低,当IPTG添加量为200 mg/L时,fmbJ-acs的Bacillomycin D产量甚至显著低于对照组(P<0.05)。
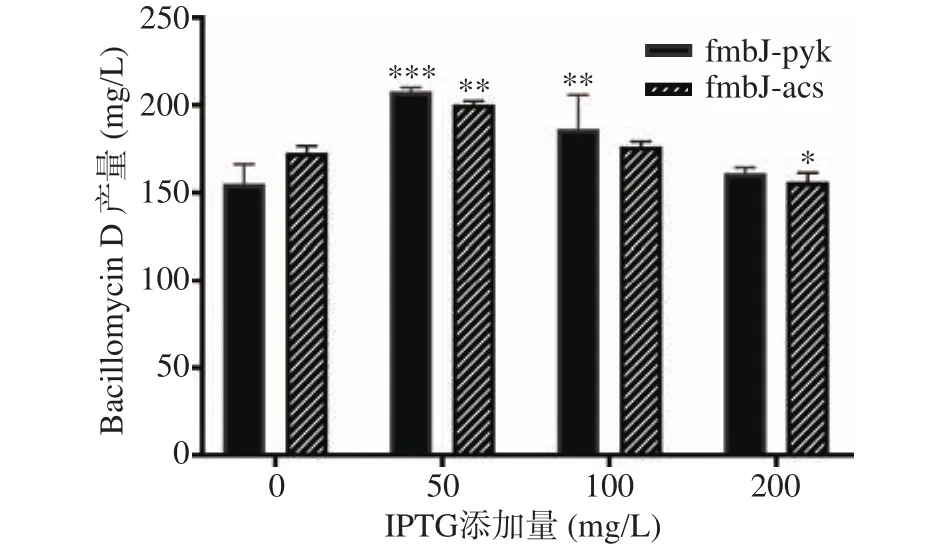
图6 pyk和acs基因过表达对Bacillomycin D产量的影响Fig.6 Effects of pyk and acs overexpression on Bacillomycin D yield
结合上述结果,当丙酮酸激酶过表达达到一定水平后,Bacillomycin D的产量不会随其表达量的提高而提高,反而会逐渐恢复到与对照组相似的产量。为了进一步探究其对Bacillomycin D合成的影响,本研究检测了丙酮酸对fmbJ-pyk的Bacillomycin D产量的影响,结果如图7所示:在0.075%的丙酮酸调控下,50 mg/L IPTG诱导的fmbJ-pyk处理组Bacillomycin D产量较对照组提高了1.1倍,低于50 mg/L IPTG诱导的fmbJ-pyk的产量。由此可见,在基础Landy培养基条件下,外源添加丙酮酸、过表达丙酮酸激酶或者乙酰辅酶A合成酶均可以促进Bacillomycin D的合成,但这种促进作用具有一定的浓度依赖性。
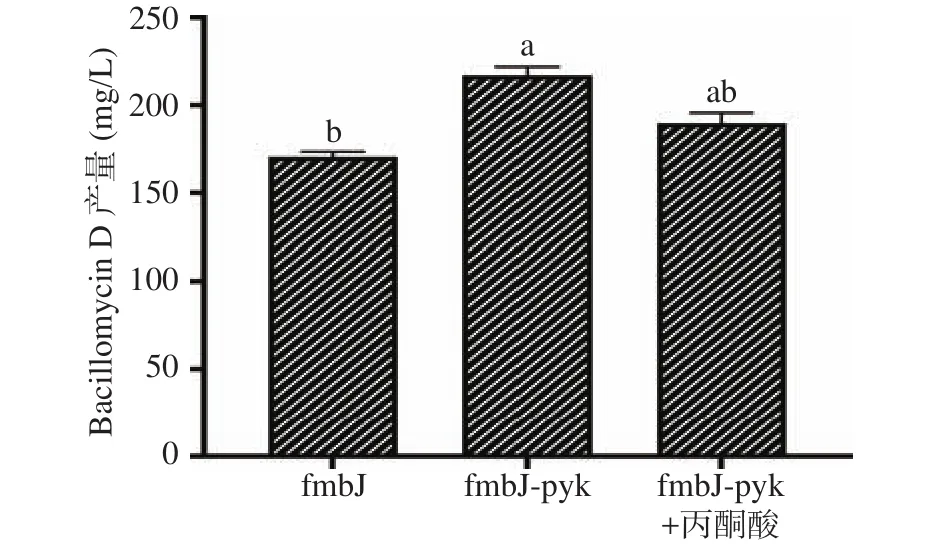
图7 丙酮酸对fmbJ-pyk的Bacillomycin D产量的影响Fig.7 Effect of pyruvate regulation on Bacillomycin D yield of fmbJ-pyk
3 讨论与结论
本研究首先通过外源添加丙酮酸,研究了增加胞内丙酮酸供应对Bacillomycin D合成的影响。结果发现在终浓度0.075%的丙酮酸调控下,B.amyloliquefaciensfmbJ的Bacillomycin D产量可达到485.85 mg/L,较对照组显著提高41%,是目前在基础Landy培养基中通过单体调控得到的较高产量,Bacillomycin D合成基因的上调也从基因水平上证实了这一提高作用。通过对丙酮酸代谢通路的分析,可以发现丙酮酸是乙酰辅酶A的重要来源之一,提高胞内丙酮酸含量可以促进其转化为乙酰辅酶A,进而为Bacillomycin D的脂肪酸链合成提供前体物质;同时也可以加速三羧酸循环,促进氨基酸合成和胞内能源物质的产生,从而促进Bacillomycin D的合成[29]。此外,正如本研究所报道的,在发酵24 h时,comA、comP、degQ、degU、spo0A、sigH、sigM的表达显著上调,这些调控因子涉及生物被膜形成、芽孢形成、DNA转录、胞内蛋白分泌等多种生理过程[30],其上调均可对Bacillomycin D的合成发挥正调控作用[31-32];CodY是一个全局调控因子,其对Bacillomycin D合成的促进作用具有一定的浓度依赖性,在一定程度的积累也有利于Bacillomycin D的合成[32];而rapC的表达呈现下调趋势,已知敲除rapC会促进Bacillomycin D的合成,可见其下调有利于Bacillomycin D的合成[33];Spo0A对全局调控因子AbrB也有一定抑制作用[34],AbrB能够抑制细菌中100多种基因的表达,且在一些Bacillomycin D产量降低的处理组也检测到了abrB表达量的上调[35],因而其下调极有可能对Bacillomycin D产量提高起到积极作用。综上所述,在发酵前期丙酮酸上调了正调控因子的表达,使得Bacillomycin D的合成反应提前,而在发酵的后期,丙酮酸可以上调关键正调控因子的表达,同时下调负调控因子的表达,维持Bacillomycin D的持续合成,从而使得Bacillomycin D合成周期变长,并最终提高Bacillomycin D的产量。综合上述结果,可得到如图8所示调控图。
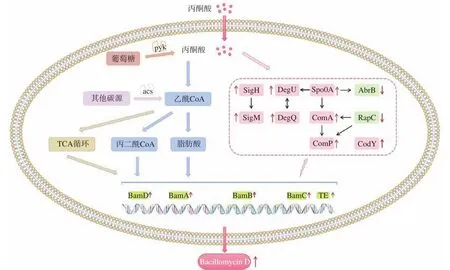
图8 丙酮酸对Bacillomycin D合成调控机制的探索Fig.8 Exploration of the regulatory mechanism of pyruvate on Bacillomycin D synthesis
丙酮酸激酶催化糖酵解过程中丙酮酸和ATP的生成,在调节碳通量分布中起关键的作用。通过过表达丙酮酸激酶能够促进葡萄糖的利用和胞内ATP、NADH的产生[36-37],从而起到与外源添加丙酮酸相似的作用。本研究也证实了这一点:在一定程度上过表达丙酮酸激酶可以促进Bacillomycin D的产量提高为对照组的1.34倍。此外,除了葡萄糖等糖类物质,乙酸、乙醇等其他碳源在乙酰辅酶A合成酶的催化下也可转化为乙酰辅酶A。已有研究报道,过表达乙酰辅酶A合成酶能够提高胞内乙酰辅酶A的含量[38]。这与本文的结果是一致的,本文构建的乙酰辅酶A合成酶过表达菌株fmbJ-acs的Bacillomycin D产量较野生菌也提高了16%。
这种直接从基因水平上促进Bacillomycin D合成的方法在降低生产成本方面具有重要意义。但也可以看到,丙酮酸激酶和乙酰辅酶A合成酶过表达对Bacillomycin D的产量提高具有一定的浓度依赖性。然而对于丙酮酸激酶而言,如果能够在其过表达的同时,实现丙酮酸脱氢酶、苹果酸脱氢酶等其他丙酮酸代谢酶的过表达,可以促进丙酮酸的进一步转化[39-40],从而有可能促进Bacillomycin D产量的进一步提高。而对于乙酰辅酶A合成酶,这与本文选择的基础培养基类型是有关系的。因为基础培养基中营养物质有限,不能够持续为乙酰辅酶A的合成提供足够的底物,但如果在fmbJ-acs的发酵培养基中分批补料乙醇、乙酸等可以直接用于合成乙酰辅酶A的物质[41],并将发酵体系扩大,随着底物量的充足及各方面设施的完备,Bacillomycin D产量也有可能获得大幅提高,这为寻找更有效的提高Bacillomycin D产量的方法开辟了新的思路。

