产KPC酶肺炎克雷伯菌耐碳青霉烯类药物的分子机制研究
张鹏 李婕 单泳源 李宇晨
(皖南医学院弋矶山医院检验科,芜湖 241001)
肺炎克雷伯菌是临床检出率最高的肠杆菌目细菌之一,除可引起原发性肺炎外,还能引起各种肺外感染,包括菌血症、泌尿系感染、脑膜炎和肠炎等。碳青霉烯类抗生素目前仍是临床上治疗肠杆菌目细菌感染最有效的抗菌药物,然而近来发现耐碳青霉烯类肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumonia,CRKP)检出率逐年增高[1],且因其治疗困难引起临床高度关注。自2013年起,美国CDC将CRKP列为必须紧急处理的耐药菌之一[2]。CRKP耐碳青霉烯类药物的机制主要是产碳青霉烯酶,在中国这其中以A组丝氨酸碳青霉烯酶(KPC酶)最常见[3]。本研究收集皖南医学院弋矶山医院临床分离非重复CRKP菌株,对其产碳青霉烯酶及ESBLs的表型进行检测并验证,并对CRKP进行序列分型,为临床抗CRKP精准治疗提供理论及实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株收集
回顾性收集2020年1月—2020年12月皖南医学院弋矶山医院临床分离保存的非重复肺炎克雷伯菌株923株,使用VITEK-2全自动细菌鉴定仪进行菌种鉴定,并用PCR扩增16S rRNA,将产物送至上海生工进行测序,根据测序结果与GenBank中序列的比对验证菌种。药敏试验按《全国细菌耐药监测网技术方案(2018版)》进行,根据美国临床和实验室标准化协会(CLSI,2019版)推荐的肠杆菌耐药折点,将亚胺培南或美罗培南最低抑菌浓度(MIC)>2 mg/L并同时使用K-B法复核美罗培南药敏纸片抑菌圈直径 ≤14 mm的肺炎克雷伯菌纳入CRKP范围。质控菌株均为本实验室保存的菌株,产碳青霉烯酶表型检测阳性质控菌为肺炎克雷伯菌ATCC BAA1705,阴性质控菌为肺炎克雷伯菌ATCC BAA1706,碳青霉烯酶基因检测阳性质控菌为肺炎克雷伯菌1192(blaKPC)、肺炎克雷伯菌1923(blaOXA),ESBLs基因检测阳性质控菌为肺炎克雷伯菌1182(blaTEM)、肺炎克雷伯菌1 5 0 7(b l aSHV)和肺炎克雷伯菌1188(blaCTX-M)。
1.1.2 主要仪器与试剂
采用法国BioMérieux VITEK-2全自动细菌鉴定与药敏分析系统以及配套试剂、杭州艾康生物Promotor RTO-960实时荧光定量PCR仪、美国Bio-Rad PCR扩增仪、琼脂糖凝胶电泳仪及成像系统。天坛生物药敏纸片购于北京普纳德科技有限公司,NGTest CARBA 5碳青霉烯酶检测试剂盒购于上海复兴长征医学科学有限公司,Trizol及RNA逆转录试剂盒购自试剂购自赛默飞世尔科技(中国)有限公司,血琼脂培养基、巧克力琼脂培养基购自济南百博生物技术股份有限公司,麦康凯琼脂培养基购自郑州点石生物技术有限公司,MH琼脂培养基为英国Oxoid公司商品配制而成。
1.2 方法
1.2.1 药敏试验
使用VITEK-2全自动细菌鉴定与药敏分析系统配套的革兰阴性杆菌药敏板测定临床分离肺炎克雷伯菌株对常见抗菌药物的MIC值,采用微量肉汤稀释法测定肺炎克雷伯菌株对药敏板未包含的药物如多黏菌素B及头孢他啶/阿维巴坦的MIC值。结果根据CLSI M100-S30推荐的折点进行判读。替加环素药敏折点参考EUCAST V11.0关于肠杆菌科细菌MIC药敏判定标准。药敏结果中显示碳青霉烯类耐药的肺炎克雷伯菌,采用K-B法复核,美罗培南药敏纸片抑菌圈直径≤14 mm的肺炎克雷伯菌被纳入CRKP。
1.2.2 碳青霉烯酶表型检测
采用胶体金免疫层析法体外定性检测CRKP产碳青霉烯酶型[4],将待测菌株与提取缓冲液混合后加入检测卡样本孔,待测标本中的碳青霉烯酶与胶体金结合垫上耦联的碳青霉烯酶单抗反应,形成相应的免疫复合物在层析作用下沿着硝酸纤维素膜移动,固定在KPC、OXA-48、VIM、IMP和NDM相应的检测线上。阳性质控菌采用肺炎克雷伯菌ATCC BAA1705,阴性质控菌采用肺炎克雷伯菌ATCC BAA1706。
1.2.3 碳青霉烯酶耐药相关基因的检测
PCR法扩增CRKP菌株常见的产碳青霉烯酶相关基因blaKPC、blaOXA-48、blaVIM、blaIMP和blaNDM。按照文献中提供的引物序列进行引物合成[5],15 μL PCR反应体系包括DNA模板2.0μL、P1 0.5 μL、P2 0.5 μL、 2×PCR mixture 7.5 μL、ddH2O 4.5 μL,反应参数为95℃ 5 min、95℃ 30 s、56℃ 30 s、72℃ 60 s,35个循环,72℃延伸6 min。取PCR扩增产物5μL行琼脂糖凝胶电泳并成像,同时将扩增产物及引物送至上海生工进行Sanger测序,结果与GenBank中序列比对加以验证。
1.2.4 ESBLs耐药相关基因的检测
选取产KPC酶CRKP菌株,PCR法扩增产ESBLs相关基因blaTEM、blaSHV和blaCTX-M。按照文献中提供的引物序列进行引物合成[6],15 μL PCR反应体系包括DNA模板2.0 μL、P1 0.5 μL、P2 0.5 μL、2×PCR mixture 7.5 μL、ddH2O 4.5 μL,反应参数为95℃ 5 min、95℃ 30 s、58℃ 30 s、72℃ 90 s,35个循环,72℃延伸7 min。电泳分析及测序验证如上所述。
1.2.5 多位点序列分型
针对产KPC酶CRKP,用PCR法扩增其高度保守的管家基因rpoB、gapA、phoE、infB、tonB、mdh和pgi。按照文献中提供的引物序列进行引物合成[7],15μL PCR反应体系包括DNA模板2.0 μL、P1 0.5
μL、P2 0.5 μL、2×PCR mixture 7.5 μL、ddH2O 4.5 μL,反应参数为95℃ 5 min、95℃ 30 s、55℃ 30 s、72℃ 60 s,35个循环,72℃延伸5 min。将扩增产物进行Sanger测序并将序列结果传至http://pubmlst.org/获得等位基因编号,组合编号进一步查得ST结果。
2 结果
2.1 肺炎克雷伯菌株对临床常见抗菌药物的耐药结果
所收集923株肺炎克雷伯菌株对亚胺培南耐药率为25.89%,对美罗培南耐药率为24.16%,256株CRKP对亚胺培南和美罗培南耐药率高达93.36%和87.11%。CRKP菌株对所有β-内酰胺类药物(含酶抑制剂)耐药率均较高(>95%),对氨基糖苷类和喹诺酮类药物耐药率也偏高(>70%),但对替加环素、多黏菌素B及头孢他啶/阿维巴坦耐药率较低,表1。
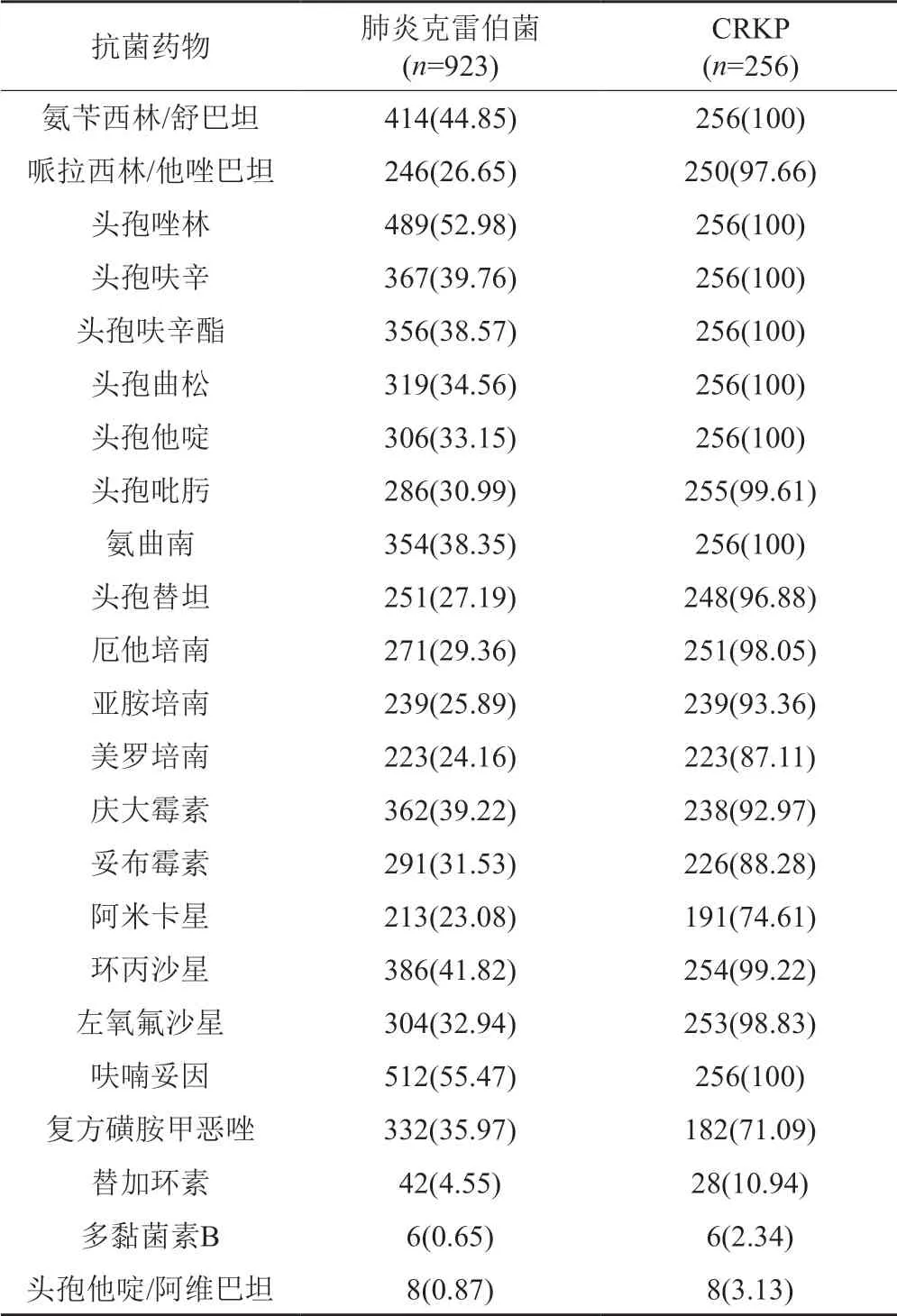
表1 肺炎克雷伯菌及CRKP菌株对临床常见抗菌药物的耐药率[n(%)]Tab.1 Drug resistance of Klebsiella pneumoniae and CRKP strains[n(%)]
2.2 CRKP产碳青霉烯酶表型及基因型鉴定结果
256株CRKP菌株采用胶体金免疫层析法体外定性检测碳青霉烯酶型,与PCR产物经测序对比结果正确率为100%,同时经PCR扩增5种常见碳青霉烯酶耐药相关基因后,其中183株KPC阳性、5株NDM阳性、25株IMP阳性,未检出VIM和OXA-48阳性菌株。碳青霉烯酶表型检测及相关基因部分电泳结果如图所示(图1)。测序结果显示183株KPC阳性菌株均携带KPC-2型碳青霉烯酶,占CRKP菌株的71.48%。
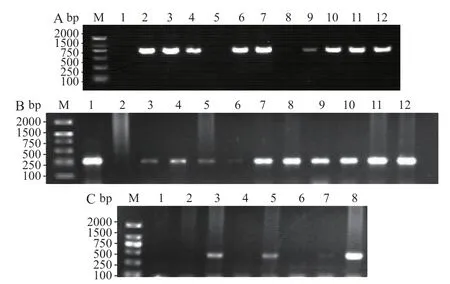
图1 部分CRKP菌株碳青霉烯酶基因检测电泳结果Fig.1 Detection of carbapenemase gene in some CRKP strains by electrophoresis
2.3 产KPC酶CRKP携带ESBLs耐药相关基因鉴定结果
183株KPC酶阳性CRKP经全自动微生物分析系统检测均产ESBLs,PCR扩增3种常见ESBLs耐药相关基因后,有118株携带blaTEM-1,129株携带blaSHV-11,101株携带blaCTX-M-1,ESBLs耐药相关基因部分电泳结果如图2所示,其中55株产KPC酶CRKP菌株携带2种及2种以上ESBLs耐药相关基因,占产KPC酶CRKP菌株的30.05%。
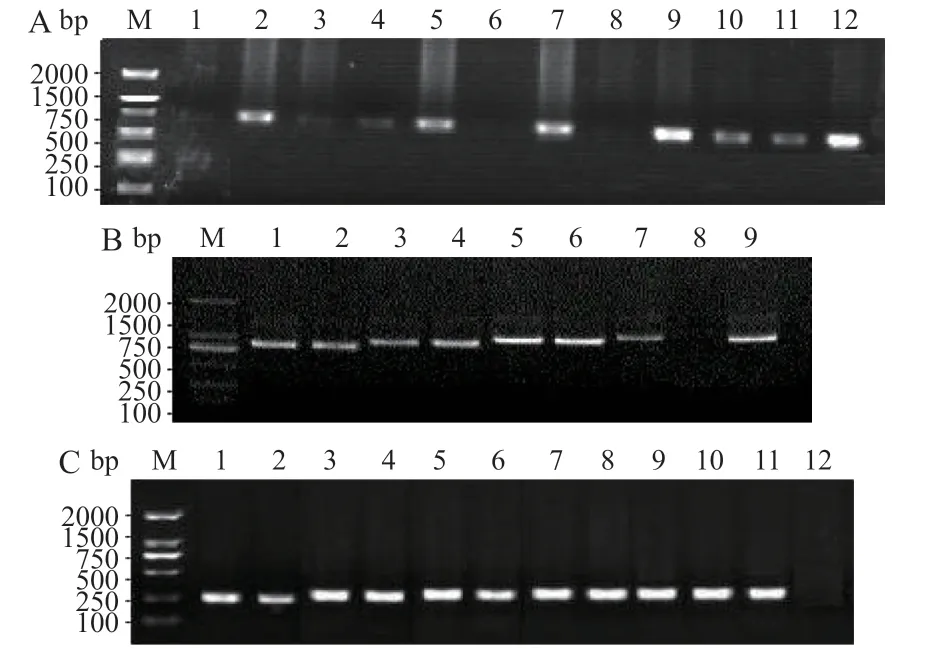
图2 产KPC酶CRKP携带ESBLs基因检测部分电泳结果Fig.2 Detection of ESBLs gene carried in KPC producing CRKP strains by electrophoresis
2.4 产KPC酶CRKP菌株ST分型结果
经过MLST测序比对,183株产KPC酶CRKP分属于2种ST分型,其中176株为ST11型,占96.17%,7株为ST12型,占3.83%。
3 讨论
肺炎克雷伯菌是临床分离肠杆菌目克雷伯菌属中最常见的重要致病菌,其广泛存在于自然界及人类呼吸道和肠道中。当人体免疫力下降时,肺炎克雷伯菌作为条件致病菌成为患者感染的病原菌[8]。由肺炎克雷伯菌引起的感染在治疗方面最有效的药物是碳青霉烯类药物,但随着该类药物在临床的广泛滥用,耐药率也不断攀升。近年来,我院临床送检培养标本结果显示肺炎克雷伯菌占比逐年增高,且耐药现象也日趋严重。全国细菌耐药监测网2014—2019年细菌耐药性监测报告显示肺炎克雷伯菌构成比由13.9%增至14.3%,肺炎克雷伯菌对碳青霉烯类药物耐药率由4.5%增至10.9%[9]。我院2020年细菌耐药统计结果显示肺炎克雷伯菌构成比占19.6%,对碳青霉烯类药物耐药率为25%左右,均高于全国平均水平。这一结果强烈提示需要重点加强临床CRKP防控及相关科室的感控工作。
本研究256株CRKP菌株对临床常用抗菌药物的体外药敏试验结果显示,对所有β-内酰胺类药物(含酶抑制剂)耐药率均较高(>95%),对氨基糖苷类、喹诺酮类、磺胺类药物耐药率也较高(>70%),这给临床治疗和院内感控带来了极大的挑战。由于碳青霉烯类药物的耐药,CRKP的治疗在临床常用抗菌药物选择上几乎无药可选,有文献报道可通过增加给药剂量[10]、延长滴注时间、优化给药频次或雾化、局部注射等[11]提高药物浓度来达标PK/PD,或联合替加环素、多黏菌素抗感染治疗[12-13]以及应用新的酶抑制剂[14]。本研究显示我院CRKP对多黏菌素和替加环素的耐药率仅为2.34%和10.94%,对新的酶抑制剂头孢他啶/阿维巴坦的耐药率仅为3.13%,可作为临床CRKP治疗的新选择。
CRKP主要耐药机制是产碳青霉烯酶,临床常见碳青霉烯酶型有KPC、OXA-48、VIM、IMP、NDM等,其中我国常见的是KPC和IMP型[15],OXA-48型主要流行于欧洲和拉丁美洲[16],NDM和VIM型主要流行于希腊地区[17]。本研究中,我院KPC型CRKP占71.48%,是主要的耐药机制,与目前相关文献报道一致[18]。此外,我院IMP型CRKP占9.77%,NDM型CRKP占1.95%,未检出VIM和OXA-48型CRKP。其中NDM型CRKP菌株耐药是通过质粒水平传播的,速度快,需加强重视和监控。另外,仍有部分CRKP菌株未检测出产以上5种碳青霉烯酶,也未检测出携带碳青霉烯酶耐药相关基因,这与其OmpK35、OmpK36和OmpK37等外膜孔蛋白缺失或合并产AmpC酶有关[19]。Moland等[20]研究发现仅KPC酶通常只会引起肺炎克雷伯菌对碳青霉烯类药物低水平耐药,而产KPC酶CRKP对碳青霉烯类药物高水平耐药可能与合并产ESBLs有关,本研究结果发现我院产KPC酶CRKP菌株均至少携带3种ESBLs基因blaTEM-1、blaSHV-11和blaCTX-M-1中的1种,携带2种及2种以上ESBLs耐药相关基因菌株占产KPC酶CRKP菌株的30.05%。
CRKP菌株除为临床常见致病菌外,还可引起院内感染,因此对CRKP进行同源性分析不仅能了解肺炎克雷伯菌的分子流行特征,还能及时发现耐药菌株的暴发,为院感防控提供依据[21]。MLST是一种常用的菌株同源性分析方法,本研究对183株产KPC酶CRKP菌株进行ST分型,结果显示ST11型占96.17%,为主要流行株,与国内其他报道一致[22]。表明我院临床科室存在ST11型CRKP不同程度的流行,应加强相关科室医务人员的院感防控意识。本研究将进一步对CRKP菌株来源科室及标本类型进行详细分类统计,着重确定CRKP院内流行区域。
综上所述,皖南医学院弋矶山医院临床分离耐碳青霉烯类肺炎克雷伯菌主要为ST11型产KPC酶CRKP,且不同程度携带ESBLs,这些耐药菌株治疗用药有限,致病死率较高,检出率逐年增高,仅对替加环素、多黏菌素及新的酶抑制剂敏感,应引起临床高度重视抗菌药物合理应用。同时,我院应进一步加强产KPC酶CRKP的细菌耐药监测工作及医院感染管控措施,防止CRKP院内播散流行。

