外泌体circ_0001445在胶质瘤内皮细胞血管生成中的调控机制研究
高宁,金虎,陈伟明,陈焕雄,王青松,彭俊,詹文亮,夏鹰
(中南大学湘雅医学院附属海口医院神经外科,海南 海口 570208)
胶质瘤是世界上最常见的中枢神经系统恶性肿瘤[1]。最新证据表明,胶质瘤细胞与大脑微环境之间的相互作用可能影响脑瘤的生长[2]。外泌体存在于循环和组织微环境中,是由细胞分泌的一种微小囊泡,可携带和传递重要的信号分子[3]。有证据表明,来自癌细胞的外泌体与肿瘤的发生、进展和转移密切相关[4]。研究显示,环状RNA(circular RNA,circRNA)在多种肿瘤中异常表达,可成为肿瘤诊断及预后评估的标志物[5]。XU等[6]研究表明,过表达circ_0001445通过调节miR-942-5p/ALX4轴减慢肝癌的进展。BARBAGALLO等[7]研究表明,circ_0001445通过调节剪接因子SRSF1/SRSF3的分子轴以抑制多形性胶质母细胞瘤的迁移。circ_0001445可能是胶质瘤的治疗靶点,但其在胶质瘤微血管内皮细胞血管生成中的调控作用还有待阐明。基于此,本研究旨在探讨circ_0001445对胶质瘤微血管内皮细胞的恶性生物学的影响以及相关机制,以期为外泌体circ_0001445在胶质瘤进展中的作用提供新的见解,现报道如下。
1 材料与方法
1.1 组织细胞及主要试剂、仪器①组织细胞:人脑微血管内皮细胞(human brain icrovascular endothelial cells,HBMECs)、人脑星型胶质正常细胞(human astrocytes,HEB)及T98G胶质瘤细胞均购自上海通派生物公司;55例胶质瘤组织和癌旁组织样本均来自2016年5月至2020年6月于本院接受胶质瘤手术患者。本研究经医院伦理委员会审核批准。②相关试剂:TRIzol试剂(源叶生物公司,货号:R21086);逆转录试剂盒(上海翊圣生物科技有限公司,货号:11141ES10);荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒(科邦兴业公司,货号:208054);双荧光素酶报告基因检测试剂盒(上海翊圣生物科技有限公司,货号:11402ES60);circ_0001445过表达质粒载体和空载质粒(维真生物);GADPH内参引物[生物生工工程(上海)股份有限公司,货号:B661104-0001];脂质体转染试剂Lipofectamine 2000(GlpBio公司,货号:GK20005);人工基底膜(北京盈丰大通科技有限公司,货号:354234);细胞外泌体提取试剂盒(贝博生物科技有限公司,货号:BB-3901);甘油醛-3-磷酸脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH,圣克鲁斯生物技术公司,货号:51332);CD63抗体(圣克鲁斯生物技术公司,货号:sc-5275);Alix抗体(圣克鲁斯生物技术公司,货号:sc-53540);二抗(圣克鲁斯生物技术公司)。③主要仪器:MA-6000荧光定量PCR仪(济南千司生物技术有限公司);JEM-2500SE透射电子显微镜(日本日立公司);BXF-80倒置显微镜(上海炳宇光学仪器);JS-680D凝胶成像仪(杭州得聚仪器设备公司)。
1.2 细胞培养将HBMECs、T98G和HEB细胞均培养在DMEM高糖完全培养基中,其中添加了胎牛血清(10%)和青霉素(100 U/ml)。当细胞融合率达到90%时,进行消化传代或质粒转染。将T98G细胞分为vector组(转染空载质粒)和circ_0001445组(转染circ_0001445过表达质粒),按照说明书进行转染。转染24~48 h,qPCR验证转染效率,转染结束后,筛选收集细胞。
1.3 外泌体的提取及HBMECs细胞对其摄取的检测细胞转染成功后,更换为10%无外泌体血清的完全培养基,24 h后收集细胞上清,按照试剂说明书,通过差速离心法提取外泌体。随后,用大量磷酸盐缓冲溶液(phosphate buffer solution,PBS)洗涤沉淀,再用PBS重新悬液,并于-80℃保存备用。采用透射电子显微镜鉴定外泌体形态。通过蛋白质印迹法检测外泌体生物标志物CD63及Alix的表达情况。浓缩外泌体悬液后,用BCA蛋白质定量试剂盒测定蛋白含量,然后在SDS样品缓冲液中煮沸。待蛋白质样品电泳分离后,采用半干法转到PVDF膜,封闭后加入一抗,置于4℃过夜,加入二抗,37℃下孵育1 h,显色成像并通过Image-ProPlus软件对图片条带进行灰度值分析。外泌体鉴定结束后,将HBMECs细胞分为两组:T98G vector组(加入vector组T98G细胞外泌体)、T98G exo-circ_0001445组(加入circ_0001445组T98G细胞外泌体),将外泌体与各组HBMECs细胞在培养基中避光共培养24 h,洗涤固定后,RT-qPCR验证circ_0001445的表达。
1.4 RNA分离及RT-qPCR检测用胰蛋白酶将各组细胞预处理。根据制造商说明,使用TRIzol试剂从细胞和组织中分离出总RNA。以GAPDH mRNA水平标准化检测RNA水平,采用分光光度计测定RNA的纯度和浓度,按照逆转录试剂盒说明书的指示反转录合成cDNA链。以此链为模板采用定量PCR仪进行扩增,以GAPDH作为内参对照。RT-qPCR的热循环条件为:95℃3 min,然后95℃30 s,53℃30 s,74℃2 min,40个循环,最后74℃10 min。目的基因表达相对值以2-ΔΔCt法计算。引物序列如下,circ_0001445引 物 序列 为F:5′-CAAGATGGGCGAAAGTTCACT-3′,R:5′-TGTGTTGCTCCATGTCTAATCATT-3′。miR-127-5p引 物 序 列 为F:5'-CT CTTCAAGCTCCAAACCAAAC-3',R:5'-GTATCCACCAGAACCACCAGG-3。GAPDH引物序列为F:5′-AGAAGGCTGGGGCTCATTTG-3′,R:5′-GCAGGAGGCATTGCTGATGAT-3′。
1.5 CCK8实验将HBMECs细胞接种于96孔板上(2×104个/孔),接种后在37℃、5%CO2条件下培养过夜。按上述处理分为两组,每组设置3个复孔,使细胞密度为3×103个/孔。待细胞贴壁后,按照分组加入外泌体干预48 h,分别向各孔中加入10 μl CCK8,置于CO2恒温培养箱中避光培育2 h后,在450 nm的波长下,通过酶标仪测出每孔吸光度(opticaldensity,OD)值,取3孔计算平均OD值。
1.6 Transwell实验分别将HBMECs细胞置于含有和不含有Transwell预涂的Matrigel基质胶过滤器的上腔内,在36孔板培养板上插8 μm孔。培养48 h后,用棉签去除上膜上残留的细胞。4%多聚甲醛固定迁移、侵袭的细胞,0.1%结晶紫染色20 min。随机选取5个视野在100倍显微镜下观察,迁移、侵袭细胞数用Adobe Photoshop CS6计数。
1.7 预测靶基因和双荧光素酶报告实验通过生物信息学软件circinteractome发现circ_0001445存在miR-127-5p的结合片段。为证实circ_0001445与miR-127-5p之间的靶向性,将含有miR-127-5p靶向序列的circ_0001445 RNA的野生型和突变的3’-UTR序列克隆至pGL3质粒,分别命名为WT-circ_0001445和MUT-circ_0001445。细胞在6孔板中培养至80%融合度,然后分别转染100 ng的WT-circ_0001445、MUT-circ_0001445、50nM的miR-127-5p过表达质粒和空载质粒。根据制造商的说明,在转染48 h后,使用双荧光素酶测定法评估荧光素酶活性,分析结果。
1.8 统计学方法采用SPSS 18.0统计学软件进行数据分析,计量资料以“±s”表示,采用t检验,作图通过GraphPadPrism 8软件,以P<0.05为差异有统计学意义。
2 结果
2.1 circ_0001445、miR-127-5p在胶质瘤组织中的表达RT-qPCR检测circ_0001445、miR-127-5p在胶质瘤组织的表达,结果发现,circ_0001445在胶质瘤组织中的表达显著下调(P<0.05),而miR-127-5p显著上调(P<0.05),见图1。
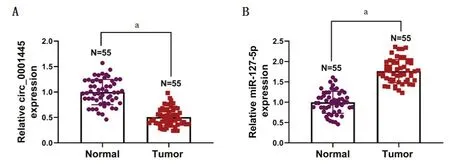
图1 circ_0001445、miR-127-5p在胶质瘤组织中的表达Figure 1 Expression of circ_0001445 and miR-127-5p in glioma tissue
2.2 T98G细胞分泌外泌体的鉴定电子显微镜下可见外泌体呈圆形的双层膜囊泡结构,且外泌体标记蛋白CD63和Alix表达均呈阳性,见图2。

图2 T98G细胞分泌的外泌体的鉴定Figure 2 Identification of exosomes secreted by T98G cells
2.3 T98G来源的外泌体circ_0001445抑制HBMECs的增殖能力相比正常细胞,胶质瘤细胞中的circ_0001445表达显著下调(P<0.05)。过表达circ_0001145处 理T98G细 胞 后,T98G细 胞 中 的circ_0001145显著上调(P<0.05),使HBMECs直接与T98G细胞的外泌体共培养24 h后,发现过表达T98G细胞中的circ_0001145显著增加HBMECs中circ_0001145的表达(P<0.05),见图3。CKK8结果发现,过表达T98G细胞中的circ_0001145显著抑制了HBMECs的吸光度(P<0.05),见图4。

图3 过表达T98G细胞circ_0001145Figure 3 Overexpressing T98G cells circ_0001145
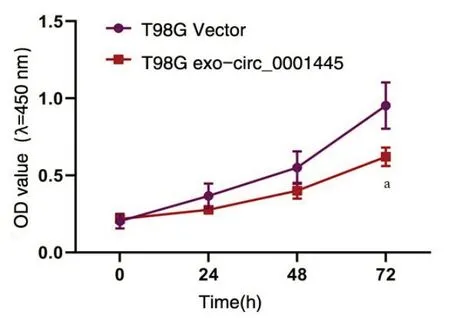
图4 外泌体circ_0001445抑制了HBMECs的吸光度Figure 4 Exosome circ_0001445 inhibited the absorbance of HBMECs
2.4 外泌体circ_0001445促进HBMECs的迁移和侵袭Transwell结果发现,过表达circ_0001445可以显著抑制HBMECs的迁移和侵袭能力(P<0.05),见图5。
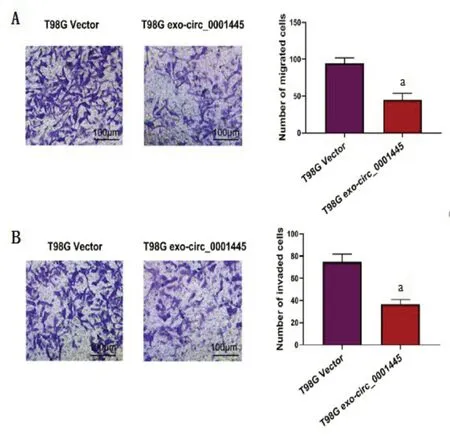
图5 外泌体circ_0001445促进HBMECs的迁移侵袭(Transwell)Figure 5 Exosome circ_0001445 promotes the migration and invasion of HBMECs(Transwell)
2.5 外泌体circ_0001445与miR-127-5p靶向结合生物信息学预测circ_0001445与miR-127-5p具有结合位点;同时,双荧光素酶报告基因实验验证了其靶向关系,与miR-NC组相比,转染组野生型纯合子circ_0001445荧光素酶活性显著降低(P<0.05);而突变型纯合子circ_0001445荧光素酶活性无显著差别,见图6。
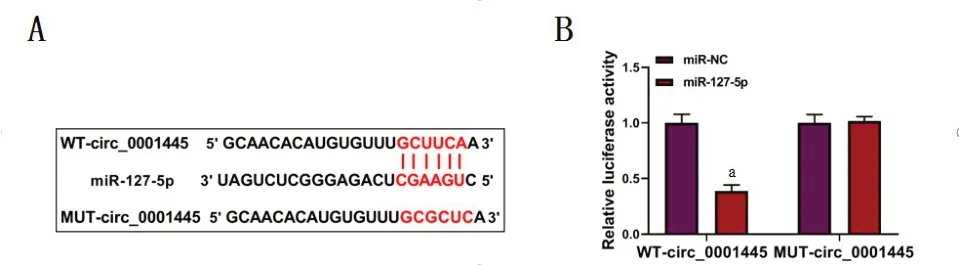
图6 circ_0001445与miR-127-5p靶向结合Figure 6 Targeted binding of circ_0001445 to miR-127-5p
3 讨论
外泌体介导的细胞间相互作用因其在癌症等多种病理过程中具有重要作用而受到越来越多的关注[8]。外泌体的双层脂质膜可保护生物活性物质不被降解,在细胞间通讯中发挥至关重要的作用。同时,外泌体衍生的circRNA作为信号分子调控肿瘤生长发育,是潜在的肿瘤进展生物标志物[9]。本研究中,鉴于胶质瘤细胞与大脑微环境之间的相互作用可影响脑瘤的生长,故将HBMECs细胞作为研究对象。研究表明,circRNA可作为miRNA海绵,调节其表达和功能,参与各种疾病的发生发展[10]。circ_0001145作为一种circRNA,研究显示,其在多种癌症中发挥抑癌因子的作用[11]。miR-127-5p作为一种多功能调控因子,可参与多种癌症的进展[12]。此外,在胶质瘤细胞中沉默miR-127-5p已被证明可通过细胞周期阻滞和诱导细胞凋亡等机制抵消阿霉素耐药[13]。本研究发现,circ_0001145在胶质瘤组织和胶质瘤细胞中均显著下调,而miR-127-5p在胶质瘤组织中显著上调(P<0.05),提示circ_0001145可能在胶质瘤中发挥抑癌因子的作用,与既往研究[14]结果一致。
在肿瘤生长的前期,因仅能吸取周围组织弥散的营养物质,所以生长缓慢;而当肿瘤进入血管期时,周围组织出现大量肿瘤相关血管,为肿瘤提供了充足的营养,促进了肿瘤的生长。新生血管对肿瘤的生长、转移等至关重要,而微血管内皮细胞在血管生成过程中起关键作用。因此,抑制微血管内皮细胞的增殖、迁移,可防止血管生成,从而抑制肿瘤的恶性发展。本研究结果发现,过表达T98G细胞中的circ_0001145可显著抑制HBMECs细胞的增殖、迁移及侵袭能力。结合荧光霉素实验结果,提示外泌体circ_0001145可能通过靶向调控miR-127-5p,从而抑制HBMECs的增殖、迁移及侵袭能力。关于外泌体circ_0001145在HBMECs中的具体调控机制还有待进一步实验进行探索与证实。
综上所述,外泌体circ_0001145在胶质瘤组织和细胞中高表达,且过表达外泌体circ_0001145可有效抑制HBMECs细胞的增殖、迁移及侵袭能力,其作用用机制可能与靶向调控miR-127-5p有关。

