主动脉夹层合并灌注不良综合征
常光其, 杨文超
(中山大学附属第一医院血管外科 血管疾病诊治技术国家地方联合工程实验室,广东 广州 510080)
灌注不良综合征(malperfusion syndrome,MPS)是一种继发于主动脉夹层 (aortic dissection,AD)的严重并发症,表现为AD累及分支动脉导致末端器官缺血,进而引发器官功能障碍。根据累及部位的不同,各种类型MPS的发生率和严重程度不尽相同。其中以下肢MPS发病率最高,肾脏次之[1]。
目前,MPS已成为影响AD病人近期疗效和远期预后的重要因素。因此,早发现、早诊断、早治疗对于挽救脏器功能、改善预后至关重要。本文将针对这一并发症的治疗进展进行分析。
AD合并MPS的分型
AD真、假腔之间的流体压力梯度和血柱所产生的应力是MPS发生的基础。根据AD撕裂内膜是否累及分支动脉血管,MPS可分为动态型、静态型及混合型[2]。其中,动态型MPS的形成机制如下:①AD真腔灌注分支动脉血管,导致夹层累及范围扩大、收缩压升高、心率加快以及外周阻力降低,加剧假腔(高压)和真腔(低压)之间压力梯度导致真腔塌陷,阻塞分支动脉开口;②主动脉撕裂的内膜覆盖分支动脉开口,导致重要脏器缺血。静态型MPS是由于病变累及分支血管,内膜破裂、卷曲或假腔血肿形成从而阻塞、压迫真腔,导致分支动脉血液淤积,血液呈高凝状态,加速血栓形成,故静态型阻塞以血管狭窄与闭塞为特点。上述两种类型并存时,则称为混合型MPS。
根据分支动脉形态学和血流动力学改变,Nagamine等[3]将分支动脉MPS分为3种类型(见表1、图 1)。
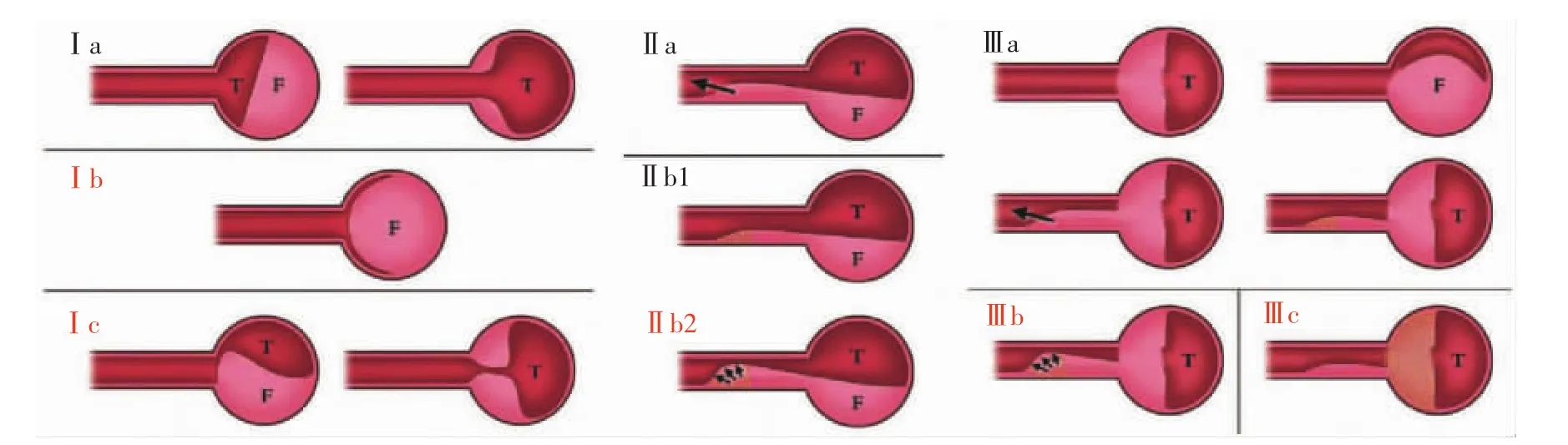
图1 AD分支动脉灌注分型图

表1 AD的分支动脉灌注模式
上述分型中Ⅰb、Ⅰc、Ⅱb2、Ⅲb和Ⅲc由于分支动脉血流灌注明显受损,被定义为高危亚型。
AD合并MPS的治疗
随着腔内治疗器械与技术的不断革新,其已逐步取代开放手术成为治疗AD合并MPS的主要手段。国际急性主动脉夹层登记 (International Registry of Acute Aortic Dissection,IRAD)资料显示,接受腔内治疗的MPS病人所占比例已从1996年至2001年的35%上升到2008年至2014年的68%,而开放手术则从47%下降至18%[4]。与开放手术相比,胸主动脉腔内修复术(thoracic endovascular aneurysm repair,TEVAR)具有微创、失血少、无需阻断主动脉、手术应激反应小、术后恢复快、重症监护和住院时间缩短、并发症发生率和死亡率明显降低等优势。Fann等[5]采用开放手术方式对18例合并MPS的AD病人进行治疗,40%的病人死亡。Dake等[6]采用TEVAR对15例合并MPS的AD病人进行治疗,仅16%的病人死亡。一些相关研究显示TEVAR治疗效果良好,住院死亡率0~10.7%[7-9]。
一、AD合并内脏MPS的治疗
急性内脏MPS是AD病人隐蔽和严重的并发症之一。其定义为任何影像学证据显示腹腔干、肠系膜上、下动脉血流灌注受损,肠道活力降低或坏死,伴或不伴乳酸中毒、疼痛或腹胀。IRAD对3 099例AD病人资料分析结果显示,AD合并急性内脏MPS的发病率约为3.8%,但其住院死亡率可高达63.2%,而无内脏MPS的死亡率则为23.8%[10]。
对于动态型内脏MPS,TEVAR可有效扩张真腔,恢复真腔内血流,并减少假腔血流以促使其血栓形成,有利于缓解分支动脉MPS[11]。静态型内脏MPS,根据供血来源可进一步分为真腔供血型、假腔供血型以及双腔供血型。对于真腔、双腔供血型分支动脉MPS,TEVAR封堵AD近端内膜破口不会加重受累内脏缺血。因此,可采用TEVAR封堵近端内膜破口,一期植入分支动脉支架以恢复缺血内脏血流灌注。对于腹腔干动脉完全假腔供血且无远端内膜破口的分支动脉MPS,采用TEVAR直接封闭近端破口,一般不会造成严重后果。但对于完全假腔供血的肠系膜上动脉MPS,TEVAR术后可进一步加重MPS,造成肠道缺血坏死,甚至危急生命。因此,对于此类病人一般先行经皮血管内开窗术、分支动脉支架植入术或解剖旁路转流术,尽快恢复肠系膜上动脉血流灌注。经皮血管内开窗术,即应用球囊在夹层内膜片打开窗口,假腔内血液回流真腔,降低假腔内压力,使其塌陷,重建真腔。肠系膜上动脉MPS症状缓解后,仍需密切检查病人肠道功能恢复情况。对于出现急性腹膜炎症状或血流动力学不稳定者,应立即开腹手术,切除失活肠道,恢复肠道功能,同时考虑延迟关闭腹腔,以便再次探查剩余肠道是否存活。
二、AD合并肾脏MPS的治疗
AD合并肾脏MPS的发病率约为8%,12%~25%的病人存在双侧肾动脉受累[12-13]。AD病人合并肾脏MPS症状,严重影响其预后。Qian等[14]对48例肾脏MPS的病人分析发现,围术期死亡率高达22.9%。Chen等[15]的荟萃分析发现,合并肾脏MPS的AD病人住院时间、血液透析时间以及术后30 d和1年的死亡率明显增加。
但AD病人合并肾脏MPS早期症状不明显,如肾小球滤过率、肌酐清除率等反映肾功能的指标,在出现肾脏MPS时仍可保持正常水平,因此在临床上往往不易被发现。CT血管造影检查出现肾脏非对称性强化是提示肾脏MPS的风险指标之一,但不能作为诊断的可靠依据。Blacker等[16]针对161例AD病人行CT血管造影检查发现,肾脏非对称性强化的诊断灵敏度为65%,特异度为58%。肾动脉超声是诊断肾脏MPS的有力辅助检查方式[17]。当超声显示动脉近端收缩期峰值速度增加,远端收缩期峰值速度降低和舒张期流量减少,则提示肾脏存在MPS。
目前采用TEVAR治疗该类病人取得良好效果。然而,部分病人TEVAR术后远端主动脉仍存在真腔压迫或塌陷,肾脏MPS症状未改善。“衬裙”技术,即 PETTICOAT(provisional extension to induce complete attachment)技术,通过在主动脉覆膜支架远端衔接金属裸支架,以固定夹层内膜瓣,防止夹层远端假腔压迫致使真腔塌陷,改善动态型MPS[18]。Nienaber等[18]对12例TEVAR术后仍存在远端真腔塌陷合并肾脏动脉MPS的AD病人采用 “衬裙”技术治疗,手术成功率为100%,远端受压真腔扩张,肾脏MPS症状消失。Bertoglio等[19]对11项研究共439例病人资料进行荟萃分析发现,“衬裙”技术手术成功率为90.2%,30 d总体死亡率为4.9%,适用于动态型MPS病人。Sobocinski等[20]研究发现联合“衬裙”技术治疗较单纯治疗,明显降低AD病人肾脏MPS相关死亡率。动态型肾脏MPS病人,行TEVAR、经皮血管内开窗术、“衬裙”技术治疗后假腔塌陷,真腔重建,受累分支动脉大多可恢复血流灌注。对于静态型肾脏分支动脉MPS,Iwakoshi等[21]发现真腔供血的肾脏MPS经TEVAR术后,62.5%的病人肾脏MPS症状缓解良好;而肾动脉由真、假双腔供血或全部假腔供血,只有6.5%的病人肾脏MPS症状得到缓解。因此,针对静态型肾脏MPS病人,通常需联合肾动脉分支支架等方式协助治疗。Barnes等[22]对71例AD合并肾脏MPS病人,采取经皮血管内开窗术24例、肾动脉支架植入术31例,以及两种手术联合治疗16例,手术成功率达95%。
对于肾动脉分支内膜广泛剥离或大量血栓形成而造成支架植入困难者,可采用外科开放手术、解剖外旁路转流术治疗。
三、AD合并下肢MPS的治疗
AD合并下肢MPS的主要机制为假腔压力升高,压迫真腔,使真腔狭窄甚至闭塞。内膜撕裂至髂、股动脉导致下肢动脉完全闭塞。内膜片形成“活瓣”,随着体位姿势改变而变化,从而出现下肢间歇性MPS等。其临床症状常表现为单侧或双侧下肢MPS,可出现“5P”征,即苍白、无脉、疼痛、麻痹和感觉异常,严重者可有红斑、水泡,甚至肌肉组织坏死。研究表明,10%的AD、40%的复杂型AD以及71%合并MPS的AD病人存在下肢MPS,该类病人如延误诊断和治疗将导致下肢永久性功能障碍或截肢[23-24]。Suzuki等[25]发现AD合并下肢MPS是住院病人死亡率增加的独立危险因素。
目前治疗策略旨在快速恢复下肢动脉血流灌注,血管腔内手术或联合杂交手术已成为治疗AD合并下肢MPS的首选方案。对于动态型下肢MPS的病人,可采用经皮血管内开窗加TEVAR治疗,大部分病人真腔血流恢复后,下肢缺血症状即可明显改善。对于静态型或混合型下肢MPS病人,虽然恢复真腔血供,但下肢动脉局部阻塞因素仍存在,因此需行髂、股动脉支架植入术治疗[26]。Henke等[27]对28例AD合并下肢MPS病人采用经皮血管腔内开窗术以及TEVAR联合髂、股动脉支架植入术进行治疗。平均随访18个月,病人保肢率高达93%。当下肢动脉阻塞严重而无法进行血管腔内干预时,可行外科主动脉开窗术或解剖外旁路转流术治疗。对于同时合并内脏MPS的病人,病情更复杂,需快速恢复受累动脉血流灌注,倾向选择外科主动脉开窗术。对于单纯合并下肢MPS的高危病人,解剖外旁路转流术更具优势。Gargiulo等[28]系统回顾138例AD合并下肢MPS病人的治疗资料,采取外科主动脉开窗术治疗与解剖外旁路转流术治疗的病人相比,死亡率为27%比14%。此外,部分病人真腔内形成血栓,可使用Angiojet等设备行溶栓、吸栓治疗。
四、AD合并脊髓MPS的治疗
AD合并脊髓MPS在临床上相对少见,但具有病情急、进展快、临床症状复杂、死亡率高等特点。Sandridge等[29]报道,AD合并脊髓MPS的发病率约1.8%。病人死亡率达31.3%[30]。脊髓血液供应复杂多变,其来源主要包括以下两个:①椎动脉来源的脊髓前、后动脉;②节段性动脉来源的肋间动脉、腰动脉、骶外动脉的脊髓支。颈段和胸上段脊髓主要接受椎动脉血供,不易受夹层病变影响;胸下段和腰段脊髓主要接受节段性动脉血供,较易受夹层病变影响。Sandhu等[31]报道29例AD合并脊髓MPS病人,44.8%的病人脊髓MPS症状自行消退,这与上述动脉之间丰富的侧支循环有关。当AD累及上述动脉后可表现为剧烈背痛、神经根疼痛及急性下肢瘫痪、大小便障碍、深浅感觉缺失等脊髓MPS表现。但Elshony等[30]报道仅47.8%的病人具有上述典型症状,这使得及时诊断和治疗无症状病人颇具挑战,其亦与不良预后相关。对于AD病人可通过体感和运动诱发电位监测脊髓灌注压,实现脊髓MPS早期诊断。
Sandhu等[31]研究发现,约80%的脊髓MPS病人行保守治疗症状可得到缓解。仅13.8%的病人保守治疗失败或合并多发MPS,需主动脉修复治疗,但行主动脉修复治疗的病人死亡率高达50%。研究建议,对于AD合并脊髓灌注不良的病人,可采用腰椎穿刺脑脊液引流进行治疗,作为保守治疗的一部分或主动脉修复的过渡[32-33]。Blacker等[16]采用脑脊液引流成功地使2例病人神经症状得到缓解。Fujisawa等[34]通过脑脊液引流、口服纳洛酮以及维持收缩压在120~140 mmHg,使AD病人合并脊髓MPS症状完全消退。此外,夹层内膜血管内开窗、脱水治疗以及辅助使用营养神经药物、氧自由基拮抗剂、激素疗法等,对减轻脊髓灌注不良损伤具有一定作用。
结 语
综上所述,MPS作为AD病人的严重并发症之一,发生率较高,预后不良,是对血管外科医师的极大挑战。需正确评估病人状况,早期诊断MPS类型及程度,从而做到早期干预、治疗。由于不同部位分支动脉在解剖、病理生理和功能上的复杂性和差异,因此,选择个性化手术治疗方案、尽快恢复组织器官再灌注和改善病人预后尤为重要。

