影响癌性肠梗阻病人预后的多因素分析
程 威, 黄雨桦, 王 剑, 李幼生
(上海交通大学医学院附属第九人民医院普外科,上海 200011)
目前,癌性肠梗阻(malignant bowel obstruction,MBO)已成为临床常见的肠梗阻类型之一,常由胃肠道原发恶性肿瘤本身或术后复发转移所致,也可由腹腔、盆腔恶性肿瘤压迫或侵犯肠道所致。与MBO相关的常见腹腔肿瘤是结肠直肠癌和卵巢癌[1]。据研究,晚期结肠直肠癌MBO患病率为24%,晚期卵巢癌MBO患病率为42%[2-3]。乳腺癌和黑素瘤是与MBO相关的常见腹腔外肿瘤[4]。结肠直肠癌病人中有7%~29%首发症状表现为急性肠梗阻[5]。由于MBO存在较高的患病率及致死率,其临床特点和治疗一直是关注和争论的焦点[6-7]。
MBO病情危重、复杂,其治疗措施有保守治疗、内镜或外科手术治疗[8]。目前国外的研究大部分集中于MBO的治疗方式[9-10],很少有对其预后相关因素进行分析,国内相关的研究更少。本研究观察MBO不同治疗方式的长期疗效,并对MBO的预后因素进行评估和分析。
资料与方法
一、一般资料
收集我院自2013年6月至2019年6月间,诊断为MBO病人的资料。所有出院诊断为“肠梗阻”的病历均再次回顾性复习,最后确诊为MBO的病人纳入本研究。诊断为肠梗阻1 177例,排除非肿瘤因素引起的肠梗阻972例,由肿瘤引起的肠梗阻205例,其中2例术后病理证实为良性肿瘤,故共203例MBO病人纳入本研究,其中得到有效随访143例(70.4%)。
二、标准依据和诊断
符合MBO和临床协议委员会国际会议提出的定义标准[11]:①存在肠梗阻的临床证据;②位于屈氏韧带以下的肠梗阻,包括小肠梗阻和结肠梗阻;③腹腔原发癌,且腹腔内有未根治性切除的病灶;④非腹腔内原发癌引起明确的腹腔内疾病。
肠梗阻诊断:①临床症状为腹痛、腹胀、恶心、呕吐、肛门停止排气排便,腹部体格检查可闻及肠鸣音亢进;②X线影像学检查发现阶梯状液平面,或CT检查发现肠管扩张狭窄的移行段,即近端肠管扩张,远端肠管狭窄空虚[12]。
三、排除标准
①不能进行有效随访;②由非肿瘤因素或良性肿瘤引起的肠梗阻,如肠扭转、术后粘连性肠梗阻,手术病理检查为非恶性肿瘤引起的梗阻。
四、资料收集与随访
设计随访表格。以统一的表格形式记录病人的一般资料、病程记录、手术记录以及随访登记表。电话随访至2019年9月1日。
五、研究终点和生存质量评分
随访的终点时间为病人死亡或随访终止日期。主要终点为病人生存情况及生存时间,包括手术、内镜等治疗后的时间。次要终点为病人治疗后3个月的生活质量评估等。病人的生存质量以生活质量评分[13](quality of life,QOL)、卡氏评分[14](Karnofsky performance scale,KPS)(百分法,0~100 分,10 分为一个等级)、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)功能状态评分[15][Zubrod-ECOG-世界卫生组织 (World Health Organization,WHO)performance status,ZPS,5 分法]指标来评估。其中QOL满分为60分,生活质量极差为≤20分,差为 21~30 分,一般为 31~40 分,较好为 41~50 分,良好为51~60分。
六、预后因素分析
MBO预后分析的因素如下:性别、年龄、肿瘤分期、相关实验室指标、生长抑素与肠内外营养的使用及治疗方式,手术还是非手术治疗。
七、统计学分析
采用SPSS 22.0软件进行统计分析。以平均值和标准差表示定量变量。其中性别、肿瘤分期、原发或继发转移、合并症数量、生长抑素使用、肠内外营养使用、是否手术作为计数资料处理。年龄、白细胞、红细胞、血红蛋白、C反应蛋白(C-reactive protein,CRP)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总蛋白、白蛋白、前白蛋白、住院时间、QOL、ZPS、KPS作为计量资料处理。用Kaplan-Meier曲线和对数秩检验进行生存分析。用Cox回归模型逐步法分析相关危险因素。采用R软件引用多因素分析中有意义的因素构建列线图,并绘制出校准曲线,以验证列线图的准确性。曲线越接近参考线,说明符合度越好。随机抽样采用Bootstrap法重复取样。P<0.05为差异有统计学意义。
结 果
一、病人基本资料
203例病人中,男117例 (57.6%),女86例(42.4%),平均年龄(67.9±15.4)(16~96)岁,<60 岁59例(29.1%),60~69岁 85例(41.9%),≥80岁 59例(29.1%)。 平均住院时间为(18.9±13.1)(1~87)d。主要临床表现为腹痛(111例,54.7%)、腹胀(89例,43.8%)、恶心呕吐(70例,34.5%)、停止排气排便(89 例,43.8%)、排便困难(26 例,12.8%)。梗阻位于小肠52例(25.6%),位于结肠 139例(68.5%),小肠、结肠均有梗阻12例(5.9%)。肿瘤来源主要为消化系统(174例,85.7%),以及妇科(15例,7.4%)、泌尿系统 (5例,2.5%)和其他或来源不明 (9例,4.4%)。导致MBO的肿瘤主要为结肠直肠癌(143例,70.4%)、胃癌 (19例,占9.4%)、卵巢癌 (7例,3.4%),还有小肠恶性肿瘤(5例,2.5%)、宫颈癌(4 例,2.0%)、前列腺癌(3 例,1.5%)、肿瘤性质不明(3例,1.5%)。其他肿瘤(19例,9.4%)包括直肠间质瘤(1例)、胰腺癌(2例)、胆管癌(1例)、胆囊癌(1例)、阑尾腺癌(2例)、腹膜后纤维肉瘤(1例)、腹膜后神经内分泌肿瘤(1例)、输卵管癌(2例)、子宫内膜癌(2例)、肾癌(1例)、膀胱癌(1例)、淋巴瘤(2例)、肺癌(2例)。在143例结肠直肠癌中,以左半结肠(56例,39.2%)和直肠(43例,30.1%)为主,右半结肠36例(25.2%),位置不明6例(4.2%),还包括2例(1.4%)合并癌(1例直肠癌合并升结肠癌,1例盲肠癌合并乙状结肠癌)。原发肿瘤111例(54.7%),继发转移肿瘤92例(45.3%)。
二、治疗情况
病人入院后均行禁食、胃肠减压等治疗。有54例使用生长抑素,32例肠内营养,56例肠外营养(见表1)。手术治疗129例(63.5%),其中3例内镜放置肠梗阻导管后再手术,6例内镜放置肠道支架后再手术。非手术治疗74例(36.5%),其中内镜放置肠道支架4例,放置肠道支架10例,其余60例行保守治疗。行手术治疗指征为梗阻较严重,急需解除梗阻或经保守治疗后未见明显好转。未手术的原因多为病人高龄、肿瘤广泛转移、基础情况较差,难以行手术治疗,或病人及其家属拒绝手术。
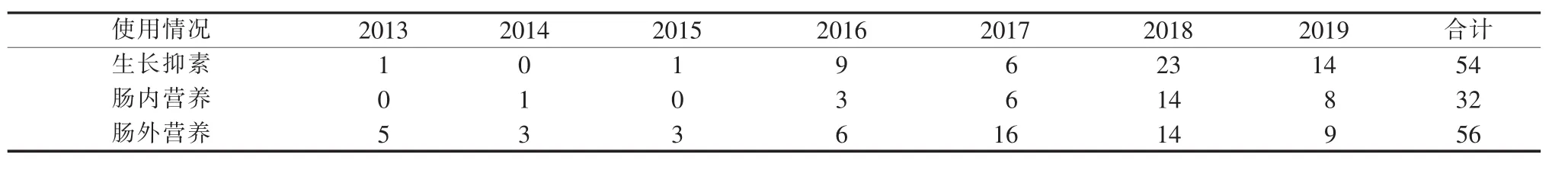
表1 2013年至2019年使用生长抑素和肠内、外营养情况(n)
三、随访结果
203例病人得到随访143例(70.4%),其中手术治疗93例(65.0%),非手术治疗50例(35.0%)。截至2019年9月1日随访,死亡86例(60.1%),生存57例(39.9%)。86例死亡病人的平均生存时间为(26.5±3.1)(0.1~38.3)个月,3、6、12 个月生存率分别为 67.8%(97 例)、58.0%(83 例)、50.3%(72 例)。
四、单因素回归预后分析
使用Cox回归对143例病人性别、年龄、肿瘤分期、实验室指标、合并慢性病数量、生长抑素使用、肠内外营养使用、住院时间、术后3个月生活质量评分,进行单因素分析(见表2)。结果显示,病人预后与年龄(P=0.679)、性别(P=0.153)、血小板(P=0.168)、CRP(P=0.235)、总蛋白(P=0.175)、合并慢性病数量(P=0.376)、住院时间(P=0.879)及生长抑素使用(P=0.870)、肠内营养(P=0.501)、肠外营养(P=0.175)相关分析,差异均无统计学意义。病人预后与肿瘤TNM分期(P<0.001)、肿瘤原发或继发转移(P<0.001)、白细胞(P=0.023)、红细胞(P<0.001)、血 红 蛋 白 (P=0.001)、ALT(P=0.023)、AST(P=0.005)、白蛋白(P<0.001)、前白蛋白(P<0.001)、是否手术治疗(P=0.013)、治疗后3个月生活质量评分(包括 QOL、ZPS、KPS)(P<0.001)等相关。 肿瘤分期晚、存在继发转移、白细胞水平高、红细胞水平低、血红蛋白水平低、ALT水平高、AST水平高、白蛋白水平低、前白蛋白水平低、未行手术治疗、治疗后3个月生活质量评分差,均提示预后差。
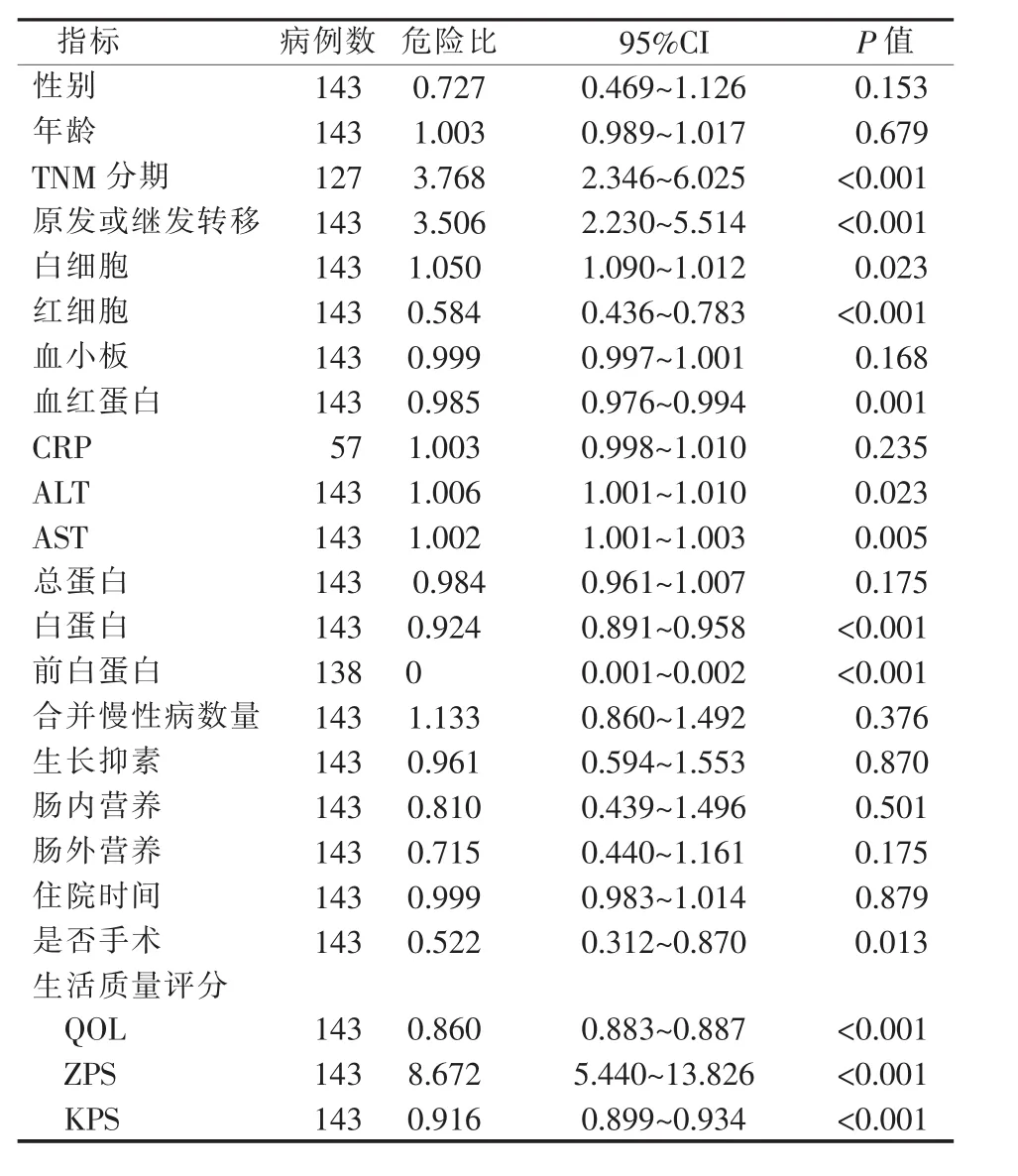
表2 与癌性肠梗阻预后相关因素的单因素Cox回归分析
五、多因素回归预后分析
对单因素分析具有显著差异的危险因素且具有明确临床意义的指标,纳入多因素Cox风险回归模型,进一步寻找独立预后危险因素。将肿瘤TNM分期、原发或继发转移、血红蛋白、白蛋白、ALT、AST、是否手术引入Cox风险回归模型,进行逐步分析。结果显示,肿瘤TNM分期(P=0.003)、白蛋白水平 (P=0.001)是影响MBO预后的独立危险因素(见表 3)。

表3 与癌性肠梗阻预后相关因素的多因素Cox回归分析
六、构建列线图
通过R软件引入部分有意义的预后因素绘制列线图(见图1),来预测MBO病人的生存期。
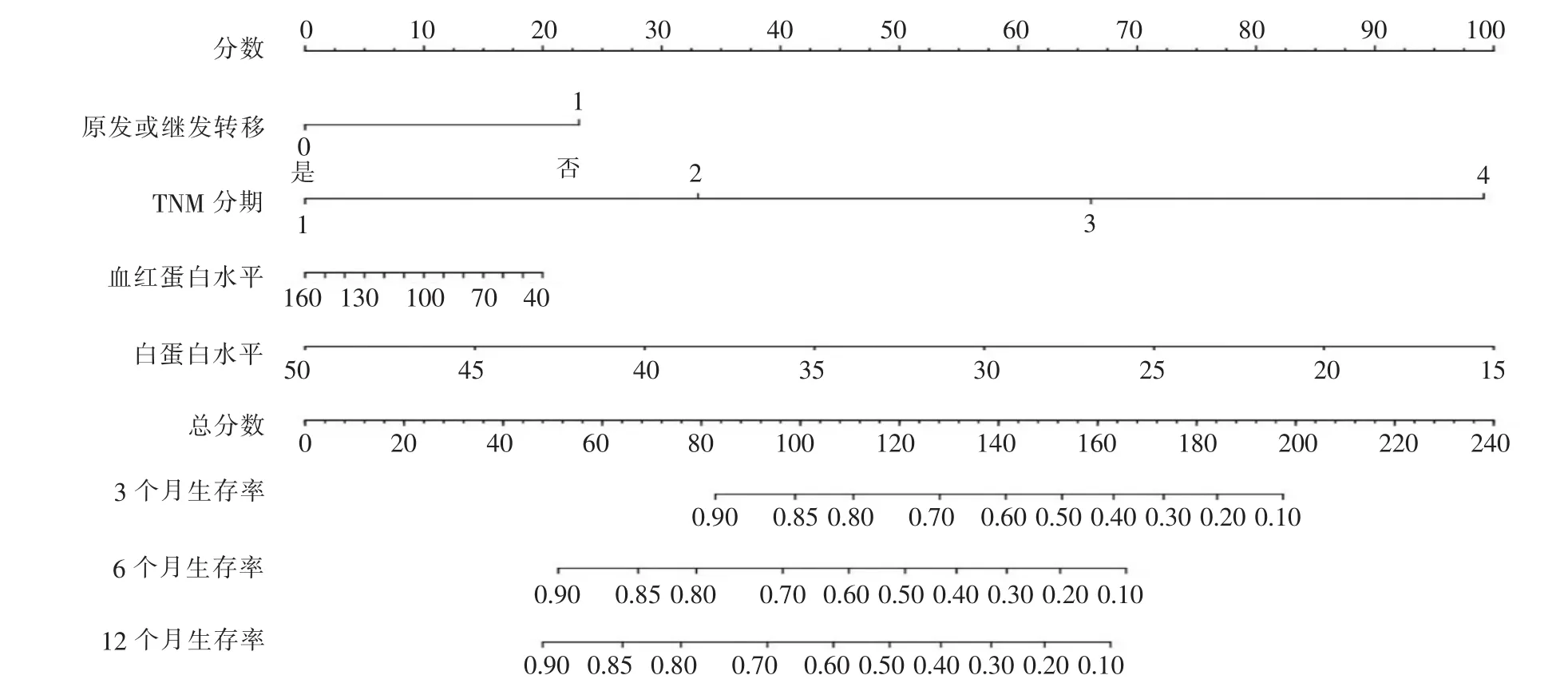
图1 多因素预测MBO病人生存期的列线图
七、验证列线图
采用内部验证方法,对模型进行验证。采用Bootstrap法从143例随访病人中随机抽取40例,对上述列线图进行验证,绘制预测3、6、12个月总生存的矫正曲线(见图2),以验证列线图内部真实性。X轴为列线图预测的MBO生存率,Y轴为研究队列中实际观察到的生存率。对角线即模型可完全正确预测实际生存率,是一种理想情况。根据校准图,该模型曲线与理想参考线比较接近,未观察到预测生存率与实际生存率的显著偏差,两者间差异无统计学意义(P=0.98),说明此列线图验证的一致性较好,未发生较大偏移。
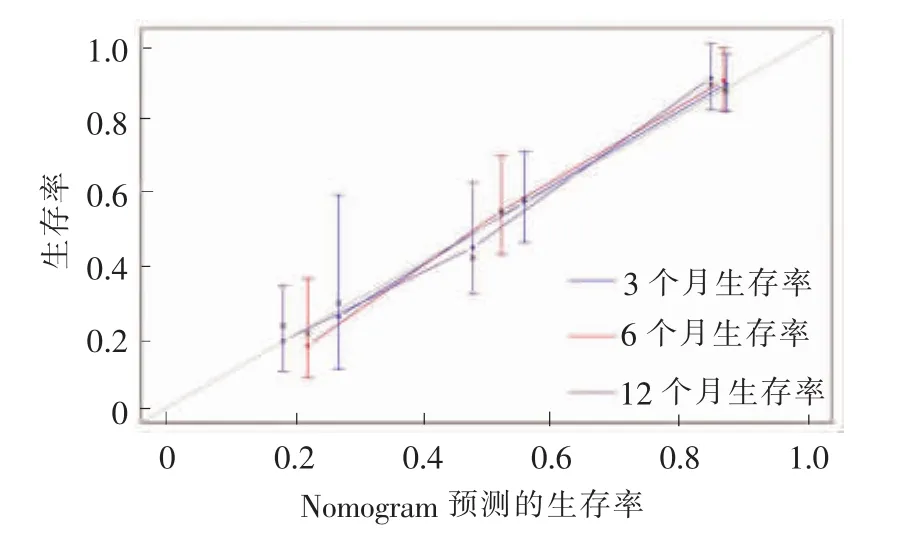
图2 列线图预测3、6、12个月总生存率的一致性验证
讨 论
MBO是目前临床上常见的肠梗阻之一,病情复杂,治疗较为棘手。目前对MBO相关预后因素的研究较少。本研究回顾性分析近6年MBO病人的入院情况、治疗方案、住院时间和总体生存率。
MBO多为机械性肠梗阻[13],主要病理生理变化表现为梗阻近端的肠管扩张。大量的食物、消化液和气体无法下行,导致水、电解质紊乱[14-15],从而引起与MBO相关的症状,如本研究描述的腹痛、腹胀、恶心呕吐、停止排气排便、排便困难等。如前所述,与MBO相关的常见腹腔内肿瘤是结肠直肠癌和卵巢癌。本研究也发现MBO病人常见的肿瘤为结肠直肠癌、胃癌,大体与之相符。有研究指出[16],结肠直肠癌发生MBO的75%以上梗阻位置在脾曲远端,最常见的部位是乙状结肠,本研究结果与此一致。
MBO治疗措施有保守治疗、内镜或手术治疗等。近年来生长抑素(如奥曲肽)的使用在MBO治疗中越来越重要。研究指出[17],奥曲肽可显著减少胃液的引流量,使大部分病人摆脱胃肠减压,在晚期MBO病人非手术治疗中具有重要作用。也有研究表明[18],与安慰剂组相比,奥曲肽在治疗72 h内未能显著减少呕吐,但多变量分析确实发现奥曲肽组的呕吐次数明显减少。在无更多研究前,仍建议在临床允许的情况下使用奥曲肽[19]。本研究也发现,近2年对生长抑素的使用明显增多。即便在本研究的单因素分析中,生长抑素的使用与MBO的预后无相关性,但生长抑素可抑制胃酸分泌、抑制胃肠道多种激素分泌、减少消化液产生,因而在此类病人中被广泛推荐。另外,肠内、外营养支持也越来越受到临床医师的重视。目前,积极保守治疗仍是治疗MBO的重要方式。
本研究发现,是否手术治疗是影响MBO预后的危险因素之一,但并非独立危险因素。研究表明,手术可改善MBO病人的生存率[20]。但是,非手术治疗的病人,可能由于存在严重合并症、肿瘤晚期广泛转移或其他手术禁忌证,而无法行手术治疗。这些因素本身就提示预后不良,后续需进一步研究分析,来评估手术治疗和非手术治疗以及不同的手术方式对其预后的影响。
已有研究证实,低蛋白血症和营养不良与MBO病人术后高死亡率有关[21]。研究指出,低蛋白血症会增加院内死亡率[22]。本研究评估影响MBO相关的预后因素发现,当肿瘤分期较晚、存在继发转移、白细胞水平较高、红细胞水平较低、血红蛋白水平较低、ALT水平较高、AST水平较高、白蛋白水平较低、前白蛋白水平较低、术后3个月生活质量评分较差,均提示预后很差。其中肿瘤分期、白蛋白水平是影响MBO预后的独立危险因素。因此,改善MBO病人的贫血、肝功能、营养状况和感染情况等对改善其预后具有重要意义。
同时,根据多种预后因素,绘制列线图,设计相关模型(见图1),以预测MBO病人的生存期,可更好地指导临床对MBO病人的预后评估和精准治疗。纳入肿瘤是否原发、肿瘤分期、白蛋白、血红蛋白水平4个因素。其中肿瘤分期、白蛋白水平是影响MBO预后的独立危险因素,而肿瘤是否原发与肿瘤分期有良好相关性。白蛋白对早期营养状况的改变比较敏感,长期机体消耗、营养不良导致贫血发生,故纳入此4个指标来评估。
总之,MBO病人病情危重,预后差,治疗非常困难。MBO因梗阻部位、梗阻程度、肿瘤分期分级、病情急缓以及病人本身伴随的基础疾病等因素差异甚大,治疗主要目标是减轻症状[23]。无论是姑息治疗还是手术治疗,都应遵循个体化治疗原则[24]。应评估每例病人的预后因素,根据具体情况和个体化原则来制定疗方案,尽量改善其预后情况。

