基于透明微针拉曼原位检测H2O2
彭 程,王 丰,杨海峰
(上海师范大学化学与材料科学学院,上海 200234)
0 引言
过氧化氢(H2O2)是一种活性氧(ROS)物种,参与体内重要的生理变化过程[1],其生理水平过高与炎症[2]、白癜风[3]等疾病相关.体内H2O2原位直接检测有望实现相关疾病的早期诊断.但由于H2O2的反应性高和半衰期短[4-5],发展高灵敏、无损(微创)的原位检测技术仍面临巨大挑战.迄今为止,对于H2O2的检测包括分光光度法[6-7]、荧光法[8-9]、比色法[10]和电化学方法[11-12],这些方法在体内的原位检测过程中,仍存在掩蔽剂的残留和需要破坏生物组织结构的问题.同时H2O2衰减速度过快,导致这些方法的原位检测仍然存在困难.
基于金纳米粒子(Au NPs)和银纳米粒子的表面增强拉曼(SERS)技术因具有灵敏度高、可实时检测的优点,已在生物传感器中获得应用[13].但是在SERS的检测过程中,纳米粒子在生物组织中的不稳定聚集会引起信号的差异,而纳米粒子的残留问题仍难以解决[14].同时,在生物组织深度信息检测中,SERS还存在检测深度不足的问题[15].
微针(MNs)是一种微创技术,最初的目的是用于透皮给药.本研究利用了高机械强度和高透光率的聚甲基丙烯酸甲酯微针(PMMA-MNs),其高机械强度能够穿透皮肤屏障;同时,高透光率解决了SERS检测深度不足的问题,能够进行原位检测[16].这种将MNs技术与SERS结合的思路也解决了纳米粒子的残留与信号不均匀的问题.在PMMA-MNs上修饰聚多巴胺(PDA)层,利用PDA的黏附性,能够在PMMA-MNs上修饰纳米粒子,同时其与离心技术的结合大大缩短了纳米金@聚多巴胺@微针(Au@PDA@MNs)基底的构建时间.随后,4-巯基苯硼酸(4-MPBA)被成功修饰在Au@PDA@MNs基底上,在H2O2的环境下,4-MPBA失去硼酸基团转变为4-羟基苯硫酚(4-HTP)[17],从而引起SERS信号的变化,如图1所示.1 000 cm-1和1 068 cm-1处拉曼信号强度比值(I1000/I1068)被用来检测H2O2的浓度[18].最后,以离体猪皮为检测对象,通过加标的方式成功在猪皮内检测出H2O2的浓度.这种原位检测策略为临床疾病的早期诊断提供了新平台,同时也为SERS光谱在生物医学上的应用提供了新思路.
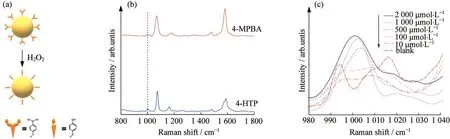
图1 H2O2敏感探针检测H2O2的示意图.
1 实验部分
1.1 主要试剂
四水氯金酸(HAuCl4·4H2O)、柠檬酸三钠(Na3Cit)、盐酸多巴胺(DA)、三羟甲基氨基甲烷(Tris·HCl)、30%H2O2、4-MBPA、4-HTP均购于阿拉丁(上海)有限公司;葡萄糖、罗丹明6G(R6G)、唾液酸、次氯酸钠(NaClO)、2,2-偶氮二(2-甲基丙脒)二盐酸盐(AAPH)均购于麦克林生物科技.光可交联的甲基丙烯酸甲酯(MMA)由Esun(中国深圳)公司提供.所有药品均为分析纯,实验过程所需水都是使用的超纯水.
1.2 主要仪器
S-4800型场发射扫描电子显微镜(FE-SEM),上海日立公司;紫外-可见分光光度计(UV-7504PC),上海欣茂仪器有限公司;离心机(H1650),湖南湘仪实验室仪器开发有限公司;Thermo DXR2xi,U.S.A.,激发光波长633 nm,激光功率为4.0 mW,曝光时间为0.05 s,扫描次数为500次.
1.3 PMMA-MNs的制备
将MMA溶液倒入聚二甲基硅氧烷(PDMS)模具中,真空脱气,紫外光照射1.5 min后,将聚甲基丙烯酸甲酯-微针(PMMA-MNs)从PDMS模具中分离出来.阵列中的每个MNs高度为450 μm,底部直径为250 μm.
1.4 Au NPs的制备
Au NPs的制备参考LEE等[19]的方法:1 mL 1%(质量分数)的HAuCl4·4H2O加入到100 mL超纯水中,搅拌煮沸后加入1.5 mL 1%(质量分数)的Na3Cit.搅拌煮沸30 min后停止加热,搅拌冷却至室温,最后4℃冷藏待用.
1.5 H2O2敏感探针的构建
将PMMA-MNs用乙醇洗去未反应的单体,0.02 g的多巴胺溶解在10 mL的Tris-HCl溶液中,随后将洗净后的PMMA-MNs浸泡在多巴胺溶液中,2 h后取出冲洗干净备用.在包覆PDA的PMMA-MNs中加入1 mL的Au NPs,控制离心转速4 000 r·min-1,离心时间5 min,最后将制备好的Au@PDA@MNs洗净备用.
称取0.05 g的4-MPBA和0.05 g的4-HTP分别溶解在10 mL的乙醇溶液中备用,随后取1 mL上述溶液加入到Au@PDA@MNs基底中,反应30 min后取出用超纯水洗净备用.
1.6 离体猪皮内的H2O2的检测
取一块1 cm×1 cm的离体猪皮样品,将其浸入100 μmol·L-1的H2O2溶液中,30 min后取出,用超纯水将表面的H2O2洗净,干燥后备用.随后将制备好的H2O2敏感探针插入猪皮中,让其反应5 min后获得SERS光谱.原始SERS光谱被导入LabSpec5软件,并使用Savitzky-Golay卷积算法进行平滑.
2 结果与讨论
2.1 Au@PDA@MNs的构建和表征
合成的Au NPs的紫外吸收光谱如图2(a)所示,在522 nm处表现强的吸收峰,表明合成的Au NPs的粒径大约为40 nm[20].Au@PDA@MNs的FE-SEM放大图也证实了Au NPs的粒径大小,如图2(b)所示.利用PDA的黏附性和控制离心转数、时间可以在MNs表面成功修饰Au NPs,并且可以避免Au NPs的团聚,原因可能是这种离心力克服了Au NPs、PDA以及纳米粒子之间的静电斥力;同时,Au NPs和PDA的黏附力克服了Au NPs的重力.图2(c)的能谱分析(EDS)图也证实了Au@PDA@MNs的成功制备.随后,以R6G为拉曼信号分子,研究了Au@PDA@MNs的SERS增强效果,证实了Au@PDA@MNs的SERS增强效果,如图2(d)所示.
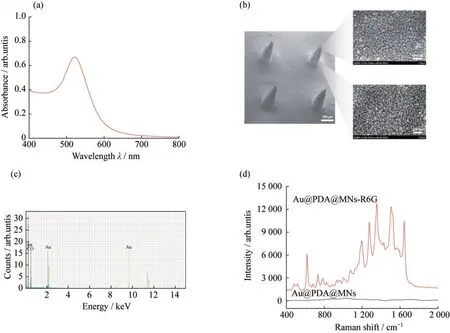
图2 Au@PDA@MNs的表征.(a)Au NPs的紫外吸收光谱图(最大吸收峰在522 nm);(b)Au@PDA@MNs的FE-SEM图;(c)Au@PDA@MNs的EDS图;(d)Au@PDA@MNs的拉曼光谱图(10-5 mol·L-1的R6G作为拉曼信号分子)
2.2 Au@PDA@MNs的条件优化
分别控制加入的Au NPs的量、离心的转速和离心的时间,研究Au@PDA@MNs的SERS增强效果,3种条件优化的拉曼光谱图如图3(a)~3(c)所示.当Au NPs加入量为1 mL时,SERS信号最好,如图3(d)所示.离心的时间为5 min时的SERS信号最佳,如图3(e)所示.图3(f)表明当离心转数为4 000 r·min-1时,SERS信号最佳.其原因可能是随着加入Au NPs量过多、转速过快或离心时间过长,会引起更多纳米粒子的团聚,纳米粒子之间的距离过近,导致有效热点数目降低;加入的Au NPs量过少、转速过慢和离心时间过短,纳米粒子间的距离变远,有效热点数目不足[21].结果表明:Au@PDA@MNs的制备过程中控制Au NPs加入量为1 mL、离心转速为4 000 r·min-1、离心时间为5 min时的SERS信号最佳.
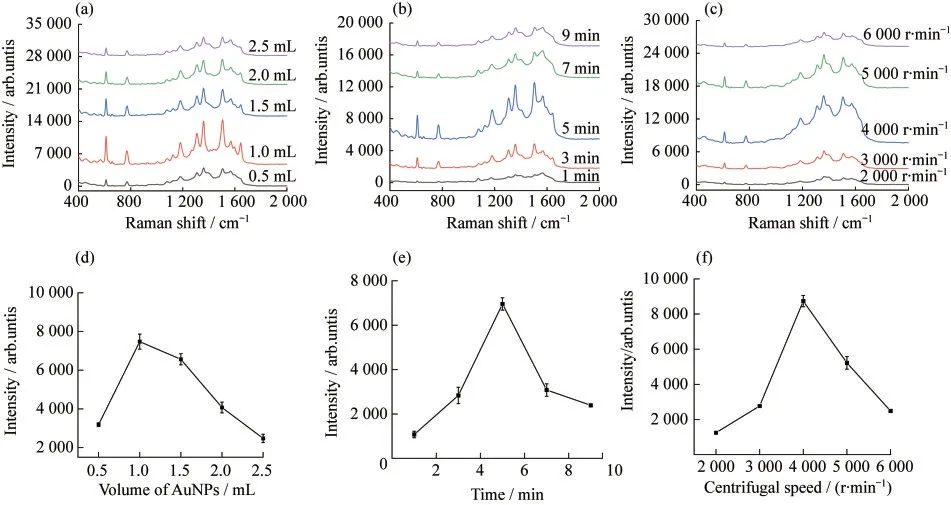
图3 不同(a)Au NPs的加入量、(b)离心的时间和(c)离心的转速的拉曼光谱图(10-5 mol·L-1的R6G作为拉曼信号分子),以及不同(d)Au NPs的量、(e)离心时间和(f)离心转速对1 510 cm-1处SERS的影响
2.3 Au@PDA@MNs的SERS性能考察
由于Au@PDA@MNs的SERS性能影响着检测的灵敏度,因此考察优化后的Au@PDA@MNs的SERS性能很有必要.如图4所示,以不同物质的量浓度的R6G作为拉曼信号分子,研究了Au@PDA@MNs的灵敏度,结果表明:Au@PDA@MNs在10-4~10-8mol·L-1的范围内有良好的线性响应,其检测限(LOD)为3.1×10-10mol·L-1.
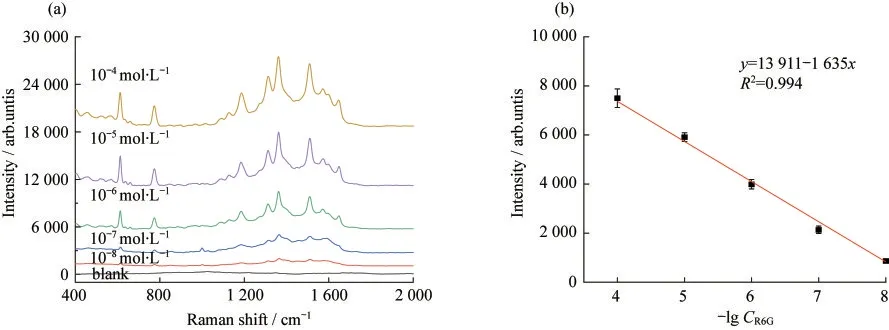
图4 Au@PDA@MNs在不同物质(CR6G)的量浓度的R6G下的(a)拉曼光谱图和(b)校准曲线
2.4 H2O2敏感探针的构建
通过将4-MPBA修饰在Au@PDA@MNs上,成功构建了H2O2敏感探针.如图1所示,其在997 cm-1和1 011 cm-1处的2个峰归因于B—O的对称伸缩和B—O—H在硼酸上的变形振动[18].在1 068 cm-1和1 562 cm-1处的另外2个峰被指定为苯环上C—H的平面变形和苯环上C=C的伸缩振动[17].随后,将4-HTP也修饰在Au@PDA@MNs上,研究了4-MPBA与4-HTP的变化情况,其1 000 cm-1归因于C—C和C—C—C的拉伸振动[22].在H2O2的环境下,4-MPBA会失去硼酸基团,转变为羟基基团,从而引起997,1 011和1 000 cm-1拉曼峰位和峰强的变化,因此,1 000 cm-1和1 068 cm-1处拉曼信号强度比(I1000/I1068)的变化可用于定量检测H2O2的浓度.
2.5 H2O2敏感探针原位检测
分别配制10,100,500,1 000和2 000 μmol·L-1的H2O2溶液,研究了H2O2敏感探针的检测性能.如图5所示,H2O2敏感探针的校准曲线为y=0.000 06x+0.113,范围在10~2 000 μmol·L-1内有响应,其LOD为0.93 μmol·L-1.随后,分别研究了1 000 μmol·L-1的ClO-、NO、·OH、葡萄糖、葡萄糖酸和谷胱甘肽对H2O2敏感探针检测的干扰.图6表明这些物质对H2O2检测干扰较小,原因可能ClO-、NO、葡萄糖酸和谷胱甘肽具有还原性,无法与硼酸基团发生反应.相比于H2O2,葡萄糖的氧化性较弱,正如文献报道一样[17],氧化性较强的·OH干扰也较小.最后,以离体猪皮作为检测对象,将H2O2敏感探针小心插入猪皮,反应5 min后采取SERS数据.如图7所示,加标后H2O2敏感探针的SERS比值为0.12,由校准曲线可知,检测的H2O2的物质的量浓度为117 μmol·L-1,结果基本准确,说明H2O2敏感探针可以很好地用于H2O2的原位检测.不仅如此,通过修饰其他拉曼活性反应物,这种MNs型SERS基底可以作为原位检测平台,用于其他生物标志物和生理生化指标的原位微创检测.
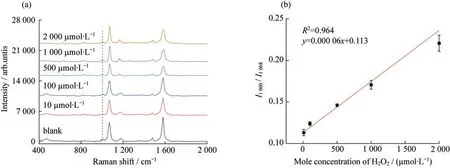
图5 H2O2敏感探针检测不同浓度的H2O2.
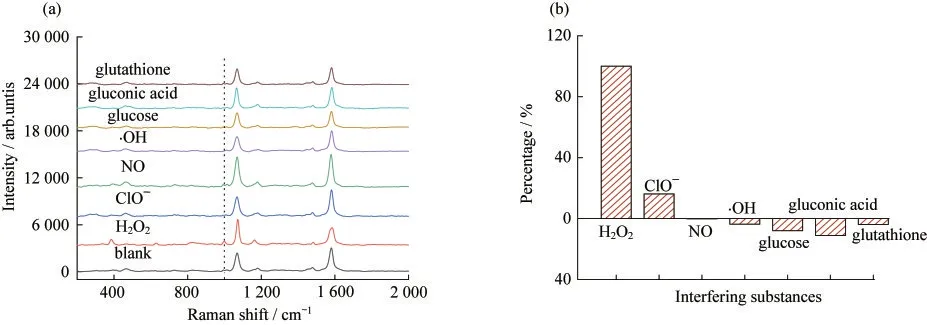
图6 各种干扰物质(1 000 μmol·L-1)对H2O2敏感探针的SERS响应的(a)影响及(b)干扰程度
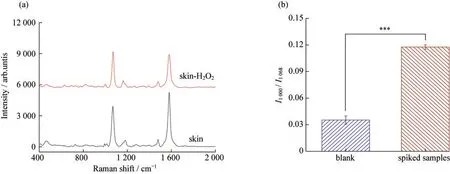
图7 加标100 μmol·L-1的H2O2溶液后(a)空白和加标离体猪皮的拉曼光谱图;(b)空白和加标离体猪皮的I1 000/I1 068的值(***表示p<0.001,有显著差异)
3 结论
基于高透光率和高机械强度的PMMA-MNs,利用PDA的黏附性在MNs表面修饰Au NPs,成功构建了Au@PDA@MNs SERS基底,离心技术的结合大大缩短了Au@PDA@MNs SERS基底的构建时间.研究发现,在加入的Au NPs量为1 mL、离心转速为4 000 r·min-1和离心时间为5 min时,SERS增强效果最佳.以R6G为拉曼信号分子,Au@PDA@MNs的检测线性范围为10-4~10-8mol·L-1,LOD为3.1×10-10mol·L-1.在Au@PDA@MNs基底上修饰4-MPBA后成功构建了H2O2敏感探针,用I1000/I1068的SERS强度比值可定量检测H2O2的物质的量浓度.其线性范围为10~2 000 μmol·L-1,LOD为0.9 μmol·L-1.最后,以离体猪皮作为检测对象,加入100 μmol·L-1的H2O2溶液,通过将H2O2敏感探针插入猪皮中,反应5 min后测定SERS光谱图,其I1000/I1068的比值表明其物质的量浓度为117 μmol·L-1,检测结果与加标浓度基本一致.这种将激光透明的MNs和SERS技术结合的思路,为将来体内生理和病理变化的原位检测提供新平台,也为未来的临床疾病的早期诊断提供新的思路.

