EMRE在高糖环境中的变化对心肌细胞凋亡机制的研究
曹兴丹 陈子仪 宋小刚 张玉秀 陈敏 汤吉超 李萍萍 荆哲 陈永清
(1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000;2.中国人民解放军联勤保障部队第九四〇医院基础医学实验室 甘肃省干细胞与基因药物重点实验室,甘肃 兰州 730050;3.中国人民解放军联勤保障部队第九四〇医院心血管内科,甘肃 兰州 730050;4.甘肃省中心医院心血管内科,甘肃 兰州 730070)
糖尿病已成为全球问题,并已迅速进展为全球增长最快的疾病之一,预计2045年约有6.93亿成年人将受到该疾病的影响[1],全球成人糖尿病患病率已从1980年的4.7%上升至2014年的8.5%[2]。而在糖尿病患者中心血管疾病是其主要的并发症之一,尤其是糖尿病心肌病(diabetic cardiomyopathy,DCM),其发病率和死亡率逐年升高,与此同时它也是糖尿病患者死亡的主要原因[3-5]。研究[6-7]指出由于机体长期慢性暴露于高血糖环境中,可诱导心肌组织和细胞代谢紊乱,导致心脏结构的改变,尤其是左心室壁僵硬和左心室功能障碍,最终引起心力衰竭的发生。而在这一过程中,心肌细胞凋亡或坏死是引发DCM的关键致病因素,但具体的分子机制目前尚不清楚。以往研究[8]发现,与钙稳态失衡和氧化应激所致的活性氧(reactive oxygen species,ROS)增加有关的线粒体功能紊乱,可能在参与心肌细胞凋亡途径中起主导作用。其中一个重要的分子钙调节蛋白,即线粒体钙单向转运活性体必须蛋白(essential mitochondrail calcium uniporter regulator,EMRE),可作为线粒体钙摄取的关键分子[9],并与线粒体钙离子单向转运体(mitochondrial calcium uniporter,MCU)、线粒体钙离子摄入蛋白1(mitochondrial calcium uptake 1,MICU1)等共同构成钙通道复合体[10-13],维持线粒体钙稳态,从而影响细胞凋亡。既往研究[14]发现,在高糖高脂诱导小鼠心肌细胞内EMRE表达升高,ROS生成增多,进而促进了心肌细胞凋亡。这只是一个对EMRE分子表达的初步探究,它与细胞的凋亡关系及对细胞凋亡的影响机制需进一步探讨。本实验通过对糖尿病小鼠和高糖诱导的H9c2心肌细胞中EMRE的表达情况,以及相关凋亡因子、线粒体ATP浓度、ROS、细胞凋亡等的水平进行检测,进一步探究EMRE在高糖环境下心肌细胞内的表达水平及其参与心肌细胞凋亡过程的可能机制,为今后在DCM的靶点治疗方面提供新思路与策略。
1 材料与方法
1.1 材料
db/db糖尿病小鼠和野生型(wild type,WT)小鼠均购买自常州卡文思实验动物有限公司。H9c2心肌细胞购自中国科学院典型培养物保藏委员会细胞库。DMEM培养基、蛋白浓度测定试剂盒、线粒体分离试剂盒、ECL Plus超敏发光液均购自索莱宝生物科技有限公司;胎牛血清购自杭州四季青生物有限公司,胰酶EDTA溶液购自上海源培生物有限公司,EMRE抗体、caspase-3、Bax、caspase-9、细胞色素c(cytochrome c,Cyto-c)、MCL-1抗体以及兔抗鼠β-actin多克隆抗体购自Affinity Biosciences公司,SteadyPure通用型RNA提取试剂盒、SYBR Green Pro Taq HS预混型qPCR试剂盒购自艾科瑞生物有限公司,ATP检测试剂盒、α-酮戊二酸脱氢酶(α-ketoglutarate dehydrogenase,α-KGDH)活性检测试剂盒、ROS检测试剂盒均购自上海碧云天生物技术有限公司,小干扰RNA(small interfering RNA,siRNA)购自上海吉马公司。
1.2 方法
1.2.1 实验分组
实验分为两部分:(1)将购买来的db/db糖尿病小鼠及WT小鼠各6只,在相同条件下饲养18周,每组随机选取3只,提取心肌组织蛋白及RNA,利用蛋白质印迹法及实时荧光定量聚合酶链反应(real-time fluorescence quantitative PCR,RT-qPCR)检测EMRE的表达情况,免疫组织化学法检测EMRE的表达水平,小动物超声仪检测小鼠的心脏功能。(2)将H9c2心肌细胞随机分为四组,即正常组(NG,培养基中含5.5 mmol/L葡萄糖),高糖组(HG,培养基中含33 mmol/L葡萄糖),高糖+阴性对照组(HG+NC siRNA,培养基中含33 mmol/L葡萄糖+阴性对照siRNA),高糖+转染EMRE组(HG+EMRE siRNA,培养基中含33 mmol/L葡萄糖+转染EMRE siRNA),将细胞置于T25培养瓶中,培养条件为37 ℃,5% CO2,pH值维持在7.3~7.5,无菌恒温培养24 h,观察细胞生长状态,当细胞生长至75%~80%后可进行下一步实验。
1.2.2 蛋白质印迹法检测蛋白表达水平
(1)心肌组织EMRE蛋白表达水平检测。将实验动物处死后,剪取每组动物的心肌组织40~50 mg,预冷的磷酸盐缓冲液(phosphate buffer solution,PBS)清洗两次,滤纸吸干血迹,利用研磨仪研磨组织,充分研磨组织至匀浆状态,再次经过PBS清洗后,加入组织裂解液,冰上裂解0.5 h后,4 ℃离心,取上清液,进行蛋白浓度测定,根据蛋白浓度计算出每个样品可取25 μg,分别加入已配置好的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)中,完成电泳。然后根据所需蛋白分子量大小设置转膜时间及电压,转膜至聚偏二氟乙烯膜后利用5%脱脂牛奶封闭1 h,最后对膜进行漂洗,孵育一抗,4 ℃摇床过夜,次日再次孵育二抗2 h,最后曝光显影。
(2)H9c2心肌细胞EMRE蛋白表达水平检测。用细胞裂解液提取各实验组细胞中的蛋白,并做好标记,利用BCA蛋白浓度测定试剂盒检测每组细胞提取的蛋白浓度,并采用蛋白质印迹法检测蛋白表达水平,检测方法同1.2.1。
(3)H9c2心肌细胞线粒体蛋白表达水平检测。将实验细胞用4 ℃预冷的PBS清洗后,用胰酶消化液消化细胞并收集至离心管内,室温离心5~10 min,添加含苯甲基磺酰氟的线粒体分离试剂,冰浴静置10~15 min。利用玻璃匀浆器匀浆后,4 ℃离心10 min。取上清液,4 ℃、10 000 r/min离心10 min,弃上清液,沉淀为得到的细胞线粒体。在分离得到的线粒体样品中可加入150~200 μL的线粒体裂解液裂解线粒体。裂解后的线粒体蛋白样品可用于线粒体蛋白浓度测定,采用蛋白质印迹法检测蛋白表达,检测方法同1.2.1。
1.2.3 RT-qPCR法检测mRNA的表达水平
将实验动物处死后,剪取其小鼠前壁心肌组织,利用匀浆器匀浆处理后,利用SteadyPure通用型RNA提取试剂盒提取所需mRNA,将提取的RNA进行反转录形成cDNA后,利用SYBR-Green嵌合荧光法进行qPCR反应。用于qPCR反应的目的基因EMRE引物上游序列为:5’-TCCGATTGATCCCCTTTCTC-3,下游序列为5’-GCTTTCCTTGZCCCTTCTGC-3’,内参基因GAPDH的上游序列为5’-GGCACAGTCAAGGCTGAGAATG-3’,下游序列为5’-ATGGTGGTGAAGACGCCAGTA-3’。反应条件为95 ℃,30 s,1个循环;95 ℃,5 s以及60 ℃,30 s,分别40个循环,反应完成后,用GraphPad Prism 8进行数据分析。
1.2.4 免疫组织化学法检测EMRE的表达水平
剪取处死后的实验组小鼠的前壁心肌组织,并经过甲醛固定、酒精脱水、二甲苯透明以及浸蜡、包埋、切片、烤片处理后,再次进行组织切片脱蜡水化,高温高压抗原修复2 min,然后利用过氧化氢溶液浸泡15 min,一抗4 ℃孵育过夜,二抗37 ℃孵育20 min,二氨基联苯胺显色,之后进行苏木精溶液复染,脱水、封片处理,最后镜检观察。
1.2.5 小动物超声仪检测心脏功能
对实验小鼠备皮,并给予小鼠吸入异氟烷进行麻醉,选用美国Visualsonics公司的超高分辨率小动物超声影像系统进行小鼠心脏功能检测,利用Vevo 2100软件进行数据分析,并计算小鼠左室射血分数(left ventricular ejection fraction,LVEF)及左心室短轴缩短率(left ventricular fraction shortening,LVFS)大小。
1.2.6 流式细胞术检测心肌细胞凋亡率
将汇合度已达到90%且生长状态良好的实验细胞利用胰酶消化后收集到离心管内,1 000 r/min,4 ℃离心5 min,弃上清液,PBS重悬细胞后,置于高速离心机中1 000 r/min离心5 min,缓冲液重悬细胞后取10 μL Annexin V-FITC细胞凋亡检测荧光试剂滴加至细胞悬液中,同时再滴加入5 μL细胞核酸染料碘化丙啶,充分混合,避光条件下,室温反应15 min,利用流式细胞仪检测细胞凋亡率。
1.2.7 线粒体ATP水平检测
将六孔板中每个样品孔内加入200 μL的细胞裂解液,细胞裂解完成后,置于高速离心机中,4 ℃,12 000 r/min离心5 min,然后各吸取20 μL ATP标准稀释液及ATP检测工作液200 μL加入样品孔中。用酶标仪进行检测,制备标准曲线,计算ATP浓度。
1.2.8 线粒体α-KGDH活性检测
根据α-KGDH活性检测试剂盒说明进行操作,取500万细胞,匀浆器充分研磨,4 ℃,11 000 r/min离心10 min,取200 μL的工作液加入检测样品中,37 ℃孵育5 min后再加入酶活性检测试剂8 μL和12 μL蒸馏水,混匀并立即测量340 nm处0 s的吸光值及340 nm处2 min时的吸光值,最后根据吸光值计算α-KGDH活性。
1.2.9 细胞ROS水平检测
根据ROS检测试剂盒说明,用无血清培养液稀释活性氧荧光探针(DCFH-DA)试剂,将稀释好的DCFH-DA工作液加入六孔板中,恒温细胞培养箱内孵育20 min,最后利用Hank’s平衡盐缓冲液清洗3次,荧光显微镜拍照记录。
1.2.10 统计学处理
使用GraphPad Prism 8软件进行数据统计学分析,用均数±标准差表示各组数据,两组之间的比较采用独立样本t检验,多组之间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 EMRE表达水平与糖尿病小鼠心脏功能的关系
蛋白质印迹法结果显示,与WT组小鼠比较,db/db小鼠组小鼠心肌中EMRE蛋白表达水平升高(P<0.01),见图1A。RT-qPCR检测结果显示,与WT组小鼠比较,db/db小鼠组心肌中EMRE mRNA表达水平升高(P<0.01),见图1B。免疫组织化学法检测结果显示,与WT组小鼠相比较,EMRE表达水平在糖尿病小鼠心肌组织中升高,见图1C。对db/db糖尿病小鼠及WT小鼠进行活体小动物超声检测,与WT组小鼠相比较,db/db糖尿病小鼠组小鼠LVEF降低、LVFS降低(P<0.01),见图2。结果提示:db/db糖尿病小鼠心肌中EMRE的表达升高,可能导致糖尿病小鼠心脏收缩功能降低。

注:图A为EMRE蛋白表达情况(***表示P<0.001);图B为EMRE mRNA表达情况(***表示P<0.001);图C为免疫组织化学法检测EMRE的表达情况(200x),n=6。
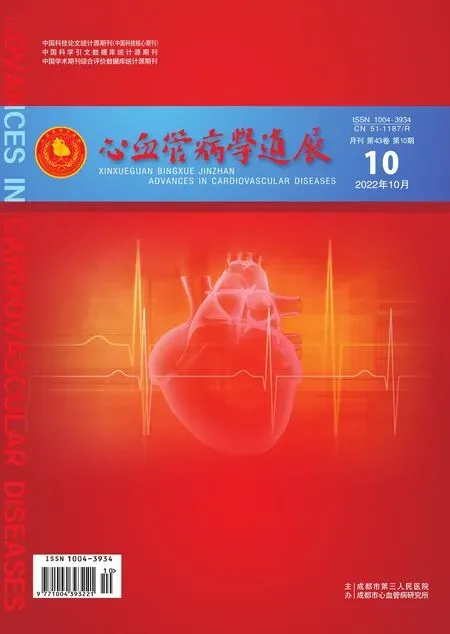
注:图A为小动物超声左心室短轴M型图像;图B为两组小鼠LVEF值;图C为两组小鼠LVFS值;**表示P<0.01。
2.2 下调EMRE表达对H9c2心肌细胞凋亡的影响
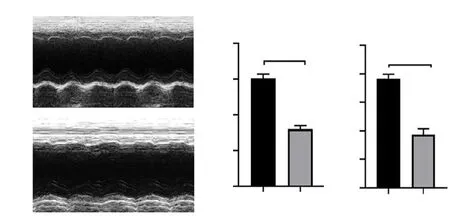
下调高糖环境下H9c2心肌细胞中EMRE的表达,蛋白质印迹法结果显示,与NG组相比较,HG组中H9c2心肌细胞EMRE蛋白的表达水平升高(P<0.01),HG+EMRE siRNA组,H9c2心肌细胞中促凋亡蛋白caspase-3表达下降(P<0.01),见图3;与NG组相比较,HG组H9c2心肌细胞中凋亡蛋白caspase-9、Bax表达升高(P<0.001,P<0.01),凋亡拮抗蛋白MCL-1表达受到抑制(P<0.01),而HG+EMRE siRNA组,促凋亡蛋白caspase-9、Bax表达下降(P<0.05,P<0.01),MCL-1蛋白表达升高(P<0.05),见图4;HG组H9c2心肌细胞线粒体凋亡蛋白Cyto-c表达升高(P<0.001),HG+EMRE siRNA组中Cyto-c表达下降(P<0.05),见图5。流式细胞术检测心肌细胞凋亡结果显示,与NG组相比较,HG组心肌细胞的凋亡水平升高,而HG+EMRE siRNA组中H9c2心肌细胞凋亡水平下降,见图6。结果提示:高糖环境可诱导H9c2心肌细胞发生线粒体内源性途径凋亡,下调EMRE的表达可抑制H9c2心肌细胞凋亡。

注:**表示P<0.01;***表示P<0.001。

注:*表示P<0.5;**表示P<0.01;***表示P<0.001。

注:PI,线胞核染料碘化丙啶。
2.3 下调EMRE表达对H9c2心肌细胞线粒体ATP生成的影响
利用ATP检测试剂盒进行检测结果显示,与NG组相比较,高糖环境下ATP浓度明显下降(P<0.01),而下调EMRE表达后,ATP浓度较HG升高(P<0.01)。利用α-KGDH活性检测试剂盒对α-KGDH活性进行检测结果显示,与NG组相比较,高糖环境下α-KGDH活性下降,下调EMRE表达后,可增加α-KGDH活性(P<0.01),见图7。结果提示:下调EMRE的表达可激活α-KGDH活性,促进ATP生成。
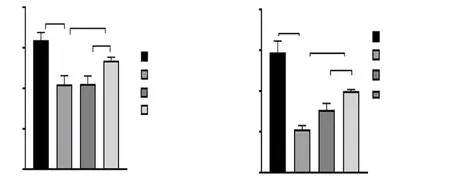
注:图A为线粒体ATP浓度;图B为α-KGDH活性;**表示P<0.01。
2.4 下调EMRE促进H9c2心肌细胞ROS的生成
利用ROS检测试剂盒进行检测结果显示,与NG组相比,高糖环境下ROS的水平明显升高(P<0.01),当下调EMRE表达后,ROS水平较前明显降低(P<0.01),见图8。结果提示:下调EMRE表达可抑制H9c2心肌细胞ROS生成。
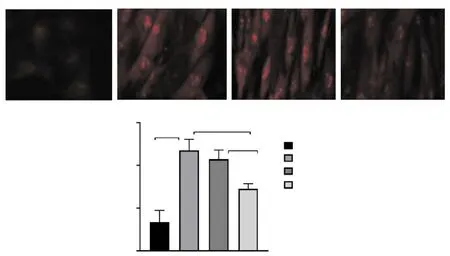
注:**表示P<0.01。
3 讨论
糖尿病是以慢性高血糖为特征,导致细胞运输和利用葡萄糖能力障碍的异质性代谢紊乱疾病[15-16]。其目前是健康人群罹患心血管疾病的重要危险因素,其中DCM是其主要的并发症,现已成为糖尿病患者死亡的主要原因[17-19]。因此DCM也日益成为人们关注的健康问题。它是一种由慢性高糖环境诱导心肌细胞发生结构和功能的改变,最终导致患者发生心力衰竭甚至死亡的疾病[20]。高血糖已被证实可通过一些有害机制参与心脏的代谢和功能改变,从而激活细胞凋亡过程[21]。而在高血糖诱导心功能损害的病理机制中,线粒体钙稳态是维持细胞内环境稳态的决定因素之一,也是细胞存活和凋亡通路的信号枢纽[22]。同时,研究[23]发现EMRE作为线粒体钙摄取的关键分子,其表达活性的异常可能会导致线粒体钙摄取异常,进而影响线粒体功能,诱导细胞凋亡。其功能的丧失可能将破坏细胞钙稳态,影响细胞功能[24]。但是EMRE在高糖环境下是如何影响线粒体功能进而参与心肌细胞凋亡的发生,当改变EMRE表达活性后又将如何影响心肌细胞凋亡,这些机制目前尚不清楚。本研究拟以糖尿病状态下EMRE的表达变化及机制,围绕EMRE对线粒体功能及其对线粒体氧化应激的调控,探讨心肌细胞凋亡发生的新机制。
为探究EMRE在高糖环境中的变化,对db/db和WT小鼠心肌组织中EMRE表达进行了初步检测,结果发现db/db小鼠心肌组织中EMRE表达升高,同时利用小动物超声功能检测发现db/db小鼠的心脏收缩功能降低。通过上述实验研究初步了解到糖尿病环境可使EMRE的表达水平升高。为了明确EMRE活性与心肌细胞凋亡之间的关系及相关凋亡机制,以高糖环境培养的H9c2心肌细胞作为模型,观察其对EMRE及凋亡相关蛋白表达水平的影响。结果显示:EMRE蛋白的表达水平升高,同时促凋亡蛋白caspase-3、caspase-9以及Bax、Cyto-c的表达水平也明显升高,而抗凋亡蛋白MCL-1的表达水平明显受到抑制,细胞的凋亡水平也显著升高,因此EMRE在高糖环境中可能参与介导细胞的凋亡途径。在对凋亡途径的研究[25-27]中发现MCL-1蛋白家族参与控制内源性(线粒体)途径,并通过MCL-1相关蛋白参与到线粒体外膜渗透中来,然后引起线粒体Cyto-c的释放,最终激活巯基蛋白酶家族成员caspase-3、caspase-9等凋亡信号分子。本实验结果也提示高糖环境下诱导H9c2心肌细胞凋亡途径中存在线粒体内源性途径,随着EMRE蛋白分子的表达升高,线粒体内源性凋亡蛋白被进一步激活,进而促进了细胞的凋亡。为进一步验证EMRE表达变化对心肌细胞凋亡的影响作用,利用siRNA下调高糖环境下EMRE的表达,结果显示:下调EMRE表达后,心肌细胞的内源性凋亡受到抑制。这也更深入地证实了高糖环境可诱导EMRE的表达升高,促进了细胞内源性凋亡,而下调其表达活性后,细胞的凋亡将受到抑制。
作为心肌细胞凋亡的关键分子EMRE,在高糖环境培养的心肌细胞中其表达明显升高,EMRE可能通过细胞内源性凋亡途径影响心肌细胞凋亡。本实验在对其具体凋亡机制的研究中发现,在高糖诱导的心肌细胞中,EMRE的表达水平升高后,心肌细胞线粒体合成ATP的能力下降,参与三羧酸循环的关键酶α-KGDH活性减弱,ROS水平升高,细胞凋亡水平也升高。因此高糖诱导的心肌细胞的凋亡中,EMRE作为细胞凋亡的关键分子,其表达活性的升高,可能诱导了线粒体功能发生障碍,然而研究发现当线粒体功能下降,线粒体受损时,细胞内ROS的含量显著增加[28],这也进一步促进了细胞凋亡。线粒体在许多重要的细胞正常生理功能中发挥作用,不仅通过氧化磷酸化产生ATP,同时也产生与细胞损伤有关的活性物质ROS[29-30]。线粒体是ROS产生的主要部位,研究发现随着ROS生成的增多,氧化应激反应也进一步被激活,当机体内线粒体抗氧化系统不能维持内环境的稳定状态时,细胞内增加的氧化损伤会导致线粒体内解耦联蛋白及酶、脂类和蛋白质等的结构改变,从而导致ATP合成能力下降,线粒体功能严重受损,细胞活性也将受到极大影响[31]。因此,在高糖环境下,EMRE也成为了导致线粒体功能障碍的活化分子,通过增强氧化应激反应来损伤线粒体能量合成,破坏线粒体功能,因此EMRE分子的表达升高起了主导作用,诱导了细胞凋亡的发生。
综上所述,高糖环境促进线粒体凋亡途径信号异常,从而诱导心肌细胞的凋亡,而EMRE的过表达在这一途径中发挥了重要作用,这可能是DCM发生的重要机制之一。从本研究中发现EMRE的表达改变影响了线粒体功能,进而影响心肌细胞凋亡,其对线粒体功能的影响是通过多方面因素来发挥作用,目前只在能量代谢这一方面做了初步的研究,此外还存在如线粒体钙摄取发生异常、线粒体自噬异常、氧化应激反应等,均需进一步长期深入的探究。同时在实验中对线粒体功能的改变观察也较少,需在后续的实验中进行深入研究,此外还需采取更多样化的研究方式,如对糖尿病小鼠采用敲除目的基因的方法,以探究EMRE上游转录调控分子对细胞凋亡的影响,为今后基因靶向治疗提供更重要的指导作用。