从腔内影像学进展探讨冠状动脉易损斑块的临床意义
刘春伟 胡越成 张敬霞 王林 丛洪良
(天津市胸科医院心内科,天津 300222)
冠状动脉粥样硬化性心脏病是目前全球范围内严重威胁人类健康的重大疾病,预防急性冠状动脉事件是公共健康预防领域的重要课题。对急性冠状动脉事件高危人群的准确识别是一项重要且富有挑战性的工作。早期尸检结果显示,60%~75%的急性心肌梗死是由易损斑块破裂继发血栓形成导致,大量研究关注于易损斑块的影像特点,希望通过腔内影像学斑块特点预测患者临床事件风险[1]。但近年来很多研究发现,易损斑块作为预测指标较传统指标并未增加临床事件的预测能力。现总结近年来有关易损斑块的众多腔内影像学临床研究,探讨其在冠状动脉粥样硬化疾病中的意义。
1 易损斑块腔内影像学检测对临床事件的预测价值
广义的易损斑块定义包括了所有具有破裂倾向、易于形成血栓及可能快速进展为“罪犯斑块”的动脉粥样硬化斑块,可分为易破裂斑块、易侵蚀斑块及钙化结节等。而影像学上易损斑块的特点包括:覆盖薄纤维帽(<65 μm)的大脂质坏死核心、丰富的炎症细胞浸润、散在的钙化结节、新生血管以及正性重构。具有以上特点的斑块通常称为薄纤维帽粥样硬化斑块(thin-cap fibroatheroma,TCFA)[2]。TCFA的部分特征(斑块容积和斑块节段重构)可通过CT等无创影像学方法检测,而纤维帽厚度(fibrous cap thickness,FCT)、脂质核心等特征的准确检测依赖于腔内影像学方法(表1)。
1.1 血管内超声对易损斑块的检测
PROSPECT研究[3]和VIVA研究[4]是最早应用血管内超声(intravascular ultrasound,IVUS)检测冠状动脉三支血管非靶病变斑块与主要不良心血管事件(major adverse cardiovascular events,MACE)的前瞻性实验,在PROSPECT研究中,TCFA定义为持续三帧坏死核心>10%和坏死核心弧度>36 °。最小管腔面积(minimal lumen area,MLA)<4 mm2,斑块负荷(plaque burden,PB)>70%和TCFA是非靶病变血管发生MACE的三项预测因子。虽然有TCFA患者较无TCFA患者MACE增加,但其阳性率过低(<5%的易损斑块在3.4年的随访中发生冠状动脉事件)。同时,尽管PROSPECT研究纳入人群多为急性冠脉综合征(acute coronary syndrome,ACS)等高危患者,但其终点事件多为心绞痛再住院而非心血管死亡等硬终点。而ATHEROREMO-IVUS研究[5]的5年随访结果显示,非罪犯血管较小的管腔面积(MLA<4.0 mm2)、较大的PB(>70%)与长期MACE相关,同时具有以上两种危险因素的TCFA斑块MACE较无这两种危险因素的TCFA斑块增加2倍,但斑块本身的不稳定性(TCFA)并非MACE的独立危险因素。

表1 不同腔内影像学方法检测易损斑块特点的比较
1.2 近红外光谱成像对易损斑块的检测
近红外光谱成像(near-infrared spectroscopy,NIRS)本身空间分辨率不高,其对不稳定斑块成分的检测效能有限,而NIRS对于斑块内胆固醇更加灵敏,能更加准确地检测斑块内脂质负荷。LRP研究[6]使用NIRS-IVUS导管检测非靶病变血管,发现脂质核心负荷指数(lipid-core burden index,LCBI4 mm)>400时MACE风险增加4倍。最近公布的PROSPECT Ⅱ研究[7]将IVUS与NIRS联合应用,发现脂质含量高和PB重是近期心肌梗死患者非靶病变血管远期MACE的独立危险因素,该研究定义的易损斑块为:maxLCBI4 mm≥325、PB≥70%及MLA<4.0 mm2,具有上述易损斑块的患者4年内MACE发生率约为13%。
1.3 光学相干断层成像对易损斑块的检测
由于对脂质穿透力有限,光学相干断层成像(optical coherence tomography,OCT)不适于测量PB,但其检测FCT、管腔面积和巨噬细胞等指标较IVUS更精确[8]。CLIMA研究[9]纳入1 003例前降支近段无严重狭窄的患者,观察OCT检测下高危斑块(具有以下特点:FCT<75 μm、脂质核心弧度>180 °、MLA<3.5 mm2和巨噬细胞聚集)与临床硬终点事件(心源性死亡和靶血管心肌梗死)的关系,研究发现同时具有以上四点高危因素的患者1年内MACE风险是无高危因素患者的7倍。
斑块光衰指数(index of plaque attenuation,IPA)是新近诞生的基于OCT评估斑块易损性的定量分析技术。由于斑块内的不同组织具有不同的光学特性(即光衰系数),富含脂质的坏死核心、巨噬细胞浸润、胆固醇结晶等组织的光衰系数要显著高于纤维组织。分析OCT图像中每个像素光衰系数的大小,形成光衰系数图谱。在其基础之上,将每帧OCT画面中光衰特性“阳性”的像素占总像素的比值计算出IPA,可定量分析斑块易损性。小样本临床研究[10]发现,IPA可准确鉴别TCFA,且检测能力优于NIRS-IVUS。
上述研究均证明了腔内影像学技术在易损斑块检测中的价值,但有共同的临床局限性:均未将冠状动脉整体粥样硬化斑块负荷作为混杂因素纳入分析,这些“高危”斑块特征可能仅仅是体内更广泛和更活跃的粥样硬化疾病的一种标志。尽管易损斑块对患者临床事件有一定的预测作用,其阴性预测值很高(>80%),但阳性预测值普遍偏低(13%~26%)(表2[3,5-7,9,11])。
2 腔内影像学多模态技术
传统腔内影像学检测的易损斑块对临床事件阳性预测值过低,近年来腔内分子影像学发展迅速,能对与斑块易损性相关的组织分子水平特性进行评估,而腔内影像学多模态技术整合了多种腔内影像学方法,能评估斑块形态学和病理分子学特点,实现不同技术的优势叠加。目前NIRS-IVUS系统发展成熟,已正式应用于临床,其他多模态技术包括近红外荧光分子成像(near-infrared fluorescence molecular imaging,NIRF)、荧光寿命成像(fluorescence lifetime imaging,FLIM)和血管内光学成像(intravascular photoacoustics,IVPA)等。
2.1 NIRS-IVUS成像
NIRS-IVUS成像结合了IVUS准确测量斑块结构和NIRS对脂质成分高敏感的双重优势。在LRP研究[6]和PROSPECT Ⅱ[7]等临床研究中均证实了NIRS-IVUS成像的安全性和可靠性,该技术能准确识别易损斑块结构特点和脂质分布。
2.2 NIRF-OCT成像
IVUS和OCT能显示不同尺度下斑块的结构信息,而NIRF通过免疫荧光显色,能在体显示斑块内炎症反应、组织蛋白酶活性、氧化低密度脂蛋白和内皮通透性异常等众多病理学分子信息。NIRF-OCT和NIRF-IVUS杂交成像技术能完成斑块结构信息和分子信息的互补整合。在早期动物模型中,应用NIRF技术发现靶向分子配体能显示局部的炎症活动和纤维累积[12],但早期靶向配体无法应用于人体。尽管在肿瘤领域内已有许多荧光探针应用于临床,但目前只有吲哚青绿(indocyanine green,ICG)被美国食品药品监督管理局批准用于心血管临床应用,小样本研究提示了ICG聚集于斑块内富含脂质和巨噬细胞的部位[13-14]。自发荧光分子成像技术是一种新的成像技术,其无需外源性靶向配体。Ughi等[15]首次将近红外自发荧光分子成像(near-infrared autofluorescence molecular imaging,NIRAF)-OCT技术应用于临床,其对12例患者研究发现,NIRAF信号为阴性或较低的斑块对应于OCT低风险区,而NIRAF高信号区域对应于OCT高风险区,包括薄纤维帽粥样瘤、斑块破裂、纤维粥样瘤和支架内再狭窄等。进一步的研究[16]提示NIRAF信号与高危斑块内出血(红细胞代谢产物胆红素和原卟啉)相关。尽管NIRAF是一项非常有前景的成像技术,但不同于NIRF特异性针对于各种分子信号(蛋白酶活性、氧化低密度脂蛋白、内皮通透性和纤维蛋白沉积等多种靶向配体),NIRAF信号相应的具体分子信号和生物过程仍未十分清晰,此外,NIRAF的发光效率也远低于NIRF。
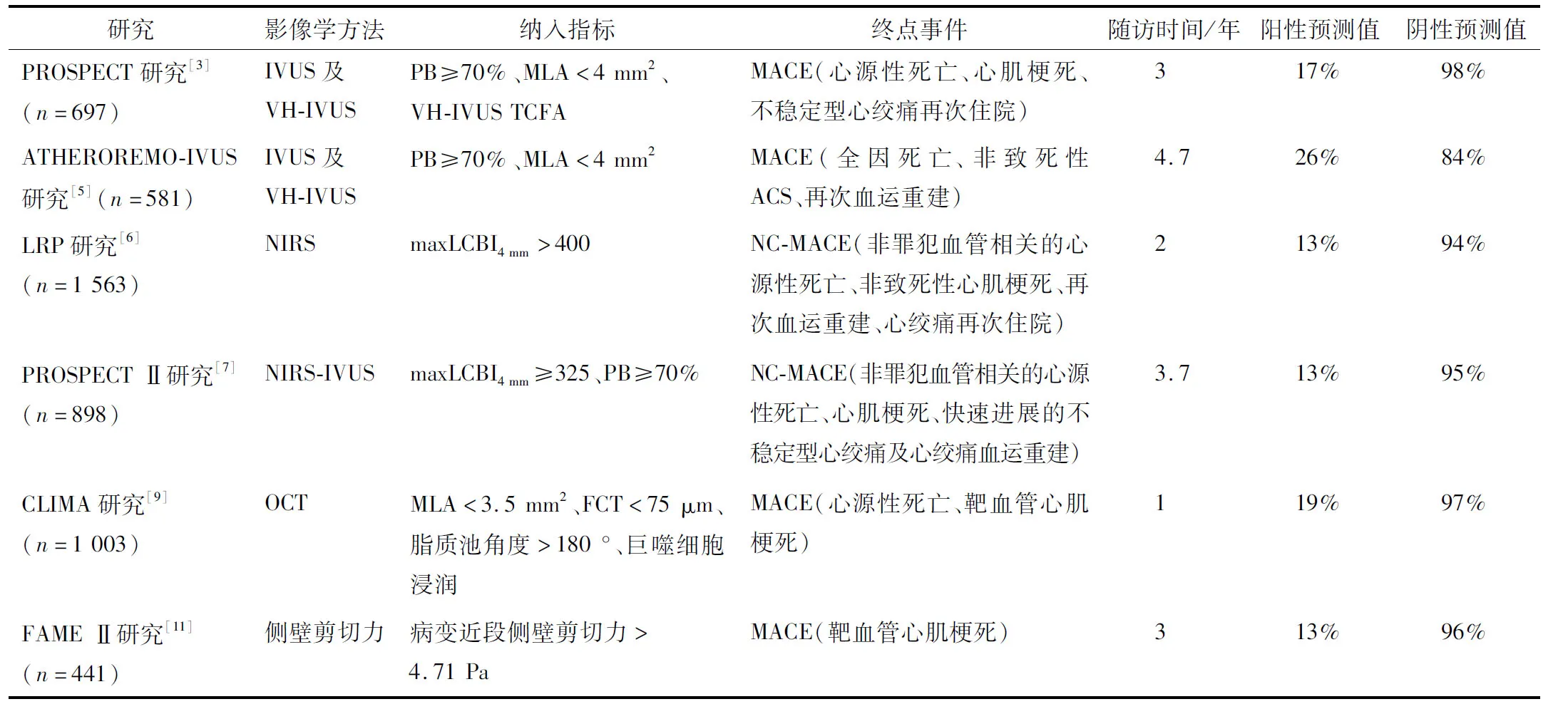
表2 不同影像学方法检测易损斑块对临床事件的预测价值
2.3 IVUS-FLIM成像和OCT-FLIM成像
FLIM成像也是一种新型的腔内分子荧光影像技术,通过测量荧光寿命值可评估分子层面的斑块生化特点,既往研究表明FLIM可检测巨噬细胞、TCFA和厚纤维帽斑块等指标,新近,Bec等[17]采用IVUS-FLIM成像导管系统首次研究了离体冠状动脉内不同性质斑块的FLIM特点,经与组织学逐位点对比后发现,巨噬泡沫细胞、细胞外脂质、表浅钙化等不同成分具有不同的光谱条带。Kim等[18]采用OCT-FLIM成像导管在在体猪冠状动脉内发现不同的荧光信号特征对应于脂质、巨噬细胞、脂质合并巨噬细胞、纤维组织等不同斑块成分,此外,在机器学习框架的辅助下可对上述不同成分进行定量分析。
2.4 IVUS-IVPA成像
IVPA原理是发射激光使血管壁组织产生热膨胀,不同结构组织会产生不同的光声信号,其对斑块内脂质(尤其是胆固醇脂)成分、支架金属梁有非常好的分辨率,IVPA较IVUS的优势在于其对斑块的深度分辨率更佳,能识别不同深度、位置的脂质斑块[19]。由于低回撤速度和需管腔冲洗,早期只能应用于动物实验,最近有关高速回撤系统的研究使IVUS-IVPA成像朝临床应用迈进一步[20]。未来还需改善噪声抑制,发展双频传感器等基础技术以满足临床应用需要。此外,新近有动物实验使用IVUS-IVPA成像技术,应用RGDfk肽-白蛋白-纳米颗粒包被的ICG作为分子探针检测斑块内新生血管水平[21]。
3 腔内影像学检测的易损斑块分布
3.1 易损斑块与冠状动脉狭窄间的关系
既往尸检结果认为,心源性猝死患者冠状动脉罪犯血管通常是轻中度狭窄,然而,近年来冠状动脉造影分析表明大多数冠状动脉血栓形成于既往存在高度狭窄的部位。这种矛盾可能是由于大多数心源性猝死原因是急性缺血诱发的恶性心律失常,这些患者通常无良好的缺血预适应,而既往有严重狭窄的心肌梗死患者通常有近期心绞痛发作史,反复发作的心绞痛使心肌产生缺血预适应,降低了急性缺血时的恶性心律失常风险。OCT研究[22]也证实,血管造影提示高度狭窄(>70%)患者的TCFA发生率是轻中度狭窄患者的2倍,管腔狭窄程度越高,TCFA的发生率也相应越高。在高度狭窄基础上的TCFA通常有更大的PB、更多微通道、胆固醇结晶、管腔正性重构等不稳定特征。多项研究[23]表明,在冠状动脉事件之前的几周至数月时间内,罪犯斑块迅速进展导致管腔狭窄明显加重,诱发心肌梗死发生。
3.2 内皮剪切应力影响斑块分布和斑块破裂
随着影像学与计算机流体力学的结合,诱发斑块不稳定的形态学和功能学因子引起研究的重视,例如内皮剪切应力(endothelial shear stress,ESS)。在斑块进展或退化的过程中,管腔也在进行着相应重构,而伴随着解剖环境的变化,ESS同样在不断变化。在冠状动脉内复杂的解剖环境中,低ESS倾向存在于血管弯曲部位的内侧、分叉脊的外侧以及狭窄部位的远端,这些部位通常伴有较多的炎性分子浸润和内皮功能损害。IVUS研究[24]已证实:低ESS与脂质累积和斑块进展密切相关。OCT研究[25]表明,低ESS区域更易观察到TCFA的存在,左冠状动脉近端的ESS明显低于远端,同时受到前降支近段更多侧支形成的非层流血流影响,TCFA在前降支近段聚集明显。相反,高ESS倾向于存在狭窄部位的近中段。一项在斑块侵蚀患者中OCT冠状动脉流体力学的分析发现,高的ESS及ESS阶差(ESS gradient,ESSG)激活了内皮表面Toll样受体2信号通路,促进中性粒细胞胞外诱捕网形成,最终促进内皮凋亡和血栓形成,该研究提示了高ESS与斑块侵蚀发生密切相关[26]。对PROSPECT研究联合IBIS-4研究[27]和对FAME Ⅱ研究[11]的事后分析均显示,高ESS斑块及斑块内压力梯度是远期MACE的预测因子,暴露于高ESS环境下的斑块近中段部位,通过p38、c-Jun、AFT2等信号通路激活巨噬细胞诱发近中段斑块破裂。最近一项小样本的OCT流体力学研究[28]发现,高ESSG与斑块破裂相关,高ESS、ESSG和震荡剪切指数(oscillatory shear index,OSI)与斑块侵蚀相关。ESSG在斑块破裂部位较斑块侵蚀部位更高,OSI在斑块侵蚀部位较斑块破裂部位更高,而ESS在斑块破裂和斑块侵蚀中未见明显差异。
4 腔内影像学检测下易损斑块的破裂和演变
既往研究认为,FCT是粥样硬化斑块破裂的主要决定因素,这一观点来源于对破裂斑块的病理观察,组织学研究发现FCT<54 μm是区分TCFA是否破裂的最佳形态学预测因子[29],随后的OCT研究[30]也证实了在ACS患者中,破裂TCFA与非破裂TCFA的FCT存在显著差异,斑块破裂部位纤维帽更薄,PB更重,管腔面积更小,但斑块本身形态特征不是破裂的影响因素。冠状动脉造影、IVUS及血管镜均证实了ACS患者冠状动脉内存在多发的斑块破裂,但不是所有斑块破裂都诱发心肌梗死,能引起临床事件的斑块破裂通常伴随小的管腔面积、重的PB和正性重构[31]。
IVUS随访观察表明,80%的基线不稳定斑块在长期随访时转化为稳定斑块,冠状动脉内斑块是动态变化的,在同一时段内,不稳定斑块可退化为稳定斑块,同时新的不稳定斑块也在不断出现[32]。OCT研究[33]表明,接受高强度他汀类药物治疗的患者中有3/4的易损斑块会转化为稳定斑块。当斑块破裂后,纤溶系统激活并抑制阻塞性血栓的形成,这种斑块破裂不会诱发急性心血管事件,破裂后的斑块在各种炎症因子作用下逐渐修复愈合,反复多次的斑块破裂-愈合过程最终会导致冠状动脉管腔狭窄程度逐渐加重[34],OCT研究[35]也证实了,随着管腔狭窄程度的增加,愈合斑块的数目也随之增加。病理学检查发现,在几乎所有中度以上狭窄的冠状动脉内,均发现至少一处未引发临床事件的愈合斑块。
易损斑块可能仅是粥样硬化进展病程中某一时段的短暂表征,冠状动脉CT血管成像研究[36]发现,非梗阻性冠状动脉病变是否进展为梗阻性病变与基线的高危斑块特征(正性重构、点状钙化、低回声斑块和餐巾环征)无关,而是由基线水平的粥样斑块容积决定。另一项冠状动脉CT血管成像研究[37]也证实,在同样的粥样硬化斑块负荷(冠状动脉钙化评分相同)的情况下,阻塞性病变和非阻塞性病变患者的远期预后无差别,粥样硬化斑块负荷而非狭窄本身,是MACE及死亡的决定因素。同样,ISCHEMIA研究[38]已证实,尽管介入治疗减少了心肌缺血发作,但并未减少心肌梗死和心源性死亡,患者PB越重,其远期事件风险越高,这种风险与心绞痛严重程度无关。总之,冠状动脉总体粥样硬化斑块负荷决定长期预后,而单一的不稳定斑块可能仅是一个“触发”因子。
5 斑块侵蚀
TCFA和富脂质斑块对急性冠状动脉事件阳性预测值偏低,其原因是多方面的,除易损斑块存在破裂-愈合-稳定的自然过程外,另一个重要原因是ACS的病理机制不仅包括易损斑块破裂,斑块侵蚀及钙化结节也是诱发ACS的重要原因。在OCT检测下,30%~40%的急性冠状动脉血栓事件是由斑块侵蚀导致[39]。斑块侵蚀是由于斑块表面内皮细胞损伤或剥脱后继发血栓形成,与斑块破裂相比,斑块侵蚀一般不伴有薄纤维帽,其蛋白多糖和平滑肌丰富而脂质核心较少,纤维帽完整,管腔较大,富含血小板血栓(白血栓),更易发生于年轻、传统心血管危险因素较少及非ST段抬高心肌梗死患者[40],同时研究[41]也发现斑块侵蚀和斑块破裂具有不同的炎症反应机制。一项对ST段抬高心肌梗死患者全血管床OCT研究[42]发现,斑块侵蚀较斑块破裂整体血管床斑块更稳定,在斑块侵蚀中非靶病变斑块破裂、非靶病变TCFA、高危斑块(依据CLIMA研究[9]定义)均明显少于斑块破裂,而非靶病变纤维性斑块则多于斑块破裂。
6 对无血流受限易损斑块的早期临床干预
对无血流明显受限,但存在易损斑块的非罪犯病变进行早期药物或介入干预是否恰当目前仍无确切答案,小样本量的研究已证实高强度他汀类药物[43]或前蛋白转化酶枯草溶菌素9抑制剂[44]均能减少PB及脂质含量,但尚无大规模临床试验验证对MACE是否有改善。PROSPECT ABSORB研究[45]探讨了对无血流受限的易损斑块(依据PROSPECTⅡ研究定义,PB≥65%)植入可吸收支架对预后的影响,在25个月随访时,支架组MLA较药物治疗组显著增加,但该研究纳入人群较小,无法证明积极干预无血流受限的高危病变能否减少MACE。在糖尿病患者中,PB通常较重且进展更快[46],COMBINE(OCT-FFR)研究[47]已提示,约25%无心肌缺血证据(血流储备分数>0.8)的糖尿病患者存在TCFA,其未来MACE风险显著增加。在合并糖尿病等高危患者亚群中,早期强化药物治疗可能会降低易损斑块的预期风险。
7 总结
腔内影像学对研究冠状动脉内斑块性质极为重要,其研究结果揭示了易损斑块自然进展的病理生理过程。尽管目前的腔内影像学指标对MACE的阳性预测值很低,但腔内影像学杂交技术的不断改善及多学科的交叉研究能指领不断寻找更佳的治疗策略。更重要的是,粥样硬化是一个系统性疾病,单一的不稳定“斑块”理念应该转变为整体的不稳定“患者”,不应仅聚焦于斑块本身特点,更应关注患者整体心血管不稳定性。诱发斑块破裂的不仅是斑块的不稳定性,更依赖于斑块所处的不稳定环境,包括流体力学异常、内皮功能受损、高凝状态及各种炎症因子。只有存在于不稳定患者中的不稳定斑块才可能引发临床事件。目前能有效减少不稳定斑块临床事件的治疗方法依然是强化降脂、抗血小板等系统性治疗策略。