火把花根多糖对运动疲劳小鼠AMPK/mTOR信号通路的影响
杜伟,吴思澜,杨雪,陈慧,叶兰△
运动疲劳是一种正常的、休息后可缓解的生理现象,表现为机体运动能力下降[1]。但部分人群运动疲劳后通过休息未能缓解,迁延6个月及以上成为慢性疲劳综合征。研究显示,荷兰多达1/3的成年人可诊断为慢性疲劳综合征[2]。我国慢性疲劳综合征患病率为12.54%[3]。目前没有应对疲劳的公认方案,药物干预是重要的举措之一[4]。因此,筛选并开发具有抗疲劳作用的药物对于改善疲劳人群生活质量具有现实意义。运动疲劳可激活腺苷酸活化蛋白激酶(AMPK)/哺乳动物雷帕霉素蛋白(mTOR)信号通路,进而调控糖代谢,增强机体运动能力[5-6]。既往研究表明,从黄芪、黄精、枸杞等常见中药提取的多糖具有抗运动疲劳作用,机制包括改善葡萄糖代谢,降低运动代谢物堆积等[7]。AMPK/mTOR信号通路成为中药多糖抗运动疲劳的潜在通路。近期有研究认为,多糖中所含的单糖种类越丰富,其抗运动疲劳活性可能越强[8]。火把花根多糖从火把花药材提取获得,具有单糖组成丰富的特征,目前有关火把花根多糖抗疲劳作用的相关研究较少。本研究基于AMPK/mTOR信号通路探究火把花根多糖抗运动疲劳的作用机制,为运动疲劳的治疗提供更多的候选药物。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级ICR雄性小鼠24只,体质量18~22 g,购自斯贝福(北京)生物科技有限公司,生产许可证号SCXK(京)2019-0010。动物饲养于明暗交替(12 h/12 h),温度20~26℃,湿度40%~70%环境中,自由摄取水和饲料。动物使用符合重庆市中药研究院伦理要求。
1.1.2 火把花根多糖制备 火把花药材为卫矛科雷公藤属植物昆明山海棠干燥根,购自重庆市中药研究院门诊部。称取火把花药材粉碎,参照文献[9],以水提醇沉法获取火把花根多糖(醇沉淀物),冷冻干燥,得黄褐色火把花根多糖样品。经苯酚-浓硫酸法检测多糖含量为54%,经亲水作用色谱-蒸发光散射检测法(HILIC-ELSD)分析火把花根多糖样品由7种单糖聚合形成,单糖组成比例为甘露糖∶鼠李糖∶葡萄糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖∶岩藻糖(1.9∶2.8∶17.0∶15.2∶35.2∶25.3∶2.6)。火把花根多糖样品用纯化水溶解,使质量浓度为20 g/L,作为本研究的火把花根多糖受试液。
1.1.3 单糖混合物制备 参照火把花根多糖的单糖组成与溶解方法,制成质量浓度为20 g/L的单糖混合物受试液。甘露糖、鼠李糖、葡萄糖醛酸、阿拉伯糖和岩藻糖购自阿拉丁试剂有限公司;葡萄糖、半乳糖购自索莱宝生物科技有限公司。
1.1.4 试剂与仪器 三酰甘油(TG)和血糖(GLU)检测试剂购自贝克曼库尔特商贸有限公司;TRIzol试剂盒购自上海源叶生物科技有限公司;病理糖原染色(PAS)试剂盒购自珠海贝索生物技术有限公司;疲劳转棒仪购自成都泰盟科技有限公司;AU480全自动生化分析仪购自美国贝克曼库尔特有限公司;Mias-2000病理图象处理系统购自四川大学图象处理国家研究所;CFX Connect Real-Time System购自伯乐生命医学产品(上海)有限公司。
1.2 方法
1.2.1 分组及给药 小鼠按随机数字表法分为静止对照组、疲劳对照组、疲劳+单糖组、疲劳+火把花根多糖组,每组6只。疲劳+火把花根多糖组给予火把花根多糖受试液,疲劳+单糖组给予单糖混合物受试液,静止对照组和疲劳对照组给予纯化水,各组均按20 mL/kg每日灌胃给药1次,连续14 d。
1.2.2 一般状况观察 给药期间每天观察1次动物行为活动、腺体分泌、呼吸、排泄物等状况;给药第1、4、7、10、13天称小鼠体质量,记录饲料和饮水的给予量,给药第2、5、8、11、14天记录饲料和饮水的剩余量,使用前1天给予量减去后1天剩余量计算摄食量和饮水量。
1.2.3 运动能力检测 除静止对照组外,其余各组小鼠均于给药后1 h进行运动能力检测。检测方法为疲劳转棒与力竭游泳。(1)疲劳转棒:采用文献[10]的方法,分别在给药第6、13天将各组小鼠置于转棒疲劳仪上(15 r/min),先进行小鼠疲劳转棒训练3次(每次2 min,间隔10 min),然后休息30min开始正式实验,记录小鼠运动性疲劳后从转棒上跌落的时间,即小鼠疲劳转棒时间。(2)力竭游泳:采用文献[11]的方法,小鼠分6次在给药第14天完成力竭游泳,每次每组取1只小鼠,将其尾根部负荷5%体质量铅皮后置于同一游泳箱中(水深不少于30 cm,水温25℃±1.0℃),当小鼠力竭时会沉至水面下,小鼠沉至水面下7 s时,记录每只小鼠游泳结束时间,即小鼠力竭游泳时间。
1.2.4 生化指标检测 小鼠力竭游泳后即眼眶取血,3 000 r/min离心10 min,分离血清,采用AU480全自动生化分析仪检测血清中TG和GLU浓度。
1.2.5 组织病理学检查 小鼠力竭游泳取血后,安乐死处死小鼠,快速采集腓肠肌。左侧腓肠肌经4%多聚甲醛固定,常规脱水、透明、包埋、切片、贴片后制备石蜡病理切片。采用HE染色观察左侧腓肠肌病理变化;按照PAS试剂盒说明书操作,观察左侧腓肠肌糖原着色。
1.2.6 实时荧光定量PCR(qPCR)检测AMPK/mTOR信号通路与葡萄糖转运蛋白4(GLUT-4)mRNA表达 取20 mg右侧腓肠肌组织,加入TRIzol试剂提取总RNA,测定RNA浓度,并进行扩增反应。取1µg总RNA反转录生成cDNA,反转录反应体系为20µL;反应条件为37℃15 min,85℃5 s。PCR引物由南京金瑞斯生物科技公司合成,见表1。反应条件:95℃预变性30 s;95℃变性10 s,60℃退火30 s,72℃延伸30 s,40个循环。通过检测解链曲线来验证引物的特异性。40个循环后分析熔解曲线及Ct值,每个样本重复3次,取平均 值。采 用2-ΔΔCt法 计 算AMPK、mTOR、GLUT-4经 内 参GAPDH标化后的相对表达量。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.3 统计学方法 采用SPSS 17.0软件进行数据分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 火把花根多糖对小鼠一般状况的影响 给药期间未见各组小鼠行为活动、腺体分泌、呼吸、排泄物等异常。给药第13天,与静止对照组比较,疲劳+火把花根多糖组的体质量减轻(P<0.05)。余各时间点各组体质量、摄食量、饮水量差异无统计学意义(P>0.05)。见表2~4。
Tab.2 Comparison of body mass of mice at different time points between the four groups表2各组小鼠不同给药时间体质量的比较(n=6,g,±s)

Tab.2 Comparison of body mass of mice at different time points between the four groups表2各组小鼠不同给药时间体质量的比较(n=6,g,±s)
*P<0.05;a与静止对照组比较,P<0.05。
组别静止对照组疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F第1天20.1±0.6 20.1±0.8 20.1±0.7 20.1±0.7 0.003第4天24.0±1.2 24.1±1.4 24.1±1.0 23.5±1.1 0.357第7天27.3±1.9 27.4±2.0 27.3±1.6 25.8±1.5 1.141第10天30.0±2.3 30.1±2.2 29.1±1.4 27.5±1.9 2.119第13天31.4±2.0 31.4±2.4 29.8±1.4 28.1±1.7a 4.192*
Tab.3 Comparison of food intake of mice at different time points between the four groups表3各组小鼠不同给药时间摄食量的比较(n=6,g,±s)
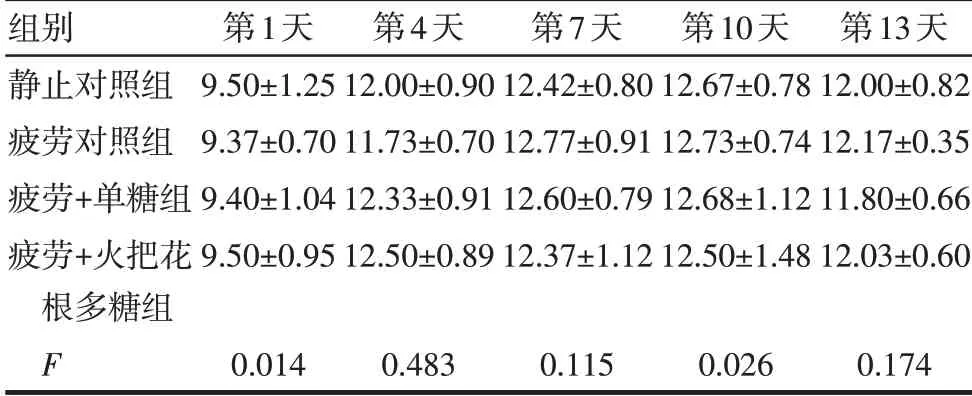
Tab.3 Comparison of food intake of mice at different time points between the four groups表3各组小鼠不同给药时间摄食量的比较(n=6,g,±s)
均P>0.05。
组别静止对照组疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F第1天9.50±1.25 9.37±0.70 9.40±1.04 9.50±0.95 0.014第4天12.00±0.90 11.73±0.70 12.33±0.91 12.50±0.89 0.483第7天12.42±0.80 12.77±0.91 12.60±0.79 12.37±1.12 0.115第10天12.67±0.78 12.73±0.74 12.68±1.12 12.50±1.48 0.026第13天12.00±0.82 12.17±0.35 11.80±0.66 12.03±0.60 0.174
Tab.4 Comparison of water consumption of mice at different time points between the four groups表4各组小鼠不同给药时间饮水量的比较(n=6,g,±s)

Tab.4 Comparison of water consumption of mice at different time points between the four groups表4各组小鼠不同给药时间饮水量的比较(n=6,g,±s)
均P>0.05。
组别静止对照组疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F第1天11.6±0.6 11.7±0.9 12.0±0.7 12.1±0.2 0.354第4天14.8±0.8 15.2±0.4 15.2±0.4 14.8±0.9 0.313第7天16.1±0.6 15.9±0.4 16.2±0.7 15.8±0.5 0.297第10天14.9±0.9 15.0±0.2 15.0±0.7 14.9±0.9 0.015第13天13.3±0.7 13.1±0.4 13.2±0.9 13.4±0.3 0.173
2.2 火把花根多糖对小鼠运动能力的影响 与疲劳对照组比较,疲劳+火把花根多糖组在给药第6天疲劳转棒时间差异无统计学意义;在给药第13天,疲劳转棒时间显著增加(P<0.05)。在给药第14天,疲劳+火把花根多糖组力竭游泳时间增加(P<0.05)。疲劳+单糖组小鼠疲劳转棒时间和力竭游泳时间与疲劳对照组比较差异均无统计学意义。见表5。
Tab.5 Comparison of fatigue rotating rod and weightbearing swimming time of mice between the three groups表5各组小鼠疲劳转棒与力竭游泳时间的比较(min,±s)

Tab.5 Comparison of fatigue rotating rod and weightbearing swimming time of mice between the three groups表5各组小鼠疲劳转棒与力竭游泳时间的比较(min,±s)
**P<0.01;a与疲劳对照组比较,P<0.05。
组别疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F n 666疲劳转棒时间第6天2.74±1.10 2.66±1.05 4.12±0.96 3.737第13天2.63±1.45 2.84±1.76 10.58±2.36a 34.268**力竭游泳时间10.2±3.4 14.0±3.3 24.2±4.8a 20.512**
2.3 火把花根多糖对小鼠TG和GLU的影响 与静止对照组比较,疲劳对照组、疲劳+单糖组、疲劳+火把花根多糖组小鼠血清中TG均上调(P<0.05),但后3组间差异无统计学意义。与静止对照组比较,疲劳对照组、疲劳+单糖组、疲劳+火把花根多糖组小鼠血清中GLU均降低(P<0.05);与疲劳对照组比较,疲劳+火把花根多糖组GLU降低(P<0.05)。见表6。
Tab.6 Comparison of serum levels of TG and GLU between the four groups of mice表6各组小鼠血清TG和GLU比较(mmol/L,±s)
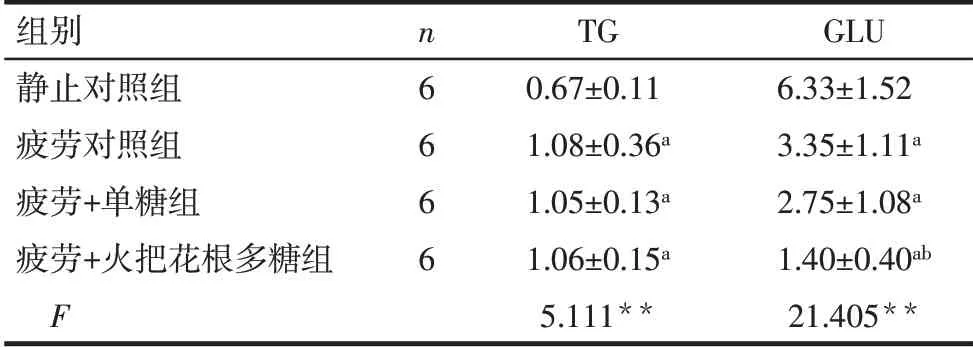
Tab.6 Comparison of serum levels of TG and GLU between the four groups of mice表6各组小鼠血清TG和GLU比较(mmol/L,±s)
**P<0.01;a与静止对照组比较,b与疲劳对照组比较,P<0.05。
组别静止对照组疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F n6666 TG 0.67±0.11 1.08±0.36a 1.05±0.13a 1.06±0.15a 5.111**GLU 6.33±1.52 3.35±1.11a 2.75±1.08a 1.40±0.40ab 21.405**
2.4 火把花根多糖对小鼠组织病理学的影响HE染色显示各组小鼠腓肠肌未见明显异常。PAS染色可见疲劳对照组与疲劳+单糖组腓肠肌着色略深,而疲劳+火把花根多糖组着色最深。见图1。

Fig.1 Pathological observation of gastrocnemius muscle in each group图1各组小鼠腓肠肌病理观察
2.5 火把花根多糖对AMPK/mTOR信号通路与GLUT-4的影响 与静止对照组和疲劳对照组比较,疲劳+火把花根多糖组小鼠腓肠肌中AMPK、mTOR、GLUT-4 mRNA均上调(P<0.05),见表7。
Tab.7 The relative expression levels of AMPK,mTOR and GLUT-4 mRNA in gastrocnemius muscle of mice after weight-bearing swimming in each group表7各组小鼠力竭游泳后腓肠肌AMPK、mTOR和GLUT-4 mRNA的比较 (n=6,±s)
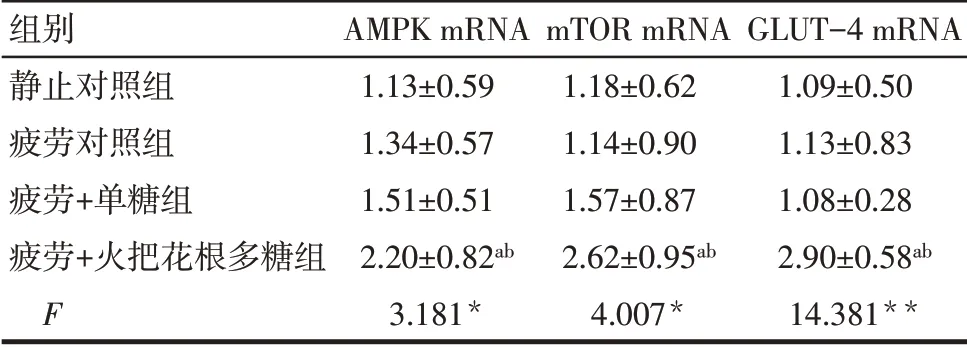
Tab.7 The relative expression levels of AMPK,mTOR and GLUT-4 mRNA in gastrocnemius muscle of mice after weight-bearing swimming in each group表7各组小鼠力竭游泳后腓肠肌AMPK、mTOR和GLUT-4 mRNA的比较 (n=6,±s)
*P<0.05,**P<0.01;a与静止对照组比较,b与疲劳对照组比较,P<0.05。
组别静止对照组疲劳对照组疲劳+单糖组疲劳+火把花根多糖组F AMPK mRNA 1.13±0.59 1.34±0.57 1.51±0.51 2.20±0.82ab 3.181*mTOR mRNA 1.18±0.62 1.14±0.90 1.57±0.87 2.62±0.95ab 4.007*GLUT-4 mRNA 1.09±0.50 1.13±0.83 1.08±0.28 2.90±0.58ab 14.381**
3 讨论
运动性疲劳的研究从19世纪初开始,至今一直是运动医学研究的热点[12]。目前的研究表明,多种因素与运动能力相关,如体质量增加、能量摄入不足、能源物质耗竭均可能加速机体运动疲劳[13-14]。通常通过食物限制和力竭游泳产生的运动疲劳小鼠模型来评估药物的抗疲劳作用[15]。
本研究未采取食物限制措施,所有小鼠均可自由摄取食物和饮水。小鼠摄食和饮水数据表明,火把花根多糖对小鼠摄食和饮水无影响,排除了小鼠能量摄入差异的可能。现有的研究支持多糖类化合物通过调控糖脂代谢而降低小鼠体质量[16]。笔者认为疲劳+火把花根多糖组小鼠体质量的降低属火把花根多糖药理效应。除力竭游泳实验外,本研究还设计了小鼠疲劳转棒实验。力竭游泳实验方法与抑郁症模型制备时采用的强迫游泳实验类似,多次力竭游泳可能引起小鼠精神紊乱[17],而未见疲劳转棒实验引起小鼠精神紊乱的报道,所以力竭游泳实验在抗疲劳研究中通常被设计至实验观察终点作单次观察。火把花根多糖给药第6天未见疲劳转棒时间的显著变化,而在给药第13天可见疲劳转棒时间较疲劳对照组显著增加,表明火把花根多糖发挥抗疲劳作用需要一个持续的用药周期。在给药第14天,观察到疲劳+火把花根多糖组力竭游泳时间显著增加,进一步证实了火把花根多糖抗疲劳的作用。
既往对多糖的认识,涉及抗运动疲劳、免疫调节、抗氧化、抗肿瘤等功效[18]。机体运动时需要消耗大量的能源物质,如糖类、脂肪和蛋白质[19]。因此,多糖抗疲劳的研究广泛集中于探讨其对能量代谢的调节作用。本研究检测了血清TG、GLU,PAS染色观察了腓肠肌糖原的着色。TG是与脂肪代谢密切相关的指标,GLU、糖原是糖代谢的重要指标。研究结果显示,火把花根多糖对血清TG无调控作用,而对血清GLU和PAS染色糖原的调控明显,表明火把花根多糖调节糖代谢是发挥抗疲劳作用的重要途径。
基于AMPK信号通路阐释药物抗疲劳机制是现行的主流趋势,研究普遍认为AMPK对能量变化较为敏感,在急性运动中,骨骼肌收缩诱发AMPK信号通路激活以适应运动引起的全身代谢反应,从而维持能量平衡[6,20]。大部分观点认为AMPK通路一旦被激活,会增加细胞对营养物质如葡萄糖的摄取,刺激分解代谢,抑制合成代谢,从而以负反馈的方式重建能量平衡,与腺苷三磷酸(ATP)消耗有关;小部分观点则认为肌肉AMPK通路激活后维持细胞能量平衡并不一定会消耗ATP[21]。mTOR是生长因子和营养信号的整合器,整合上游的信号(如AMPK)进而调节细胞的生长[22]。GLUT-4跨膜转运葡萄糖,在AMPK激活后扮演“搬运工”角色,促进能量平衡[23]。在本研究中,疲劳+火把花根多糖组小鼠AMPK、mTOR、GLUT-4与疲劳对照组比较显著上调,可见火把花根多糖抗疲劳机制可能与调节AMPK/mTOR信号通路有关。
多糖为大分子化合物,由10个以上单糖通过苷键聚合形成,无法直接入血。有研究认为多糖通常在机体内被降解为寡糖或单糖实现对机体的作用[16]。因此本研究按照火把花根多糖的单糖组成设置了疲劳+单糖组。与疲劳对照组比较,疲劳+单糖组小鼠各指标均未见显著差异,表明单糖混合物不能发挥显著抗疲劳作用,说明火把花根多糖抗疲劳作用可能与多种单糖的苷键聚合相关。而具体的苷键聚合特征有待进一步阐明。
综上,火把花根多糖具有抗运动疲劳作用,其机制可能与调节AMPK/mTOR信号通路调控的糖代谢有关。

