电针足三里、内关穴抑制mTOR信号通路缓解大鼠脑缺血损伤作用的研究
张游,靳子言,尹亚龙,吴新贵
缺血性脑卒中作为一种世界范围内的高残疾率和高死亡率的疾病,严重威胁着公众健康[1]。缺血性脑卒中后脑局灶性血液循环障碍会导致炎症、氧自由基的产生、兴奋性毒性、自噬、坏死和凋亡等一系列病理改变,从而造成严重的神经损伤[2]。自噬是受损、变性、衰老和失去功能的细胞质内容物和细胞器自我降解的过程,在细胞代谢中起关键作用[3]。研究表明,适当的自噬激活可以通过降解受损蛋白质,诱导新生蛋白质合成,抑制细胞凋亡、坏死,从而改善缺血性脑损伤[4]。近年来,雷帕霉素靶蛋白(mTOR)作为调节自噬的关键因子,已成为治疗缺血性卒中的新靶点[5]。抑制mTOR的磷酸化可诱导自噬反应发生,从而改善脑缺血损伤,起到神经保护作用[6]。电针(electroacupuncture,EA)是通过现代电子技术与中国传统医学的结合来进行针灸治疗,越来越多的证据表明其对缺血性脑卒中有疗效[7],但具体机制尚不明确。本研究旨在探讨EA对缺血性卒中大鼠的神经保护作用,并分析EA通过mTOR信号通路改善缺血性脑卒中大鼠神经功能障碍的机制。
1 材料与方法
1.1 主要仪器及试剂 盐酸艾司氯胺酮注射液(江苏恒瑞公司),盐酸甲苯噻嗪(Sigma公司),异氟烷(深圳瑞沃德公司);线栓(广州佳灵公司,硅胶头直径0.36~0.37 mm),针灸针(Φ 0.25 mm×1.3 mm、Φ0.25 mm×2.5 mm,苏州市华佗医疗用品有限公司),SDZ-Ⅱ型电子针疗仪(苏州医疗用品厂有限公司);2,3,5氯化三苯基四氮唑(TTC)粉末、苏木素伊红(HE)染色试剂盒(北京solarbio公司),尼式染液(武汉碧云天公司);兔源抗AKT抗体、抗mTOR抗体、抗磷酸化mTOR(pmTOR)抗体(美国Cell Signaling Technology公司),山羊抗兔二抗(Elabscience公司);Trizol总RNA提取试剂盒,荧光定量PCR试剂盒,反转录试剂盒以及LCB3、Beclin-1、B淋巴细胞瘤-2相关蛋白X(Bax)、β-actin引物(武汉塞维尔生物科技有限公司);全自动冰冻研磨仪(广州露卡公司),垂直电泳系统、荧光定量PCR仪(Bio-rad公司),正置显微镜(日本Olympus公司)。
1.2 实验动物与分组SPF级健康雄性SD大鼠75只,8~9周龄,平均体质量(280±50)g,购自广西医科大学实验动物中心,动物生产许可证号:SCXK(桂)2020-0003。SD大鼠由广西医科大学动物实验中心动物房代养,规律摄水、摄食,环境温度(24±4)℃,平均相对湿度55%,明暗交替12 h,实验方案得到广西医科大学实验动物福利与伦理委员会的许可。
将75只大鼠按随机数字表法分为假手术(Sham)组、大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型3 d组、EA干预3 d组、MCAO模型7 d组、EA干预7 d组,每组15只。
1.3 造模方法MCAO大鼠模型采用Longa线栓法诱导制备。大鼠手术前禁食过夜(12~14 h),然后通过腹腔注射氯胺酮(60 mg/kg)+甲苯噻嗪(8 mg/kg)进行麻醉;将大鼠仰卧固定,常规消毒后沿颈部正中线切开,暴露右侧颈总动脉(CCA)、颈内动脉(ICA)、颈外动脉(ECA)。在距ICA分叉5 mm处插入线栓,沿ICA向上平行推进致右侧大脑中动脉(MCA)血流阻断,结扎ICA和CCA以固定线栓,止血、消毒后逐层缝合切口。术中及术后使用电热毯维持大鼠肛温在37℃。Sham组大鼠实施同样的手术操作但不插入线栓和结扎血管。
1.4 模型成功标准MCAO大鼠模型评估参考Bederson 4分5级法[8]:0分,无神经功能缺损症状;1分,左侧肢体疼痛刺激后收缩现象消失,轻度神经功能缺损;2分,向左倾倒或转圈,中度神经功能缺损;3分,向病灶对侧跌倒,提尾时左上肢屈曲抱胸,不能向前伸直,重度神经功能缺损;4分,不能自行行走,意识水平下降。大鼠手术苏醒后24 h内选择Bederson评分为1~3分的大鼠入组,剔除评分为0分、4分的SD大鼠。
1.5 干预方法 造模术后,EA干预组通过电子针疗仪对双侧肢体的足三里(ST36)和内关(PC6)穴进行刺激。大鼠在EA治疗前接受异氟烷气体麻醉,随后使用大鼠固定架固定,在双侧内关和足三里穴位处插入直径为0.25 mm的针灸针,深度分别为1 mm和2 mm。EA刺激参数为2 Hz的疏密波频率和1 mA的强度,每日治疗20 min。Sham组、MCAO模型组大鼠仅麻醉后固定,不进行EA治疗。
1.6 样本采集MCAO术后3 d后对MCAO模型3 d组和EA干预3 d组取材,MCAO术后7 d后对Sham组、MCAO模型7 d组和EA干预7 d组取材。以10%水合氯醛(0.35 g/kg)腹腔注射麻醉处死大鼠,按随机数字表法抽取大鼠:5只大鼠直接取出全脑,置于-20℃冰箱冻存,用于TTC染色;5只大鼠用生理盐水和4%多聚甲醛行心脏灌注,见流出液体清亮后取梗死侧大脑皮层,浸泡于4%多聚甲醛中过夜,常规石蜡包埋,并制成厚度为5µm的切片,用于HE染色和尼式染色;5只大鼠仅用生理盐水行心脏灌注,见流出液体清亮后迅速取梗死侧大脑皮层,置于-80℃冰箱保存,用于Western blot检测和实时荧光定量PCR检测。
1.7 观察指标及检测方法
1.7.1 Bederson评分 采用Bederson 4分5级法评价大鼠MCAO术后1、3、7 d神经功能缺损程度,并记录评分。
1.7.2 TTC染色测定脑梗死面积 取-20℃冰箱中冻存的全脑,将大脑从冠状面均匀切成6个层面,切片厚度约2 mm,将切片放入2%TTC溶液中,37℃恒温避光孵育30 min,置于4%多聚甲醛缓冲液过夜固定,然后拍照记录。正常脑区为暗红色,梗死区为白色,使用Image J软件测量梗死面积百分比。
1.7.3 HE染色评估大脑皮层病理形态学情况 取1.6制好的切片,60℃烤片过夜,再通过二甲苯和乙醇溶液脱蜡和脱水,依次行苏木精染色5 min、伊红染色3 min,封片后拍照分析。
1.7.4 尼式染色评估大脑皮层神经元损伤情况 取1.6制好的切片,烤片后放入二甲苯中浸泡3次,每次10 min,再通过梯度乙醇脱水(50%、70%、80%、90%和95%各5 min),浸入尼式染液30 min,用水快速冲洗后,乙醇递增式脱水,二甲苯中浸泡3次,每次2 min,最后封片并显微镜拍照,随机读取3个视野,用Image J软件分析完整神经元阳性细胞数量。
1.7.5 Western blot检测AKT/mTOR通路蛋白表达 取冻存于-80℃冰箱中的梗死侧大脑皮层组织,随后置于蛋白裂解液中破碎匀浆,4℃、12 000×g离心30 min,收集上清液并在-80℃下冻存,通过BCA蛋白检测试剂盒检测各组的蛋白浓度。将等量的蛋白质(70µg)上样至10%SDS-PAGE凝胶中进行电泳,然后转移到PVDF膜上,放置于5%牛血清白蛋白溶液中37℃封闭1 h,4℃冰柜摇床孵育一抗过夜(12~14 h),使用的一抗为AKT(1∶1 000),mTOR(1∶1 000),p-mTOR(1∶1 000),β-actin(1∶1 000),第2天用TBST漂洗3次后,加入相对应的山羊抗兔(1∶2 000)二抗,室温孵育1 h,使用化学发光法(ECL)检测条带,照片通过Image J软件分析蛋白条带灰度值,以β-actin为内参,得出蛋白相对表达量。
1.7.6 实时荧光定量PCR检测 取-80℃冰箱中的梗死侧大脑皮层组织,随后使用总RNA提取试剂盒提取总RNA,使用反转录试剂盒将其反转录为cDNA,随后进行PCR扩增。热循环条件为:95℃预变性30 s;95℃15 s,60℃30 s,循环40次。测得Ct值后,以2-ΔΔCt法计算每组样品中mRNA相对表达量。引物序列见表1。

Tab.1 Primer sequences表1引物序列
1.8 统计学方法 所有数据均使用SPSS 23.0软件进行处理,计量数据用均数±标准差(±s)表示。符合方差齐性检验,多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较 与Sham组相比,MCAO模型组和EA干预组各时间点神经功能缺损评分均升高(P<0.05),MCAO模型制备成功;MCAO模型组和EA干预组在术后1 d和3 d的神经功能缺损评分差异无统计学意义,但术后7 d,EA干预组神经功能缺损评分较MCAO模型组降低(P<0.05),见表2。
Tab.2 Comparison of neurological deficit scores at different time points after ischemic brain injury between the three groups of rats表2各组大鼠脑缺血性损伤后不同时间点神经功能缺损评分比较 (n=15,分,±s)

Tab.2 Comparison of neurological deficit scores at different time points after ischemic brain injury between the three groups of rats表2各组大鼠脑缺血性损伤后不同时间点神经功能缺损评分比较 (n=15,分,±s)
**P<0.01;a与Sham组比较,b与MCAO模型组比较,P<0.05。
组别Sham组MCAO模型组EA干预组F术后1 d 0.00±0.00 2.70±0.48a 2.80±0.42a 184.135**术后3 d 0.00±0.00 2.50±0.52a 2.60±0.51a 119.571**术后7 d 0.00±0.00 2.30±0.48a 1.60±0.51b 83.400**
2.2 各组大鼠脑梗死体积的比较Sham组无明显缺血改变,未见白色缺血梗死灶;MCAO模型组和EA组在术后3 d和7 d时出现了明显的缺血梗死灶。EA干预3 d组和7 d组的脑梗死面积百分比均较相应MCAO模型组明显缩小(均P<0.05),见表3、图1。
Tab.3 Comparison of percentage of cerebral infarction area and number of intact neurons between the five groups of rats表3各组大鼠脑梗死面积百分比及完整神经元数量的比较(n=5,±s)

Tab.3 Comparison of percentage of cerebral infarction area and number of intact neurons between the five groups of rats表3各组大鼠脑梗死面积百分比及完整神经元数量的比较(n=5,±s)
**P<0.01;a与Sham组比较,b与MCAO模型3 d组比较,c与MCAO模型7 d组比较,P<0.05;表4、5同。
组别Sham组MCAO模型3 d组EA干预3 d组MCAO模型7 d组EA干预7 d组F脑梗死面积百分比(%)—68.32±5.78 52.91±0.47b 60.25±2.86 36.15±1.66c 84.053**神经元数量(个/视野)542.00±43.13 245.27±48.84a 356.13±82.28b 406.27±39.40a 500.87±36.23c 75.273**

Fig.1 TTC staining of cerebral infarction area in each group图1 TTC染色检测各组脑梗死面积
2.3 各组大鼠大脑梗死区病理形态学变化Sham组大脑皮层局部结构疏松,可见较多血管扩张,周围间隙变大,较多神经元胞质疏松,排列规则。MCAO模型3 d组和7 d组可见皮层大范围结构疏松,大片坏死;脑膜出现水肿,伴有少量淋巴细胞、中性粒细胞浸润;较多神经元坏死,胞核碎裂或溶解,胞质嗜酸性增强,伴有较多胶质细胞浸润;少量血管扩张,少量神经元胞质疏松,形状不规则,排列紊乱。EA干预3 d组和7 d组可见坏死灶显著减小,炎性浸润改善;脑膜出现水肿,伴有少量淋巴细胞浸润;少量血管扩张,周围间隙变大,较多神经元胞质疏松,排列不规则,见图2。
2.4 各组大鼠脑梗死区完整神经元数量比较 与Sham组相比,MCAO模型组神经元染色较浅,细胞排列较疏松,神经元较少,MCAO模型3 d组和7 d组的完整神经元数量较Sham组显著减少(P<0.05);与MCAO模型组相比,EA干预组变性神经元数量显著减少,EA干预3、7 d组的完整神经元数量显著高于对应MCAO模型组(均P<0.05),见表3、图3。
2.5 各组大鼠大脑皮层AKT和mTOR蛋白磷酸化水平比较 与Sham组相比,MCAO模型3 d组的mTOR磷酸化水平(p-mTOR/t-mTOR)显著降低,但MCAO模 型7 d组p-mTOR/t-mTOR较MCAO模 型3 d组显著增加(均P<0.05);与MCAO模型7 d组相比,EA干预7 d组p-mTOR/t-mTOR显著降低(P<0.05);各组AKT、t-mTOR表达水平差异均无统计学意义,见表4、图4。

Fig.2 Comparison of pathomorphological changes of cortical areas on the infarct side of rats between the five groups(HE staining,×200)图2各组大鼠梗死侧大脑皮层区病理形态学比较(HE染色,×200)
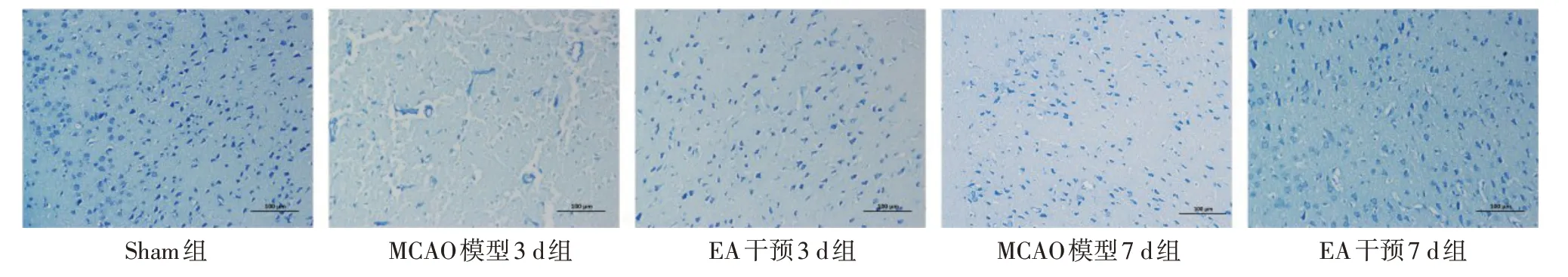
Fig.3 Comparison of neuronal morphology in the cortical area of the infarct side of rats between the five groups(Nissl staining,×200)图3各组大鼠梗死侧大脑皮层区神经元形态学比较(尼式染色,×200)
2.6 各组大鼠大脑皮层LC3B、Beclin-1和Bax mRNA表达情况 与Sham组相比,MCAO模型3 d组和7 d组的LC3B和Beclin-1表达水平均显著降低(P<0.05),EA干预7 d组的LC3B和Beclin-1表达水平显著高于MCAO模型7 d组(P<0.05);MCAO模型7 d组的Bax表达水平显著高于Sham组(P<0.05),而与MCAO模型7 d组相比,EA干预7 d组Bax的表达水平显著降低(P<0.05),见表5。
Tab.4 Comparison of relative expression levels of AKT,p-mTOR and t-mTOR proteins in rat brain tissues between the five groups表4各组大鼠脑组织AKT、p-mTOR和t-mTOR蛋白相对表达水平比较 (n=5,±s)

Tab.4 Comparison of relative expression levels of AKT,p-mTOR and t-mTOR proteins in rat brain tissues between the five groups表4各组大鼠脑组织AKT、p-mTOR和t-mTOR蛋白相对表达水平比较 (n=5,±s)
组别Sham组MCAO模型3 d组EA干预3 d组MCAO模型7 d组EA干预7 d组F AKT 2.07±1.14 2.89±0.70 2.33±0.73 2.74±0.59 2.11±0.90 0.972 p-mTOR/t-mTOR 1.15±0.40 0.65±0.22a 0.69±0.30 1.49±0.40b 0.63±0.21c 7.015**t-mTOR 0.87±0.32 1.40±0.26 1.10±0.33 1.02±0.93 0.97±0.32 2.470

Fig.4 Western blot analysis showed the expressions of AKT,p-mTOR and t-mTOR in the five groups图4蛋白印迹分析显示各组AKT、p-mTOR和t-mTOR蛋白的表达
Tab.5 Comparison of LC3B,Beclin-1 and Bax mRNA expressions in rat brain tissue at different time points between the five groups表5各组大鼠脑组织不同时间点LC3B、Beclin-1和Bax mRNA表达量比较 (n=5,±s)
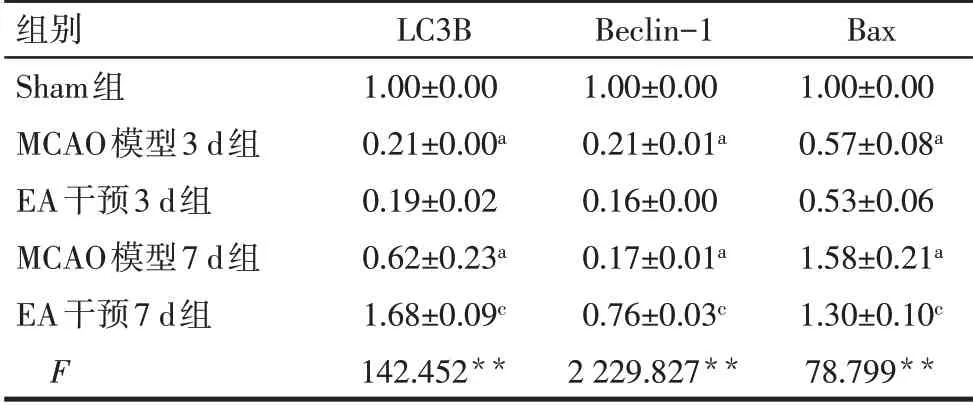
Tab.5 Comparison of LC3B,Beclin-1 and Bax mRNA expressions in rat brain tissue at different time points between the five groups表5各组大鼠脑组织不同时间点LC3B、Beclin-1和Bax mRNA表达量比较 (n=5,±s)
组别Sham组MCAO模型3 d组EA干预3 d组MCAO模型7 d组EA干预7 d组F LC3B 1.00±0.00 0.21±0.00a 0.19±0.02 0.62±0.23a 1.68±0.09c 142.452**Beclin-1 1.00±0.00 0.21±0.01a 0.16±0.00 0.17±0.01a 0.76±0.03c 2 229.827**Bax 1.00±0.00 0.57±0.08a 0.53±0.06 1.58±0.21a 1.30±0.10c 78.799**
3 讨论
缺血性脑卒中是由缺血缺氧引起的局限性脑组织缺血性坏死或软化的脑部血液循环障碍[1]。虽然溶栓和血管内治疗在临床上的疗效显著,但其使用条件受限,必须在发病后数小时内使用,恢复期不可使用,后期应用组织型纤溶酶原激活剂(t-PA)可能导致颅内出血[9]。目前临床上对缺血性脑损伤后的脑部恢复多采用物理疗法,以促进缺血性脑损伤后神经再生、血管生成及功能恢复[10]。
EA作为中医现代化的产物,已广泛应用于缺血性脑卒中的辅助治疗,并被证明在脑梗死治疗中具有抑制炎症反应、调节自噬和凋亡、促神经营养因子释放、促进神经和血管再生等作用[11],可以有效地改善脑梗死患者的神经功能缺损情况及预后。EA疗法治疗疾病的核心理念之一就是刺激身体特定部位可调节生理功能,并认为其通过传统经络发挥作用[12],其中足三里[13]、内关穴[14]为治疗缺血性卒中常用的组合穴位。本研究首先探讨EA干预对MCAO大鼠神经功能障碍的影响,发现EA干预7 d后Bederson评分显著低于MCAO组;此外,EA治疗后脑梗死面积明显减少,梗死侧大脑皮层神经元损伤明显减轻,EA治疗对缺血性卒中具有神经保护作用,与之前的研究结果一致[15]。Tian等[16]还发现,EA疗法能起到镇痛作用,还可抑制神经元凋亡及异常星形细胞活化。针灸在临床康复中的作用已得到广泛认可,但其作用机制尚不明确。
自噬是机体内普遍存在的一种细胞调控机制,机体可以通过自噬降解受损、变性、衰老和失去功能的细胞、细胞器和变性蛋白质与核酸等生物大分子[17]。自噬在生长和发育过程中比较活跃,对神经元尤其重要。由于神经元结构复杂,代谢需求较大,因此,自噬系统在神经元合成代谢和分解代谢中扮演了重要角色[18]。有研究表明mTOR在多种中枢神经损伤模型中起重要作用[19]。进一步研究发现,mTOR在调节自噬过程中起着关键作用,通过抑制mTOR的表达而诱导细胞自噬[20]。
mTOR为丝氨酸/苏氨酸蛋白激酶,其催化亚单位为mTORC1和mTORC2。mTORC1通过正向调节细胞内合成代谢过程和负向调节细胞内分解代谢过程而促进细胞生长;mTORC2通过调节其他下游的蛋白激酶和细胞骨架元素,影响细胞的生存、代谢和结构[18]。其中,mTORC1在诱导自噬过程中起着核心作用[21],通过调节神经元自噬来改善脑缺血损伤[22]。正常情况下,mTORC1作为自噬抑制剂存在于机体中,一旦细胞出现缺血、缺氧症状,mTORC1就会失去活性,从而促进自噬[23]。Beclin-1是mTOR下游分子,可促进LC3-Ⅰ酯化形成LC3-Ⅱ,并在自噬溶酶体的形成中起重要作用[24]。在缺血性脑卒中患者的脑组织中,抑制mTOR磷酸化可以促进自噬,降低兴奋性毒性所致的损伤[25],并显著提高自噬相关因子Beclin-1和LC3B的表达[4]。注射组胺H3受体的拮抗剂可抑制大脑梗死区mTOR磷酸化并诱导自噬发生,在脑缺血损伤后起到保护作用[6]。在本研究中,与Sham组相比,MCAO模型7 d组的自噬相关因子Beclin-1、LC3B表达显著降低,EA干预可逆转MCAO模型组的变化,EA干预7 d组的mTOR磷酸化水平显著降低,Beclin-1、LC3B表达显著增加,提示EA治疗可能通过抑制mTOR激活自噬改善缺血性脑损伤。
缺血性脑卒中后,脑梗死核心区神经元迅速坏死、凋亡,造成不可逆转的损伤[26],而适度的自噬可通过抑制凋亡反应缓解脑损伤[27]。其中,凋亡途径主要由Bax的钙依赖性激活启动,并通过激活下游的caspase-3介导细胞凋亡[28]。研究表明,在脑缺血再灌注模型大鼠中,沙芬酰胺能显著促进自噬相关蛋白Beclin-1、LC3B的表达,抑制凋亡相关因子Bcl-2、Bax、caspase-3表达,沙芬酰胺可能通过抗凋亡、诱导自噬等途径发挥神经保护作用[29]。本研究结果显示,MCAO模型7 d组的促凋亡因子Bax表达水平显著高于Sham组,EA干预7 d组的Bax表达水平显著低于MCAO模型7 d组,且趋势与上述研究结果一致,提示EA治疗可能通过抑制凋亡因子诱导自噬反应。
综上所述,EA刺激内关、足三里可明显改善缺血性卒中大鼠运动功能,改善继发性脑损伤及神经元坏死,其作用机制可能是通过抑制mTOR信号通路诱导自噬,抑制细胞凋亡,发挥神经保护作用。

