GPR19基因在前列腺癌中的表达及意义
刘帅兵,闫墨,王楷斌,杨阔,王玉琢
前列腺癌(PCa)是全球男性癌症相关死亡的主要原因,由于我国老年人口的占比越来越高,PCa的发病率和病死率也逐年增高[1]。尽管对于PCa的早期诊断和治疗策略研究方面已取得了进展,大多数PCa患者在确诊时已经出现远处转移,治疗手段局限于内分泌治疗和放疗,患者的预后仍然较差[2-3]。G蛋白偶联受体(GPCR)家族成员是美国食品药品监督管理局(FDA)批准的大部分可用药物的靶标。然而,许多GPCR的生理作用和药理特性仍然未知,部分内源性配体未知的GPCR被称为孤儿GPCR[4]。此类GPCR可能是PCa治疗的可能靶标[5]。一些孤儿GPCR,如GPRC6A和GPR160,已被证明与PCa细胞增殖和疾病进展有关[6]。GPR19编码一种进化上保守的孤儿GPCR,最初是通过筛选人类表达序列数据库(EST)确定的。其在成人的中枢神经系统中呈高表达,在卵巢和睾丸组织中呈中度表达[7]。研究证实,GPR19在小细胞肺癌中的表达水平与生长优势相关[8],也能通过调节E-钙黏蛋白表达来影响乳腺癌的侵袭性[9]。但目前GPR19在PCa中的报道少见,本研究通过分析PCa患者中GPR19的表达水平,探讨GPR19是否可通过调节细胞周期促进PCa发展,为PCa的治疗提供新的靶点。
1 材料与方法
1.1 主要试剂与仪器 正常前列腺细胞系RWPE-1及6种PCa细胞系LNCaP、DU145、PC3、22RV1、C4-2、VCap均由天津市泌尿外科研究所冻存、复苏;RPMI-1640培养基、胰酶购自以色列BI公司;胎牛血清(FBS)购自中国MRC公司;RNA提取试剂盒购自美国Omega Biotek公司;逆转录试剂盒购自美国光大公司,细胞总蛋白提取试剂、蛋白酶抑制剂、BCA法蛋白浓度测定试剂盒购自中国索莱宝公司;蛋白Marker、KSFM培养基和全自动酶标仪购自美国Thermo Fisher公司;罗氏转染试剂购自美国默克公司,EdU检测试剂盒、兔抗GPR19抗体购自中国Abbkine公司;兔抗CDK1抗体、鼠抗GAPDH抗体、羊抗兔及羊抗鼠二抗均购自中国Proteintech公司。针对GPR19的特异性siRNA购自吉玛基因(苏州)。FV1000倒置荧光显微镜购自日本Olympus公司,PCR扩增仪购自德国Eppendorf公司。
1.2 生物信息学分析 利用R语言分析TCGA及Oncomine数据库,得到GPR19在PCa中的差异表达情况;GEPIA网站分析GPR19的无进展生存率;R语言“dplyr”包分析GPR19在不同临床病理特征患者中的分布情况,“survival”包进行Cox回归分析;GSEA软件进行GPR19基因的通路富集分析。
1.3 细胞培养 人正常前列腺细胞系RWPE-1使用含有生长因子的K-SFM培养基,6种PCa细胞系均采用含10%胎牛血清的RPMI-1640培养基,于37℃、5%CO2的细胞培养箱中培养,细胞生长至80%左右进行传代。
1.4 Western blot待细胞密度生长至80%左右后用蛋白提取试剂提取总蛋白,BCA法测定所提蛋白质浓度,加入上样缓冲液后95℃变性5 min。每孔加30µg蛋白行SDS-PAGE后电转至NC膜。5%脱脂牛奶室温下封闭1 h,4℃过夜孵育GAPDH(1∶1 500),CDK1(1∶500),GPR19(1∶1 000)一抗,次日室温孵育二抗1 h。ECL化学发光法对蛋白条带进行成像处理。Image J软件测量灰度值,计算目的蛋白表达量。目的蛋白表达量=目的蛋白灰度值/内参GAPDH灰度值,实验重复3次。
1.5 qPCR采用RNA提取试剂盒提取细胞总RNA。使用逆转录试剂盒将总RNA(1 µg)反转录成cDNA。GAPDH作为内参对照。所用引物见表1。反应条件为:95℃预变性5 min,95℃10 s、60℃20 s、72℃30 s进行45个循环,采用2-ΔΔCt法计算mRNA相对表达量,实验重复3次。

Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.6 细胞转染 取对数生长期的LNCaP细胞接种于6孔板中,每孔约2×105个细胞,置于37℃、5%CO2的培养箱中培养24 h。然后使用转染试剂将细胞与siGPR19或者siRNA NC共同孵育4 h,分别设为siGPR19组和Control组。siRNA序列为:正义链5'-CCUUCACUAUGUGCUGAAATT-3',反义链5'-UUUCAGCACAUAGUGAAGGTT-3'。通过qPCR检测敲低效率,步骤同1.5。
1.7 EdU细胞增殖实验siGPR19组和Control组细胞培养24 h后,加入EdU染料孵育4 h,然后对细胞进行固定、通透、孵育EdU检测试剂,最后使用荧光显微镜对细胞进行观察计数。蓝色为DAPI进行核定位,橙色为EdU染料标记增殖细胞,细胞增殖率(%)=增殖细胞数/细胞总数×100%。
1.8 统计学方法 采用R(v3.6.3)及Graphpad Prism 8.0进行数据分析。符合正态分布的计量数据以均数±标准差(±s)表示,2组间均数比较用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验。相关性分析采用Spearman相关。P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析PCa中GPR19的表达TCGA和Oncomine数据库分析显示,PCa组织中GPR19mRNA表达量高于癌旁组织,此外,在TCGA数据库多个患者队列信息中显示GPR19表达升高的患者无进展生存时间明显缩短,见图1。
2.2 TCGA数据库分析GPR19 mRNA表达与患者临床特征关系 分析不同临床特征患者GPR19表达水平发现,GPR19高表达比例无进展死亡患者高于存活患者,Gleason评分>7分患者高于≤7分患者,T3~T4期患者高于T1~T2期患者,年龄>60岁患者高于≤60岁患者,见表2。
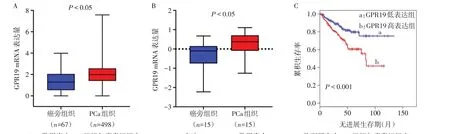
Fig.1 Bioinformatic analysis of GPR19 expression in prostate cancer图1生物信息学分析GPR19在PCa中的表达及与预后的关系

Tab.2 GPR19 expression in patients with different clinicopathological features表2不同临床病理特征患者GPR19基因表达情况
2.3 影响PCa患者无进展生存的Cox回归分析 在单因素Cox回归分析中,Gleason评分、TNM分期和GPR19表达是PCa患者无进展生存的影响因素,见表3。但在多因素Cox分析中,仅Gleason评分>7分是PCa的独立危险因素,见表4。
2.4 不同PCa细胞系中GPR19 mRNA和蛋白表达情况 与正常前列腺细胞RWPE-1相比,PCa细胞系VCaP、LNCaP、C4-2、22RV1、PC3、DU145中GPR19 mRNA表达升高。Western blot结果也显示,PCa细胞系中GPR19蛋白水平表达也有不同程度的升高,见表5,图2。鉴于GPR19 mRNA及蛋白在LNCaP细胞中的表达均较高,后续使用LNCaP细胞进行验证。

Tab.3 Univariate Cox regression analysis for prostate cancer relapse-free survival表3 PCa无进展生存的单因素Cox回归分析

Tab.4 Multivariate Cox regression analysis for prostate cancer relapse-free survival表4 PCa无进展生存的多因素Cox回归分析
2.5 GPR19敲除效率验证 在LNCaP细胞中,siGPR19组GPR19 mRNA表达低于Control组(0.10±0.02vs.0.99±0.01,n=3,t=16.056,P<0.05)。
2.6 敲低GPR19对PCa细胞增殖的影响EdU增殖实验结果显示,与Control组相比,siGPR19组LNCaP细胞增殖率下降(33.24%±2.47%vs.45.79%±1.21%,n=3,t=12.164,P<0.05),见图3。
2.7 GPR19 GESA通路富集分析GSEA通路富集分析结果显示,GPR19基因能够被G2M信号检查点、E2F信号靶点、精子发生、DNA修复等7个通路富集,见图4。
Tab.5 Expression of GPR19 mRNA and GPR19 protein in each cell line表5各细胞系中GPR19 mRNA及其蛋白相对表达(±s)

Tab.5 Expression of GPR19 mRNA and GPR19 protein in each cell line表5各细胞系中GPR19 mRNA及其蛋白相对表达(±s)
*P<0.05;a与RWPE-1细胞比较,P<0.05。
细胞系RWPE-1 C4-2 PC3 LNCaP VCaP 22RV1 DU145 F n3333333 GPR19 mRNA 0.989±0.029 2.104±0.120a 3.208±0.122a 8.661±0.354a 2.009±0.244a 1.701±0.052a 3.718±0.451a 331.000*GPR19蛋白0.389±0.133 0.960±0.129a 0.745±0.148a 0.941±0.013a 0.416±0.297 0.329±0.272 0.724±0.225 5.478*

Fig.2 Results of GPR19 protein expression in different PCa cell lines图2不同PCa细胞系中GPR19蛋白表达结果
2.8 敲低GPR19对PCa细胞G2M信号检查点通路的影响GPR19与G2M信号检查点通路的关键基因CDK1存在较高的相关性(r=0.510),见图5A;与Control组相比,siGPR19组CDK1的mRNA相对表达量降低(0.483±0.033vs.0.939±0.105,n=3,t=7.175,P<0.05),Western blot结果显示CDK1的蛋白表达也有降低趋势,见图5B。
2.9 GPR19影响PCa发生发展的下游靶基因的预测 由于在PCa中E2F信号靶点和G2M信号检查点信号通路被预测为高度激活,这2个通路的基因组中发现有73个基因重叠,在这些共有基因中,CDKN3的表达与GPR19基因表达的相关性最高,见图6。

Fig.3 The cell proliferation efficiency after GPR19 knockdown detected by EdU proliferation assay图3敲低GPR19后EdU增殖实验检测细胞增殖效率
3 讨论
目前GPR19在肺癌[7]、乳腺癌[8]、肾上腺癌[10]等肿瘤发病中的作用已被广泛报道,但其在PCa中的致癌机制仍不清楚。本研究首先通过2个PCa独立队列研究的数据分析发现,PCa患者中GPR19表达水平升高,进一步分析结果显示,GPR19的表达与Gleason评分、TNM分期、年龄、无进展生存率相关,而Gleason评分是有力的预后预测因素,能够更好地识别高风险和低风险患者[11]。单因素Cox分析中也发现GPR19的表达与无进展生存有关,多因素Cox分析显示GPR19并非预后的独立影响因素,但从对其无进展生存率及其他临床特征关系的分析可以看出,GPR19对于PCa的发生发展仍具有一定的作用,因此,本研究从生物信息学及细胞行为学方面进行验证,推测GPR19可能为PCa的研究提供新的靶点方向。
本研究进一步通过qPCR和Western blot实验对生物信息学的预测进行验证,结果发现PCa细胞系的GPR19 mRNA和蛋白水平表达高于正常前列腺上皮细胞,与生信分析结果一致。EdU实验结果显示,敲低GPR19后能够降低肿瘤细胞的增殖效率。
为了探究GPR19在PCa中的作用机制,笔者对GPR19进行GSEA通路富集分析,结果显示在周期相关通路E2F信号靶点、G2M信号检查点中有较高的富集分数。E2F、G2M是细胞周期的特异性基因[12],已有研究证实GPR19可通过调节细胞周期来影响肺癌的发展[7]。CDK1作为G2M信号检查点上的关键蛋白分子,主要调节G2M相变,其功能也不能被其他CDK代替[13-14]。研究表明,CDK1不仅调节细胞周期,而且也在肿瘤细胞的增殖中发挥重要作用[15]。细胞质中CDK1的积累与上皮性卵巢癌的存 活 率 相 关[16]。本 研 究 发 现,TCGA数 据 库 中GPR19与CDK1 mRNA表达量具有一定的相关性,实验验证敲低GPR19后PCa细胞中CDK1的蛋白及mRNA表达均降低。因此,预测GPR19可能通过促进CDK1的表达进一步影响细胞周期,从而影响肿瘤细胞增殖,这可能就是EdU实验结果siGPR19组细胞增殖率下降的原因。CDKN3作为与GPR19相关性较强的基因,已有研究[17]证实,其可通过调节细胞周期和DNA复制来影响PCa,在其他癌症如直肠癌、肾细胞癌、肝癌中也被证明发挥了一定作用[18-20]。以上研究提示GPR19可能与CDKN3存在上下游关系,共同通过调节细胞周期来影响PCa的进展。

Fig.4 Pathway enrichment analysis of GPR19 in prostate cancer图4 PCa中GPR19的通路富集分析
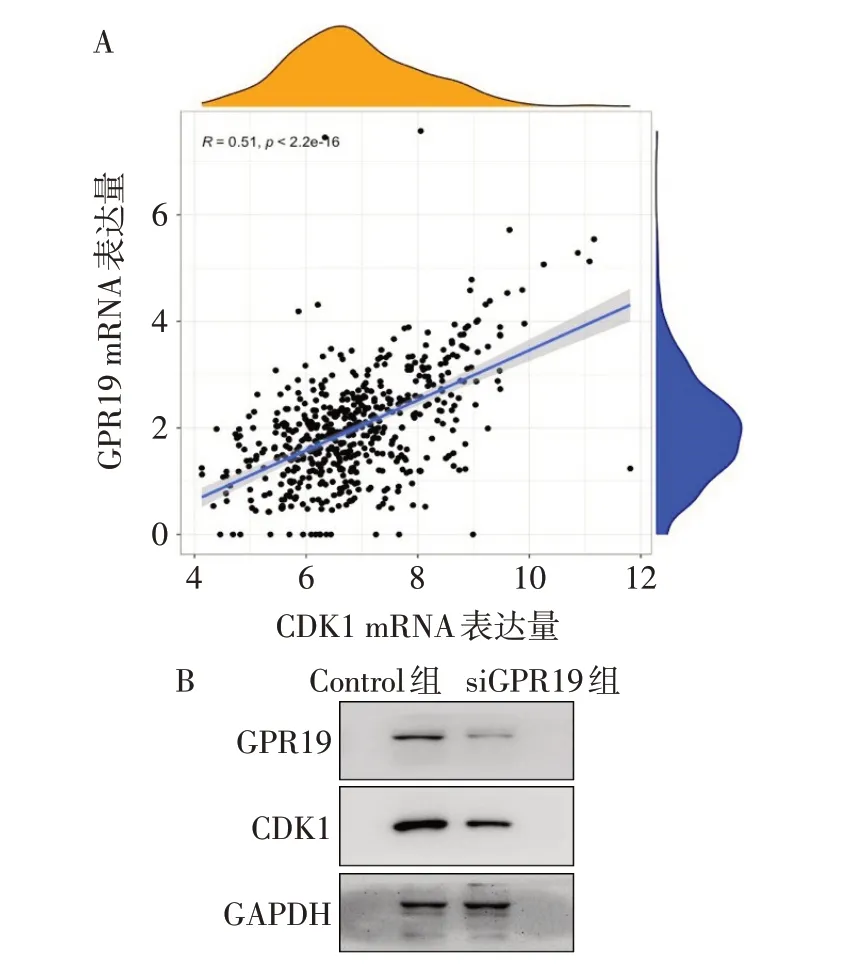
Fig.5 The relationship of GPR19 and CDK1,a key molecule on the G2M checkpoint图5 GPR19与G2M检查点关键分子CDK1的相关性

Fig.6 Correlation between GPR19 and genes in the periodic pathway图6 GPR19与周期通路中基因的相关性
综上所述,本研究证实GPR19基因在PCa中高表达,并与多个临床要素相关。下调GPR19表达可抑制PCa细胞的增殖及降低G2M信号检查点关键分子CDK1的表达,预测CDKN3可能与GPR19共同调节肿瘤细胞周期来影响PCa的发生与进展。本研究为进一步全面了解GPR19在PCa中的作用及后续的研究提供了有价值的信息。

