Hepcidin-25、HbA2、PON1表达水平在预测妊娠期缺铁性贫血中的价值
晋艳婷,赵兴丹,翁艾罕,李素皎
海南省妇女儿童医学中心输血科,海南海口 570100
缺铁性贫血是一种多发于妇女儿童的贫血症,是由于缺铁,血红蛋白无法正常合成,红细胞生成受限所导致。约50%的孕妇会出现贫血,且大多数为缺铁性贫血[1]。缺铁患者多出现面色苍白、倦怠、食欲不佳、恶心、腹泻、吞咽困难等症状[1],久病者甚至会出现指甲皱缩、反甲、皮肤干枯、毛发干燥等[2],致使孕妇的抵抗力下降、妊娠不良风险增加、后续生产的风险增加。孕妇轻中度贫血对胎儿的影响不大,但重度贫血会引发胎儿生长受限,甚至发生早产或死胎等不良妊娠结局。妊娠期缺铁会对母体和胎儿造成严重的不良后果,因此,应高度重视妊娠期缺铁性贫血的诊疗。铁调素-25(Hepcidin-25)是一类调节铁平衡的多肽,主要在肝脏中产生,是铁代谢的关键调节因子[2]。血红蛋白A2(HbA2)在健康成人体内占血红蛋白总量的2.5%~3.5%[1],缺铁性贫血会导致HbA2水平降低[2]。氧磷酶1(PON1)是人体内重要的生物活性物质,在肝脏中合成,已有研究表明,PON1水平降低可预测患者缺铁性贫血的发生[3]。在临床治疗上,缺铁性贫血还容易与珠蛋白生成障碍性贫血和慢性炎症性贫血、铁粒幼细胞性贫血的诊断混淆,本研究探讨了Hepcidin-25、HbA2、PON1在妊娠期缺铁性贫血中的诊断效能,现报道如下。
1 资料与方法
1.1一般资料 选取2019年4月至2020年4月本院收治的60例妊娠期缺铁性贫血患者作为观察组,其中轻度贫血29例,重度贫血31例。(1)纳入标准:①所有患者均参照《妊娠期铁缺乏和缺铁性贫血诊治指南》相关标准确诊为妊娠期缺铁性贫血;②临床各项检查资料完整;③无妊娠期其他并发症。(2)排除标准:①合并其他器官及系统的重大疾病;②合并血液系统其他疾病;③未满18岁;④患有精神类疾病。选取同期60例未出现缺铁性贫血孕妇作为对照组,孕检各项指标均正常。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。所有研究对象均自愿参与本研究,且签署知情同意书。本研究经过本院医学伦理委员会批准。

表1 两组基线资料比较
1.2方法
1.2.1标本采集 抽取所有研究对象孕24~28周空腹静脉血3.0 mL,置于含分离胶与促凝剂的黄色真空采血管及乙二胺四乙酸二钾(EDTA-K2)抗凝紫色真空采血管中,充分混匀并在2 h内送检。分离血清,黄色真空采血管的血清标本用于检测PON1活力,紫色真空采血管的血清标本用于HbA2、Hepcidin-25水平检测。
1.2.2指标检测 采用酶联免疫吸附试验(ELISA)检测血清Hepcidin-25水平,试剂盒由美国CUSABIO公司生产。采用SEBIA全自动高压液相毛细管电泳仪(法国Sebia公司)检测血清HbA2水平,试剂盒为仪器配套试剂盒。采用化学发光免疫分析法检测血清PON1水平,试剂盒购自上海泽叶生物科技有限公司。所有检测流程参照试剂盒说明书及相关标准操作规程进行。
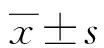
2 结 果
2.1两组Hepcidin-25、HbA2、PON1水平比较 观察组的Hepcidin-25、HbA2、PON1水平明显低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组Hepcidin-25、HbA2、PON1水平比较
2.23项指标对妊娠期缺铁性贫血的诊断效能 Hepcidin-25、HbA2、PON1诊断妊娠期缺铁性贫血的曲线下面积(AUC)分别为0.973、0.915、0.993,3项指标均有较好的诊断效能。见表3。
2.33项指标对妊娠期缺铁性贫血的影响 多因素Logistic回归分析结果显示,Hepcidin-25≤103.22 ng/mL、HbA2≤2.21%、PON1≤556.89 U/L是妊娠期缺铁性贫血发生的独立危险因素(P<0.05)。其中影响最大的独立危险因素是Hepcidin-25,最小的是HbA2。见表4。
2.4构建预测妊娠期缺铁性贫血的Nomogram模型 将Hepcidin-25(≤103.22 ng/mL)、HbA2(≤2.21%)、PON1(≤556.89 U/L)纳入Nomogram模型,构建妊娠期缺铁性贫血的预测模型。见图1。
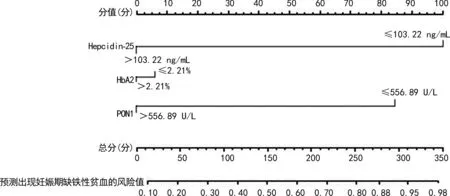
注:第一行点线代表着每个影响因素对应的分数;第二行至第四行分别表示3个影响因素;第五行表示各个影响因素的总分;最后一行表示发生缺铁性贫血的概率。每个影响因素轴线上的值向上做一条垂线对应到点线上,确定每个影响因素的分值,计算3个影响因素的总分。
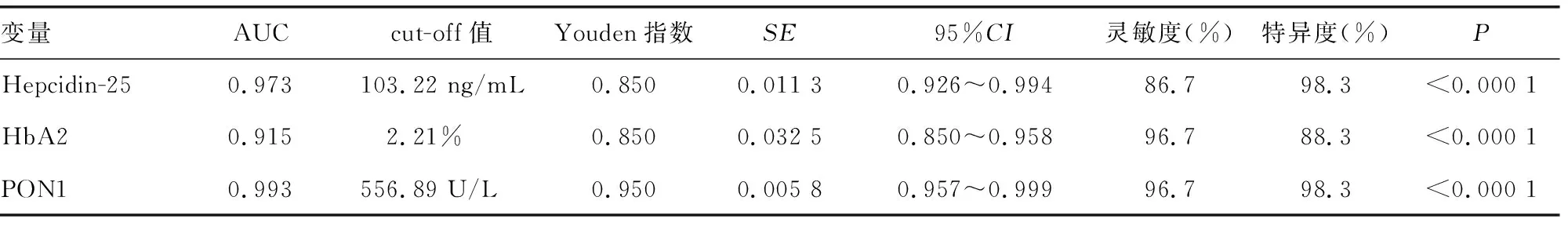
表3 3项指标对妊娠期缺铁性贫血的诊断效能

表4 3项指标诊断妊娠期缺铁性贫血的多因素Logistic回归分析
2.5Nomogram模型校正曲线及临床净收益分析 内部验证结果显示,Nomogram模型预测出现妊娠期缺铁性贫血的C-index 为0.764(95%CI:0.413~1.201)。校正曲线显示观测值与预测值之间保持较好一致性。见图2。Nomogram模型预测妊娠期缺铁性贫血出现的风险阈值为>0.086,Nomogram模型提供了临床净收益。此外,DCA 曲线显示该Nomogram预测模型的临床应用价值较高,净收益均高于Hepcidin-25、HbA2、PON1。见图3。
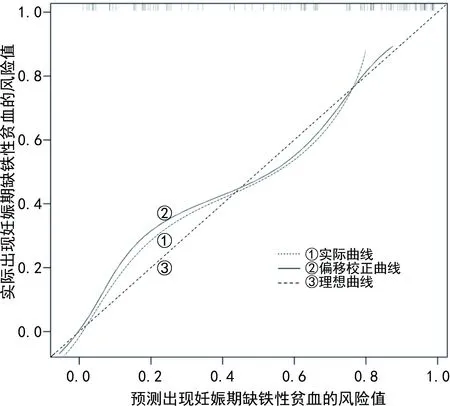
图2 Nomogram模型校正曲线
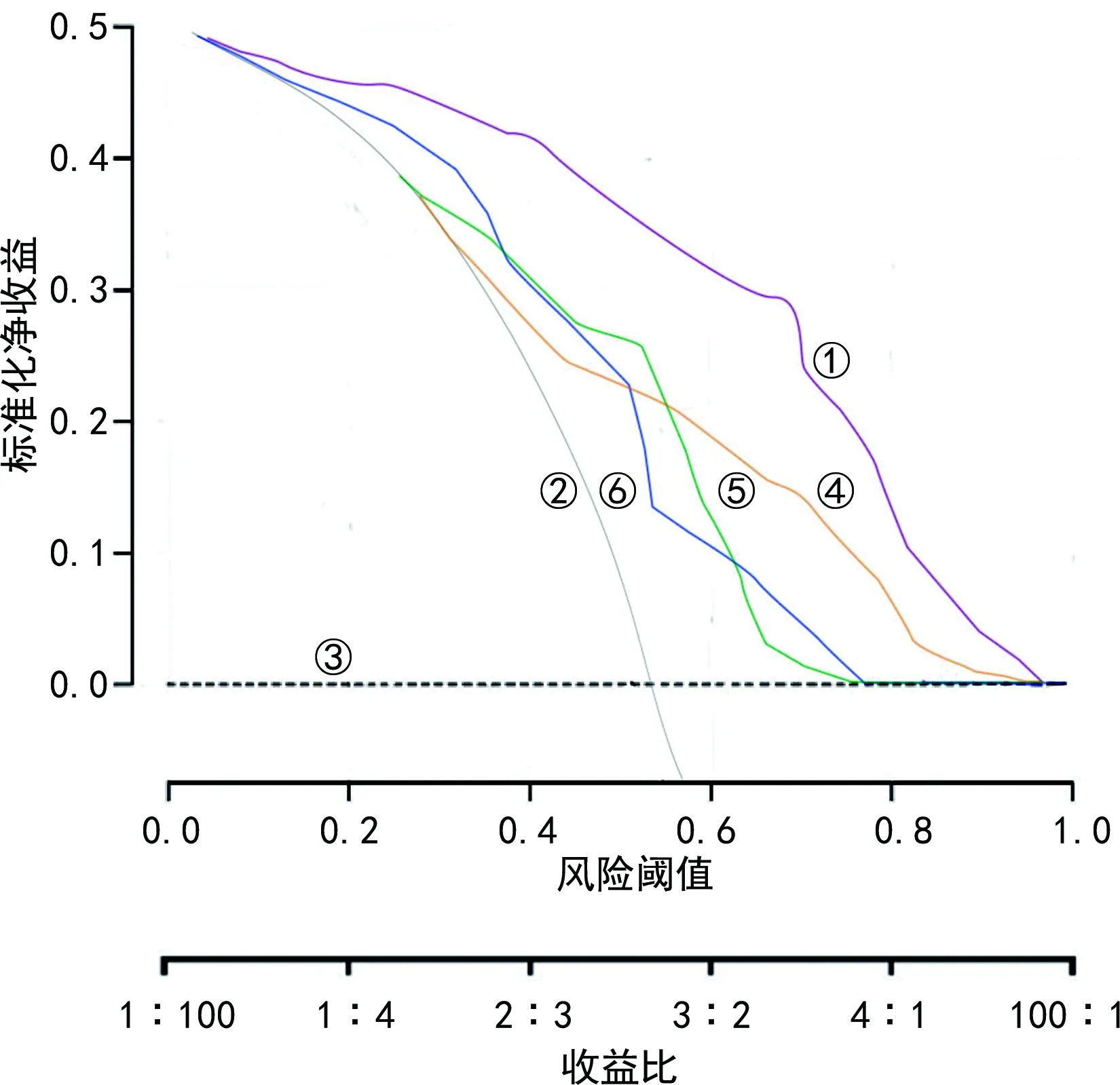
注:①代表Nomogram预测模型;②代表当所有患者用常规方法去预测并进行治疗,所获得的临床收益;③代表假设所有患者都不进行预测,也不治疗,所获得的临床收益为0;④为Hepcidin-25;⑤为HbA2;⑥为PON1。
3 讨 论
妊娠期缺铁性贫血作为影响孕妇健康和生命的危险因素,是一种妊娠期常见的并发症,尤其多发于孕中晚期。孕早期食欲不振、妊娠反应带来的身体不适,以及胎儿发育、孕妇血容量增加导致了血液稀释,铁吸收减少,使孕妇血红蛋白合成不足、红细胞生成不足,最终引发了贫血[1]。我国妊娠期缺铁性贫血发病率较高且逐年递增[2]。铁缺乏会影响到新生儿长期的健康。临产时缺铁性贫血会导致孕妇剖宫产的概率增加,增加生产风险。即使在孕晚期纠正贫血也可能无法阻止不良妊娠结局的发生。目前,临床用于确诊缺铁性贫血的手段是骨髓穿刺涂片,需要对患者进行侵入性操作,其应用具有很大的局限性。因此,寻找一个合适的可用于无创诊断缺铁性贫血的指标是现阶段亟待解决的大问题。
相关研究数据表明,妊娠期缺铁性贫血患者血清Hepcidin-25水平下降,低血清水平Hepcidin-25是孕妇发生妊娠期缺铁性贫血的独立危险因素[3],本研究也验证了这一结论。观察组的血清Hepcidin-25水平明显低于对照组,且ROC曲线显示该指标对妊娠期缺铁性贫血也有较好的诊断效能。多因素Logistic回归分析结果显示,血清Hepcidin-25≤103.22 ng/mL为孕妇发生妊娠期缺铁性贫血的独立危险因素。Hepcidin-25为膳食铁吸收和体内铁分布的中心调节剂,导致血清Hepcidin-25水平下调最重要的因素是缺铁。肽激素通过结合作用来降低血液循环中的铁,调节铁输出蛋白及铁转运蛋白。缺铁是导致贫血的重要原因,而孕妇出现贫血的主要原因在于孕妇特殊的铁需求,发育中的胎儿需要较多的铁元素。吸收的铁不足以满足怀孕后期的需求,进而引发母体出现了缺铁性贫血的症状。
相关研究表明,HbA2可作为监测妊娠期缺铁性贫血的指标[4]。本研究通过ROC曲线分析及多因素Logistic回归分析,发现HbA2≤2.21%也是妊娠期缺铁性贫血发生的独立危险因素。本研究结果表明,观察组的HbA2水平明显低于对照组,差异有统计学意义(P<0.05)。这一表现的原因正是由于铁供给与需求的失衡[5-7],影响了血红蛋白的正常生成[8-10]。因此,可以根据患者的HbA2水平,在宏观上预测缺铁性贫血症的发生。
PON1在肝脏中分泌,在血液中紧密固定在高密度脂蛋白上,可抑制低密度脂蛋白的氧化修饰,并水解具有生物活性的溶血磷脂等脂质过氧化物[11-15]。以往研究表明PON1水平在妊娠期缺铁性贫血患者中明显降低[16-21],本研究也证实了这一观点。本研究进一步分析了PON1的诊断效能,并进行了多因素Logistic回归分析,结果显示PON1在妊娠期缺铁性贫血中具有较好的诊断效能,且PON1≤556.89 U/L是妊娠期缺铁性贫血的独立危险因素。
在以上分析结果的基础上,利用3项指标构建Nomogram模型,Nomogram模型预测出现妊娠期缺铁性贫血的C-index 为0.764(95%CI:0.413~1.201)。校正曲线显示观测值与预测值之间保持了较好一致性。Nomogram模型预测妊娠期缺铁性贫血出现的风险阈值为>0.086,Nomogram模型提供了临床净收益。Nomogram模型临床净收益均高于Hepcidin-25、HbA2、PON1。综上所述,本研究证实,Hepcidin-25、HbA2、PON1在妊娠期缺铁性贫血患者中的水平均与健康对照者差异有统计学意义(P<0.05),构建Nomogram模型可用于临床对妊娠期缺铁性贫血的预测。
本研究在既往研究基础上,既验证了前人研究的准确性,还使用建模的方法对患者患病的风险因素进行进一步分析,并采用新颖的Nomogram模型预测了妊娠期缺铁性贫血出现的风险,该模型可以通过整合不同的相关变量,来生成临床事件发生的单个数值概率[22-23],满足对生物和临床整合模型需求,推动个性化医疗,以协助临床决策[24-25]。从而实现对不同孕期患者进行分层对症治疗,通过膳食和药物补充患者缺少的铁元素,从根本上改善患者的病情。

