极度濒危植物狭叶坡垒种子脱水敏感性研究
黄 宁,刘雄盛,廖南燕,王仁杰,黄荣林,蒋 燚,肖玉菲,王凌晖
(1.广西大学,广西南宁 530004;2.广西壮族自治区林业科学研究院 广西优质用材林资源培育重点实验室,广西南宁 530002;3.广西防城金花茶国家级自然保护区,广西防城港 538021)
种子是植物种群繁衍、更新和扩散的基础。根据种子贮藏特性,可将其分为正常性种子、中间性种子和顽拗性种子[1]。其中,顽拗性种子在脱离母株前未经干燥失水,脱离母株后含水率较高(30%~60%),内部代谢较活跃,一旦遭遇干旱,种子会快速失水,加剧膜脂过氧化作用,破坏细胞膜结构和功能,导致自由基积累和抗氧化保护系统活性降低,致使细胞内部生理代谢活动紊乱[2-3]。当种子脱水超过某一临界值时,种子的寿命和活力将大幅降低,甚至完全失活而不能萌发[2]。珍稀濒危植物金丝李(Garcinia paucinervis)种子失水率超过18.0%时,其萌发率显著下降;失水率达42.0%时,种子完全失活,萌发率为0[4]。银杏(Ginkgo biloba)种子含水量降至40.1%时,发芽率降至50.0%;含水量降至25.0%时,种子萌发率降至20.0%,SOD 活性达最大值[5]。掌握顽拗性种子的脱水敏感性和生理生化特征对植物种质资源保存、苗木培育及引种栽培均有深远意义[5]。
狭叶坡垒(Hopea chinensis)为龙脑香科(Dip‑terocarpaceae)坡垒属常绿乔木,为桂南北热带常绿季雨林代表树种之一,对研究热带雨林区系构成、地理分布和生态习性有重要价值。其材质坚硬,耐腐力极强,被称为“万年木”,可应用在军工、机械和高级家具等领域;树皮具龙袍状花纹,亦有“龙袍树”之称[6]。狭叶坡垒为第三纪残留种,分布在局部地形形成的“避难所”中,原分布于广西十万大山和大青山海拔600 m 以下的山麓、沟谷和山坡林中;由于人类活动,其生境丧失,个体数量下降,现只在广西十万大山区域内还有少量野生狭叶坡垒分布,已被《国家重点保护野生植物名录》列为国家Ⅱ级保护植物,被世界自然保护联盟(IUCN)列为极危(CR)物种[7],对其进行野生资源保护及人工扩繁迫在眉睫。
目前,对狭叶坡垒的研究主要集中在种群生态学特征[6,8]、光合特性[9]和迁地保护[7,10]等方面。唐文秀等[11]研究指出,狭叶坡垒种子含水量高,无休眠,易萌发,但若外界条件不合适,种子会很快失活,是典型的顽拗性种子。目前,关于狭叶坡垒种子生理学特性的研究较少,严重限制其种质资源的保存与利用。本研究通过定时测定自然脱水条件下狭叶坡垒种子的含水率,并测定种子萌发率、萌发势和萌发指数等萌发参数及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性及电导率和丙二醛(MDA)含量等生理指标,旨在探明其脱水敏感性及脱水条件下的生理特性,为狭叶坡垒种子保存及其保育和利用提供参考。
1 材料与方法
1.1 试验材料
2020年1月,在广西防城金花茶国家级自然保护区南山站(108°02′E,21°43′N)野生狭叶坡垒种群采集狭叶坡垒种子。为保证种子成熟度,所有种子均在从母树上自然脱落期间采集。采集后立即带回实验室,去除杂质后立即开展基本生物学测定和萌发试验。所有采集活动均获得当地管理部门和主管部门许可。
1.2 试验方法
1.2.1 种子基本特征和含水率测定
参照GB 2772-1999《林木种子检验规程》[12],采用四分法,随机选取50 颗种翅完整的健康种子,重复3次;采用游标卡尺(精度为0.01 mm)测量每粒种子的种翅长、种翅宽、种子长和种子宽4个形态指标(由于狭叶坡垒种子为圆形或椭圆形,仅测定种子长和宽,长度、宽度均选择样品的最长和最宽处进行测量),并计算种翅长宽比和种子长宽比。
采用四分法,随机挑选100粒健康种子,去种翅后,采用电子天平(精度为0.01 g)称重,重复5次,计算种子千粒重。
采用低恒温烘干法测定种子含水量。随机选取30 粒去种翅健康种子,在103 ℃下烘至恒重,重复3次。计算种子含水率(MC,%),计算公式为[12]:

1.2.2 种子脱水处理
参照张俊杰等[4]和文彬等[13]的方法,将采集后的狭叶坡垒种子摊开置于室内阴凉通风处,使其自然脱水,期间日均温为16.0 ~ 18.0 ℃,空气湿度为70%~85%。每2天取样1次,分为4份,1份用于种子含水率测定,1 份用于种子萌发特性测定,1 份用于种子相对电导率(RC)测定,另1份用于MDA含量及SOD和CAT活性测定。种子自然脱水持续20天,共取样10次。
1.2.3 脱水种子萌发试验
每次取样时,随机选取90 粒种子,用0.2%高锰酸钾溶液浸泡消毒5 min,流水冲洗后,分为3 个重复,每重复30 粒去种翅的健康种子,置于铺有2 层滤纸的120 mm 规格的培养皿中,放入条件为25 ℃、3 000 Lux 12 h/d 和80%相对湿度的培养箱内萌发。每天定时观察和记录种子萌发情况,并补充适量水分。20 天后结束试验,每重复随机选取10 株幼苗,分别测定幼苗根长和芽长(不足10 株则全部测量)。
种子萌发指标包括萌发率(GP,%)、发芽势(GE,%)、萌发指数(GI)、萌发时滞(GD,d)、萌发历期(D,d)及活力指数(VI),计算公式为[4,14-15]:

式中,Gt为第t天萌发的种子数;Dt为萌发天数。
GD 为第一粒种子萌发所需天数;D 为第一粒种子和最后一粒种子萌发的时间差。

式中,Lr和Ls分别为萌发试验结束时幼苗的根长(cm)和芽长(cm)(本研究中幼苗根长为胚根及胚轴的总长度)。
1.2.4 脱水种子生理指标测定
每次取样时,随机选取90粒种子,去种皮后,分为3 个重复,每重复30 粒,用电导仪测定种子相对电导率(RC)。随机取30 粒种子,去种皮后,分为3个重复,每重复10 粒,液氮极速冷冻后,保存于-80 ℃冰箱内。采用硫代巴比妥酸法测定种子MDA含量,采用氮蓝四唑法测定SOD 活性,采用紫外吸收法测定CAT活性[16]。
1.3 数据处理
采用Excel 2016 软件对种子形态、萌发和生理性状数据进行统计和作图。采用SPSS 19.0 软件对种子萌发和生理指标进行方差分析和多重比较(采用邓肯氏新复极差法);采用Pearson 相关系数对萌发和生理指标进行相关性分析。以上统计分析显著性水平均设定为α=0.05。
2 结果与分析
2.1 狭叶坡垒种子大小与含水率
狭叶坡垒种子呈卵圆形,被增长的5枚花萼裂片基部包裹,其中2枚花萼裂片增大为长圆状披针形或长圆形的翅。在广西防城港,狭叶坡垒种子每年12月—翌年1月成熟,成熟种子长为(13.67±1.06)mm,种子宽为(10.16 ± 0.82)mm,种子长宽比为(1.36 ±0.04);种翅长为(7.45 ± 0.77)cm,种翅宽为(1.85 ±0.04)cm,种翅长宽比为(4.04±0.17);种子千粒重为(470.73±25.55)g,种子含水率为(42.57±0.91)%。
2.2 自然脱水条件下种子含水率变化
狭叶坡垒种子初始含水率为42.57%;随脱水时间增加,种子含水率逐渐降低,呈二项式模型(图1)。不同脱水时间下,种子含水率差异极显著(P<0.01)。0~6天,种子含水率下降较快;6~14 天,种子含水率下降速度较慢;14~18 天,种子含水率下降速度较快;至18 天时,种子含水率为18.91%,比初始含水率降低55.58%。
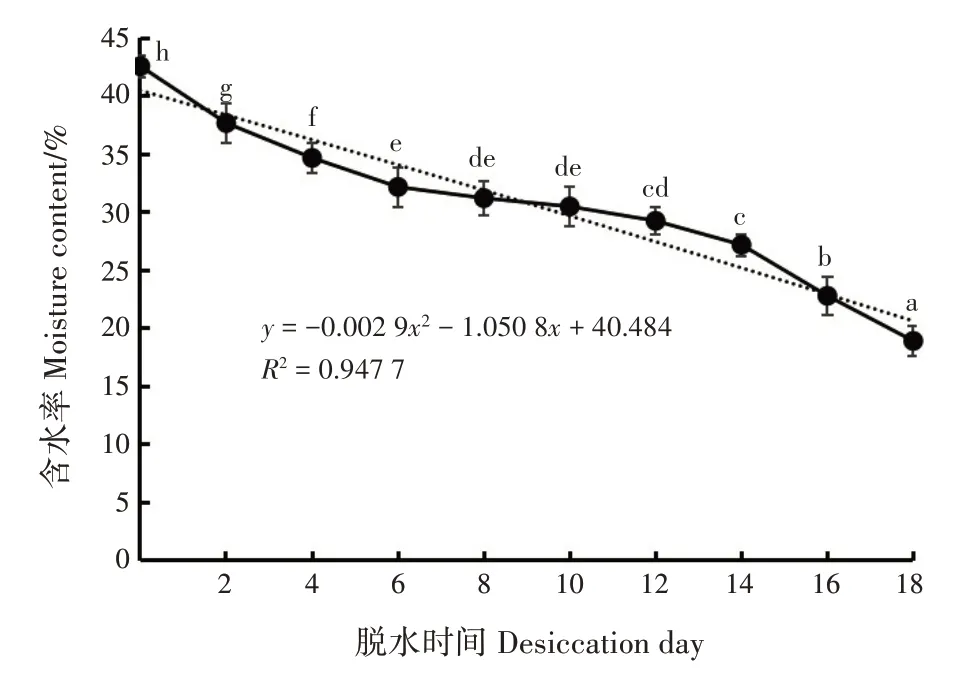
图1 不同脱水时间狭叶坡垒种子含水率变化Fig.1 Changes of moisture contents of H.chinensis seeds in different desiccation days
2.3 脱水种子萌发特性
不同脱水时间下,狭叶坡垒种子的萌发动态差异较大(图2)。脱水0 天的种子(新鲜种子)在萌发试验开始2天后开始萌发,3~12天为种子萌发高峰期,12~20 天萌发速度变缓。脱水2 和4 天的种子在萌发试验开始3天后开始萌发,4~10天为种子萌发高峰期,10~17 天萌发速度变缓,之后逐渐停止萌发。脱水6 天的种子在萌发试验开始5 天后开始萌发,6 ~ 13 天为种子萌发高峰期,13 ~ 17 天萌发速度变缓,17 天后逐渐停止萌发。脱水8 天的种子在萌发试验开始6天后开始萌发,7~11天为种子萌发高峰期,11~16 天萌发速度变缓,16 天后逐渐停止萌发。脱水10 天的种子在萌发试验开始7 天后开始萌发,8~11天为种子萌发高峰期,11~15天萌发速度变缓,15天后逐渐停止萌发。脱水12天的种子在萌发试验开始8天后开始萌发,9~11天为种子萌发高峰期,11~15 天萌发速度变缓,15 天后逐渐停止萌发。脱水14 天的种子在萌发试验开始9 天后开始萌发,10 ~ 11 天为种子萌发高峰期,11 ~ 15天萌发速度变缓,15 天后逐渐停止萌发。脱水16和18天的种子均失去活力,不能萌发。
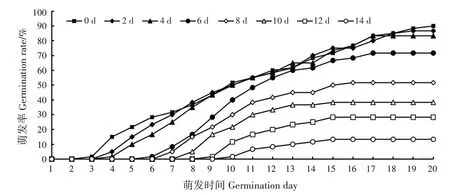
图2 不同脱水时间狭叶坡垒种子萌发动态Fig.2 Germination dynamics of H.chinensis seeds in different desiccation days
不同脱水时间下,狭叶坡垒的种子萌发率、发芽势、萌发指数、萌发时滞、萌发历期、活力指数、根长和芽长均差异极显著(P< 0.01)(图3)。随脱水时间增加,种子萌发率、发芽势、萌发指数、萌发历期、活力指数、根长和芽长均逐渐降低,萌发时滞逐渐增加。自然脱水0 ~ 4 天时,种子萌发率下降速度较慢;0 天时,种子萌发率为90.00%;4 天时,种子萌发率为83.33%,比0 天时下降7.41%。4 ~ 16 天时,种子萌发率快速下降;8 天时,种子萌发率降至51.67%,接近半致死;16 天时,种子完全失去活力,不能萌发。若以种子半致死率衡量种子寿命,狭叶坡垒种子寿命仅8天,16天后完全丧失活力。
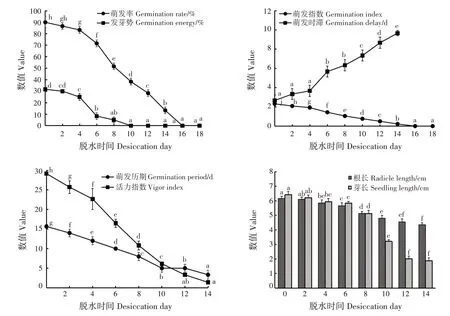
图3 不同脱水时间狭叶坡垒种子萌发特性Fig.3 Germination characters of H.chinensis seeds in different desiccation days
自然脱水0 天时,种子发芽势为31.67%;4 天时,种子发芽势为25.00%,下降速度较慢;4天后,快速下降;10 天时,发芽势降为0。自然脱水0 天时,种子萌发指数为2.32;随脱水时间增加,萌发指数显著下降(P<0.05);16天时降至0。自然脱水0天时,种子萌发时滞为2.8 天,与自然脱水2 和4 天的种子萌发时滞差异不显著;4 天后,种子萌发时滞显著上升(P< 0.05);14 天时,种子萌发时滞为9.7 天。自然脱水0 天时,种子活力指数和萌发历期分别为29.18 和15.7 天,之后显著下降(P<0.05);14 天时,种子活力指数和萌发历期分别为1.39 和3.3 天,下降幅度分别为95.24%和78.98%。
不同脱水时间下,种子根长和芽长变化趋势基本一致,均呈逐渐下降趋势。自然脱水0天时,根长和芽长分别为6.16 和6.41 cm;0~4 天时,根长和芽长下降速度缓慢;4天后,快速下降;14天时,根长和芽长分别为4.36 和1.88 cm,下降幅度分别为29.22%和70.67%。
2.4 脱水种子生理特性
不同脱水时间下,狭叶坡垒种子的相对电导率、MDA 含量及SOD 和CAT 活性均差异极显著(P<0.01)(图4)。随脱水时间增加,种子相对电导率和MDA 含量均逐渐增加;SOD 活性呈“W”型,波动性升降;CAT 活性呈先升后降的趋势。自然脱水0 天时,种子相对电导率和MDA 含量分别为53.40%和31.93 μmol/g;18天时,种子相对电导率和MDA含量分别为105.87%和202.83 μmol/g,增幅分别为98.26%和535.23%。
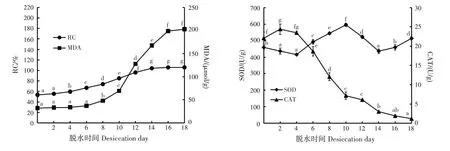
图4 不同脱水时间狭叶坡垒种子生理变化Fig.4 Physiological changes of H.chinensis seeds in different desiccation days
自然脱水0 天时,种子SOD 活性为459.14 U/g;之后降低,4天时降至436.74 U/g;之后上升,10天时升至最高(595.50 U/g);之后又逐渐降低,14 天时降至最低(436.39 U/g);之后又上升。自然脱水0 天时,种子CAT 活性为22.07 U/g;2 天时,CAT 活性升至最高(24.40 U/g),之后快速下降;18 天时降至1.92 U/g,比0天时下降91.30%。
2.5 种子萌发与生理性状的关系
种子含水率、萌发率、萌发指数、萌发历期、根长、芽长及活力指数均与相对电导率和MDA含量呈极显著负相关(P< 0.01),与CAT 活性呈极显著正相关(P<0.01)(表1)。SOD 活性与9个萌发指标均无显著相关性。
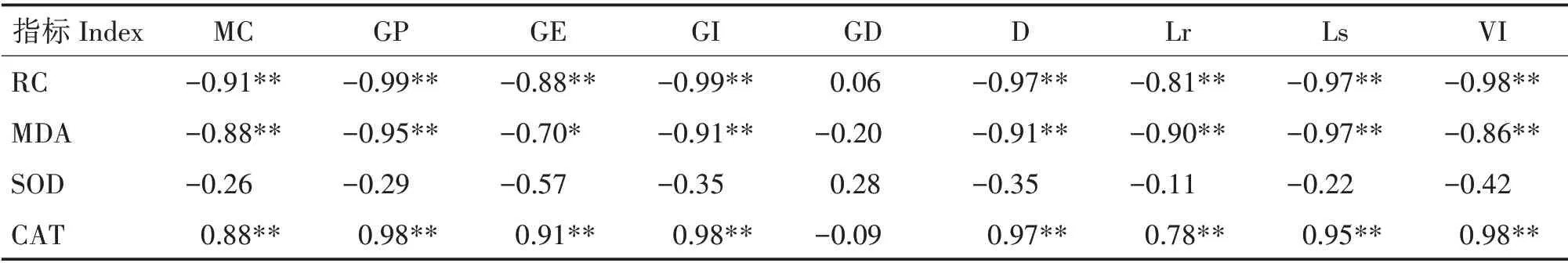
表1 狭叶坡垒种子萌发指标与生理指标的相关性Tab.1 Correlations among germination indexes and physiological indexes of H.chinensis seeds
3 讨论与结论
狭叶坡垒种子初始含水率为42.57%,初始萌发率为90.00%。自然条件下,狭叶坡垒种子失水较快,随种子含水率降低,种子萌发率逐渐降低;种子含水率高于34.67%时(自然脱水前4 天),种子萌发率、发芽势和萌发指数降幅均较小;4天后,3个萌发指标下降速度较快,说明狭叶坡垒种子能忍受轻度脱水。狭叶坡垒种子自然脱水8 天时,种子含水率为31.21%,此时的种子萌发率为51.67%,接近半致死,说明狭叶坡垒种子寿命较短,8 天内若没有适宜的萌发环境,种子极易失去活力,这可能是野外狭叶坡垒林下幼苗较少的原因之一。自然脱水16 天后,狭叶坡垒种子含水率降至22.80%,此时种子完全失去活力,与坡垒(Hopea hainanensis)[17]、多毛坡垒(Hopea mollissima)[13]和绒毛番龙眼(Pometia to⁃mentosa)[18]等热带雨林植物相似,符合顽拗性种子特性,且属于高度顽拗性类型[19],对脱水高度敏感。
相关研究表明,顽拗性种子含水率高,大多能迅速萌发,不存在休眠现象[20-21]。狭叶坡垒种子亦是如此,采收后2天可萌发,无休眠期。随种子含水率降低,狭叶坡垒种子萌发时滞逐渐增加,与金丝李研究结果一致[4],可能是脱水导致种子代谢遭到破坏,待自身修复后才能萌发,萌发启动时间延长[22]。狭叶坡垒种子的活力指数、根长和芽长均随脱水时间增加呈下降趋势,与蒲葵(Livistona chinen⁃sis)种子类似[23],与辽东栎(Quercus wutaishansea)种子不同[21],这可能是因为不同树种种子的内源激素含量和酶活性有差异[24-25]。
相对电导率是衡量细胞膜透性的主要指标,其值越大,细胞电解质渗漏量越多,细胞膜受损程度越大[26]。丙二醛是细胞膜脂过氧化的终产物,会加剧细胞膜损伤,且具有改变细胞蛋白质结构和功能、降低抗氧化保护酶活性等毒性作用[4]。常用相对电导率和丙二醛含量衡量种子受害程度[4,27]。本研究中,随种子含水率降低,狭叶坡垒种子相对电导率和丙二醛含量逐渐上升,与桢楠(Phoebe zhen⁃nan)[16]、蒲葵[23]和马拉巴栗(Pachira glabra)[28]种子研究结果一致。相关分析表明,相对电导率和丙二醛含量与含水率、萌发率、萌发指数及活力指数均呈极显著负相关,说明脱水导致的细胞膜损伤是狭叶坡垒种子劣变的主要原因。
相关研究表明,种子内抗氧化酶系统能在一定程度上抵御脱水引起的自由基及膜脂过氧化作用对细胞膜造成伤害[29-31]。本研究中,随狭叶坡垒种子含水率逐渐降低,超氧化物歧化酶活性呈波动性升降,过氧化氢酶活性呈先升后降的趋势。脱水前期(0~4天),种子过氧化氢酶活性比0天时升高,超氧化物歧化酶活性下降,说明过氧化氢酶先启动,分解过氧化氢对种子的危害;此时,种子维持较高萌发率,说明狭叶坡垒种子脱水前期主要受过氧化氢危害,且过氧化氢酶能维持细胞膜完整性;期间,种子相对电导率和丙二醛含量基本保持平稳,也能说明这一点;过氧化氢酶是该时期的敏感性保护酶。随脱水时间增加,过氧化氢酶活性快速下降,超氧化物歧化酶活性快速上升,至第10 天达到峰值,之后快速下降;种子相对电导率和丙二醛含量快速上升;种子萌发率快速下降;说明脱水导致种子内部产生大量自由基,对种子产生严重毒害;10天后,毒害超出种子耐受范围,超氧化物歧化酶活性骤降,不能有效清除自由基,种子逐渐失活。在狭叶坡垒脱水后期,超氧化物歧化酶活性又出现升高趋势,这一现象在金丝李种子脱水耐性研究中也存在[4],具体原因有待进一步研究。
狭叶坡垒种子无休眠性状,初始含水率和萌发率较高。随种子含水率降低,种子相对电导率和丙二醛含量逐渐上升,细胞膜损伤导致种子发生劣变。脱水前期(0~4 天),种子通过提高过氧化氢酶活性维持细胞膜完整性,种子萌发率降幅较小。脱水4 ~ 10 天,细胞膜损伤加剧,种子萌发率快速下降,种子通过提高超氧化物歧化酶活性抵御毒害。脱水10 天后,毒害超出种子耐受范围,种子逐渐失活。狭叶坡垒种子对脱水高度敏感,属于高度顽拗性种子。了解顽拗性种子的脱水耐性生理和调控机制对其贮藏和保护有至关重要的作用。本研究虽然阐述了狭叶坡垒种子抗氧化系统与脱水耐性的关系,但对于种子脱水过程中水分和养分代谢、激素调控和调控候选基因和位点及其调控网络等并不清楚。后续需对狭叶坡垒种子脱水耐性生理和调控机制进行深入研究,为其种质资源保存和保护提供更多科学依据。

