养心定悸胶囊改善缺血再灌注损伤引起的心肌细胞凋亡和炎症反应
范鸿儒,王 栋,雷 杰,陈昌贵,李立为,贺立群
(武汉市第一医院,武汉市中西医结合医院心血管内科,武汉 430022;*通讯作者,E-mail:liqunhe0902@163.com)
急性心肌梗死具有较高的发病率和死亡率,预计到2030年将成为全球第二大死因[1]。目前主要采用经皮冠状动脉介入治疗或溶栓治疗进行心肌再灌注,以恢复缺血心肌血流,减少心肌损伤与梗死面积[2,3]。然而,心肌缺血再灌注(ischemia/reperfusion,I/R)会引起一系列继发性损伤,这是由于突然的血流回流激活了一系列复杂的细胞内反应,从而促进了心肌细胞的死亡[4]。研究表明,心肌细胞凋亡与炎症反应是心肌损伤的重要机制[5]。
炎症小体是一组胞质蛋白复合物,由含半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptor,NLR)组成,能够识别多种炎症的刺激以及一些重要促炎因子产生与释放,使组织细胞发生炎症反应[6,7]。有研究表明,Nod样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性小体在I/R损伤中起重要作用,抑制NLRP3可限制小鼠心肌I/R后的炎性损伤[8]。因此,NLRP3炎性体可能是预防心肌I/R损伤的重要靶标。养心定悸胶囊是临床常用的治疗气虚血少、心悸气短、心律不齐的中药制剂,已有研究表明,其能够有效改善心肌I/R损伤引起的心律失常[9],然而,关于养心定悸胶囊对心肌I/R损伤的具体作用机制尚不明确。本研究通过制备心肌I/R大鼠模型,观察养心定悸胶囊对I/R心肌损伤的作用机制,以期为后续I/R的治疗提供实验依据。
1 材料与方法
1.1 材料
清洁级雄性Wistar大鼠购自西安交通大学实验动物中心。养心定悸胶囊购自石药集团河北永丰药业有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、ASC、Caspase-1、NLRP3及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Santa Cruz公司;2,3,5-氯化三苯基四氮唑(2,3,5-trihenylterzolium chloride,TTC)染色液购自北京索莱宝生物公司;苏木素-伊红(hematoxylin-eosin,HE)染色试剂购于南京建成生物工程研究所;原位末端转移酶标记(TdT-mediated-dUTP nick end labeling,TUNEL)细胞检测试剂盒购自美国Roche公司;白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附剂测定(enzyme-linked immunosorbnent assay,ELISA)试剂盒与二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒购自上海碧云天公司;放射免疫沉淀测定(radio-immunoprecipitation assay,RIPA)裂解液与电化学发光(electrochemiluminescence,ECL)试剂液购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 模型制备及分组 所有大鼠(200~260 g)于无菌动物饲养箱内适应性饲养1周,温度为20~25 ℃,湿度为35%~40%,12 h/12 h昼夜交替,期间自由饮水和摄食,本研究获得武汉市第一医院医学伦理委员会审批(批号:2020016号)。将80只大鼠按随机数字表法分为5组:假手术(sham)组、心肌缺血/再灌注(I/R)组、低剂量养心定悸胶囊(50 mg/kg)组、中剂量养心定悸胶囊(100 mg/kg)组、高剂量养心定悸胶囊(150 mg/kg)组,每组16只。
模型制备过程:通过腹膜内注射戊巴比妥钠(40 mg/kg)麻醉大鼠,气管插管后,使用动物呼吸器进行机械通气,同时进行心电监护。将大鼠进行开胸剖腹手术,心脏完全暴露,通过用6-0丝线穿过左心耳下方约2 mm穿过进行缝合结扎,以阻塞左冠状动脉前降支,进行结扎30 min后,观察到结扎下方心肌逐渐变灰白,同时心电图出现S-T段抬高0.2 mm时释放结扎线,待心肌颜色逐渐恢复正常且心电图S-T段下降,心脏再灌注2 h以建立I/R大鼠模型,缝合腹部,置于笼中饲养。sham组大鼠除不进行结扎外,其余操作均相同。术后给予大鼠注射硫酸庆大霉素(1.5 ml/kg)2 d,以避免伤口感染。
1.2.2 给药处理 术后24 h,养心定悸胶囊低、中、高剂量组大鼠分别按体质量以50,100,150 mg/kg的养心定悸胶囊灌胃给药,每天1次,连续4周;sham组和I/R组大鼠同时给予等量生理盐水灌胃,每天1次,连续4周。
1.2.3 心脏功能的超声心动图评估 使用Vevo 770高分辨率超声成像系统评估大鼠心脏功能。麻醉大鼠后,进行超声心动图检查,通过识别心室频谱和左心室后壁获得图像,超声心动图系统自动检测心室的射血分数(ejection fraction,EF)和左心室短轴缩短率分数(fractional shortening,FS)。
1.2.4 TTC染色检测心肌梗死面积 采集大鼠主动脉血后,将大鼠解剖,取心脏组织在液氮中快速冷冻15 min。沿垂直心脏长轴方向至底横向切成大约1 mm厚的组织薄片,将组织样本夹在两个载玻片间,将其轻轻弄平以防止褶皱与收缩,在37 ℃恒温水浴中浸于1% TTC磷酸盐缓冲溶液(phosphate buffered saline,PBS)中放置30 min,然后在4%多聚甲醛溶液中固定24 h。通过Image J软件测量心肌梗死区域的大小及梗死组织面积比例(心肌梗死面积/心肌总面积),其中梗死组织为白色或浅色,存活组织为红色。
1.2.5 HE染色观察心肌组织病理学形态 将心肌组织固定在4%多聚甲醛缓冲液中,梯度酒精脱水,常规石蜡包埋,切成厚度约为5 μm的切片,二甲苯中常规脱蜡,梯度酒精水化。使用苏木素染色10 min,冲洗掉表面多余染液,1%酒精-盐酸分化数秒,再加入伊红染色液染色1 min,经梯度酒精脱水与二甲苯透明后,使用中性树胶封片,在光学显微镜下观察图像并拍照。
1.2.6 免疫组织化学染色检测心肌组织NLRP3表达 将心肌组织石蜡切片脱蜡水化后,加入柠檬酸溶液在高温下进行组织抗原修复。在3%H2O2中孵育10 min来阻断内源性过氧化物酶的活性。加入山羊血清在37 ℃下孵育1 h,滴加单克隆一抗NLRP3(1 ∶1 000)在4 ℃孵育过夜。次日,PBS洗涤后,滴加NLRP3生物素标记二抗在室温下孵育1 h,PBS洗涤,滴加DAB染色,使用苏木精复染,二甲苯透明,中性树胶封片。在光学显微镜下观察图像并拍照,通过Image J软件分析图像。
1.2.7 TUNEL染色检测心肌组织凋亡情况 将心肌组织石蜡切片在60 ℃烤片2 h脱蜡后,将切片与20 μg/ml蛋白酶K在室温下孵育15 min。PBS冲洗后,滴加50 μl TUNEL检测液于切片上,在37 ℃下孵育1 h,再加入过氧化物酶转化剂37 ℃孵育30 min,DAB显色,苏木素复染,经梯度酒精脱水、二甲苯透明后,中性树胶封片。于光学显微镜下观察计数TUNEL阳性细胞数,凋亡细胞的阳性细胞核呈棕褐色。
1.2.8 ELISA检测血清IL-1β、IL-6及TNF-α水平 将采集的大鼠血液在4 ℃下以4 000 r/min离心15 min,获取血清,将样品加入各反应孔,使用大鼠特异性ELISA试剂盒检测血清中IL-1β、IL-6、TNF-α的水平,操作步骤严格按试剂盒说明书进行,用酶标仪检测450 nm处吸光度值,计算各因子含量。
1.2.9 Western blot测定心肌组织IL-1β、ASC、Caspase-1及NLRP3蛋白表达 将心肌组织剪碎并用PBS清洗,加入RIPA裂解缓冲液进行裂解,4 ℃下以12 000 r/min离心20 min,取上清液,BCA法测定蛋白质含量。以30 μg蛋白的量加样并用10% SDS-PAGE凝胶分离蛋白质,转移至聚偏氟乙烯膜上。5%脱脂奶粉室温封闭2 h,TBST洗膜后,加入稀释后的抗IL-1β(1 ∶1 000)、ASC(1 ∶1 000)、Caspase-1(1 ∶2 000)、NLRP3(1 ∶1 000)为一抗,以GAPDH(1 ∶5 000)为内参,4 ℃下孵育过夜。次日,TBST洗膜,加入辣根过氧化物酶标记的二抗(1 ∶5 000),室温下孵育1 h,TBST洗膜后,滴加ECL化学发光液显色曝光,凝胶成像系统拍照,使用Image Pro-Plus分析系统对蛋白条带进行分析。
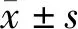
2 结果
2.1 养心定悸胶囊对I/R大鼠心功能的影响
与sham组比较,I/R组大鼠心功能下降,大鼠FS、EF值下降,差异有统计学意义(P<0.05);与I/R组比较,低剂量养心定悸胶囊组大鼠FS、EF值虽升高,但差异无统计学意义(P>0.05);中、高剂量养心定悸胶囊组大鼠FS、EF值均升高,差异均有统计学意义(P<0.05,见图1)。
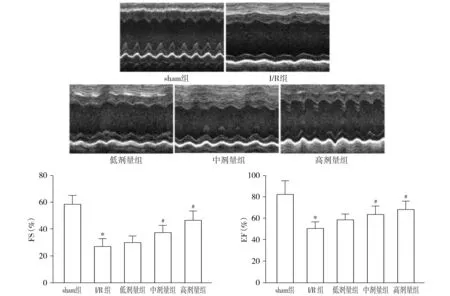
2.2 养心定悸胶囊对I/R大鼠心肌梗死面积的影响
sham组大鼠的心肌梗死面积为(0.65±0.05)%,I/R组大鼠的心肌梗死面积达到(31.08±3.02)%,I/R组较sham组明显增加(P<0.05);低剂量养心定悸胶囊组大鼠心肌组织的梗死面积为(28.64±2.55)%,较I/R组虽有所减少但差异无统计学意义(P>0.05);而中、高剂量养心定悸胶囊组大鼠心肌组织的梗死面积分别为(22.76±2.19)%和(14.88±1.39)%,均较I/R组明显减少(P<0.05,见图2)。
与sham组比较,*P<0.05;与I/R组比较,#P<0.05图1 各组大鼠超声心动图检测结果Figure 1 Echocardiographic results of rats in each group
梗死组织为白色或浅色,存活组织为红色;与sham组比较,*P<0.05;与I/R组比较,#P<0.05图2 各组大鼠心肌梗死面积比例Figure 2 Area percentage of myocardial infarction of rats in each group
2.3 养心定悸胶囊对I/R大鼠心肌组织病理学形态的影响
sham组大鼠心肌组织的心肌纤维排列规则、结构清晰,横纹清晰可见,细胞核结构清晰。与sham组比较,I/R组大鼠心肌纤维不规则,纤维断裂且结构模糊,心肌细胞结构较疏松,观察到明显的炎性细胞浸润。与I/R组比较,低、中、高剂量养心定悸胶囊组大鼠的心肌组织病理改变均有所减轻,其中,中、高剂量养心定悸胶囊组大鼠的纤维断裂减少,横纹可见,炎性细胞浸润减少,且高剂量养心定悸胶囊组大鼠的改善效果更为明显(见图3)。
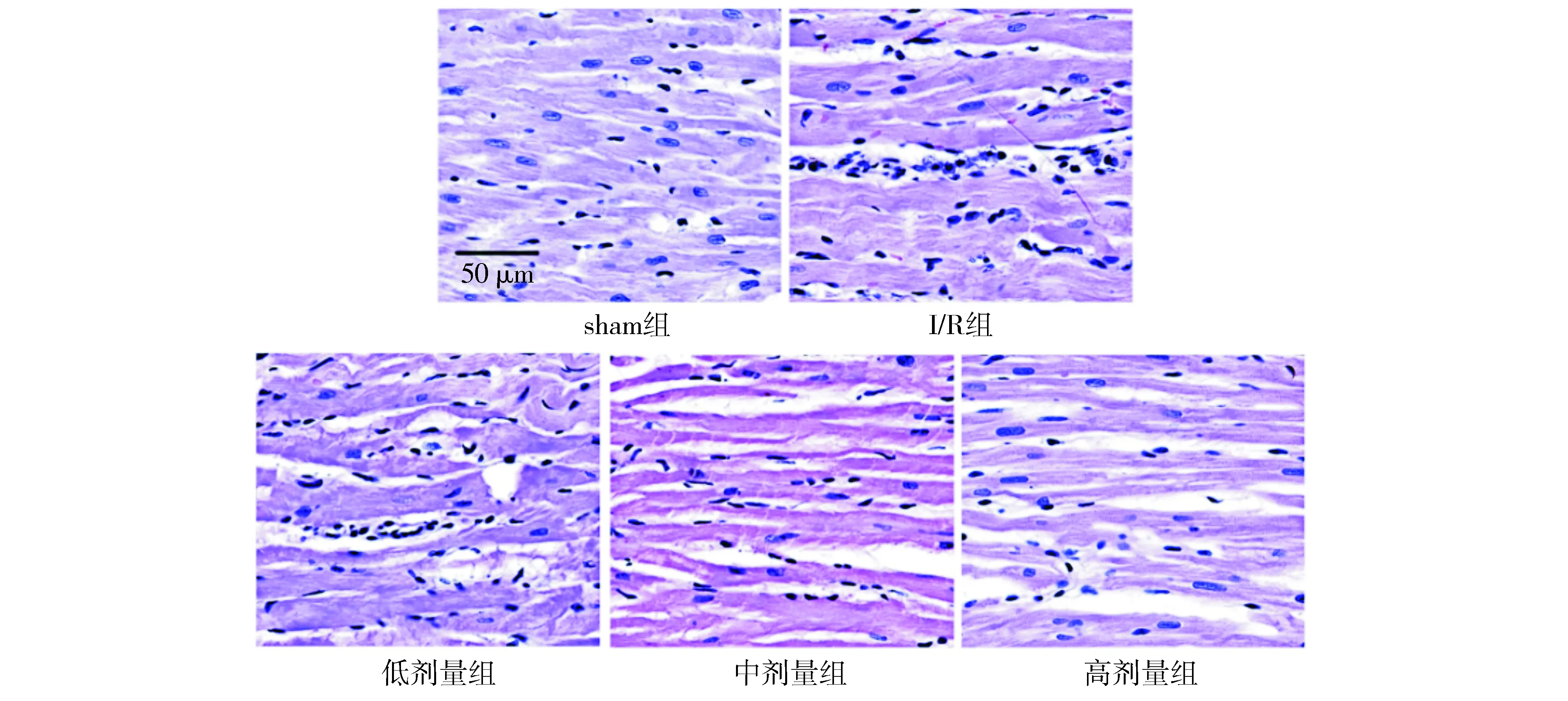
图3 HE染色检测各组大鼠心肌病理学形态Figure 3 Myocardial pathology of rats in each group by HE
2.4 养心定悸胶囊对I/R大鼠心肌细胞凋亡的影响
sham组和I/R组大鼠心肌组织中TUNEL阳性细胞率分别为(2.78±0.26)%和(47.48±4.50)%,I/R组较sham组明显增加(P<0.05);低剂量养心定悸胶囊组大鼠心肌组织中TUNEL阳性细胞率为(44.79±4.16)%,较I/R组有所减少,但差异无统计学意义(P>0.05);中、高剂量养心定悸胶囊组大鼠心肌组织中TUNEL阳性细胞率分别为(23.54±2.18)%和(20.59±1.96)%,均较I/R组明显减少(P<0.05,见图4)。

箭头所示为TUNEL阳性心肌细胞,即凋亡细胞;与sham组比较,*P<0.05;与I/R组比较,#P<0.05图4 TUNEL染色观察各组大鼠心肌细胞凋亡情况Figure 4 Myocardial apoptosis in each group by TUNEL
2.5 养心定悸胶囊对I/R大鼠血清炎症细胞因子水平的影响
与sham组比较,I/R组大鼠血清中炎症细胞因子IL-1β、IL-6和TNF-α的含量升高,差异有统计学意义(P<0.05);与I/R组比较,低剂量养心定悸胶囊组大鼠血清中IL-1β、IL-6和TNF-α的含量均有所减少,但差异无统计学意义(P>0.05);与I/R组比较,中、高剂量养心定悸胶囊组大鼠血清中IL-1β、IL-6和TNF-α的含量均明显降低(P<0.05,见图5)。
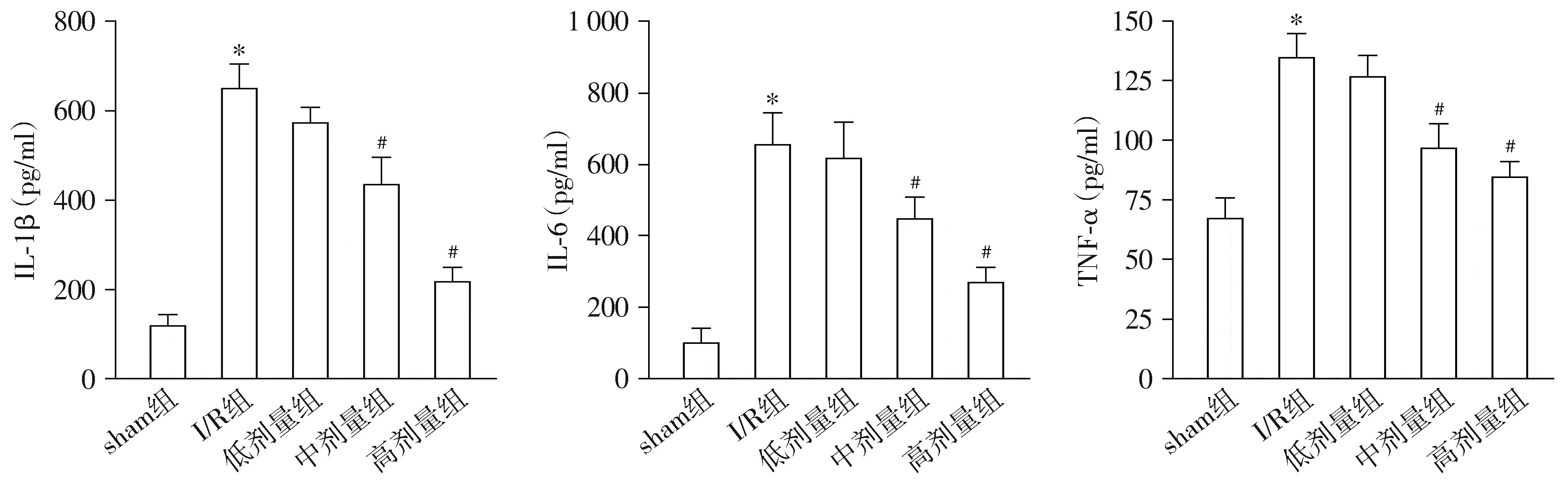
与sham组比较,*P<0.05;与I/R组比较,#P<0.05图5 各组大鼠血清中炎症细胞因子水平Figure 5 Levels of inflammatory cytokines in serum of rats in each group
2.6 养心定悸胶囊对I/R大鼠NLRP3活化的影响
免疫组织化学分析表明,I/R组和sham组大鼠心肌组织中NLRP3阳性表达达到(63.74±6.21)%和(6.80±0.63)%,I/R组较sham组明显增加(P<0.05);低剂量养心定悸胶囊治疗下大鼠心肌组织中NLRP3阳性表达为(60.08±5.96)%,较I/R组虽有所下降但差异无统计学意义(P>0.05);中、高养心定悸胶囊组大鼠心肌组织中NLRP3阳性表达分别为(35.17±3.22)%和(27.75±2.64)%,均较I/R组明显下降(P<0.05,见图6)。
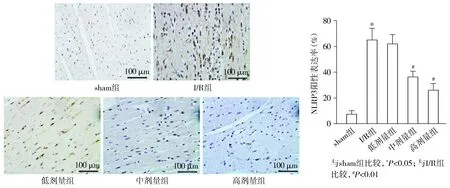
图6 免疫组织化学染色检测各组大鼠心肌组织NLRP3表达Figure 6 Expression of NLRP3 in myocardial tissue of rats in each group by IHC
Western blot结果显示,与sham组比较,I/R组大鼠心肌组织中IL-1β、ASC、Caspase-1和NLRP3蛋白表达增加,差异有统计学意义(P<0.05);与I/R组比较,低剂量养心定悸胶囊组大鼠心肌组织中IL-1β、ASC、Caspase-1和NLRP3蛋白表达虽有所下降,但差异无统计学意义(P>0.05);与I/R组比较,中、高养心定悸胶囊组大鼠心肌组织中IL-1β、ASC、Caspase-1和NLRP3蛋白表达下降,且差异有统计学意义(P<0.05,见图7)。
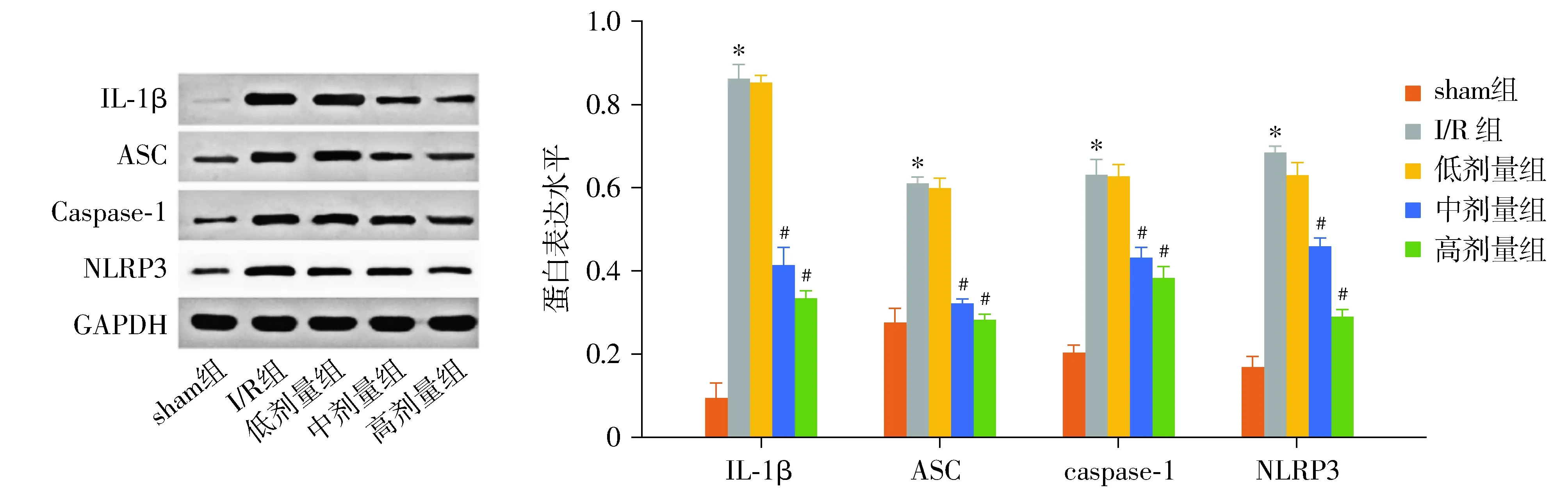
与sham组比较,*P<0.05;与I/R组比较,#P<0.01图7 各组大鼠心肌组织中IL-1β、ASC、Caspase-1和NLRP3蛋白表达Figure 7 Expression of IL-1β, ASC, Caspase-1 and NLRP3 proteins in myocardial tissue of rats in each group
3 讨论
随着我国社会经济的发展,由冠状动脉疾病引起的急性心肌梗死,为患者和社会带来了沉重负担[10]。心肌缺血再灌注在治疗急性心脏病的同时,会出现一些严重并发症发生的风险,如加重心肌损伤、心源性猝死等[11]。因此,I/R的治疗是一个急需解决的问题。为了阐明潜在机制并探索治疗心肌I/R损伤的治疗策略,研究者们已经做出了巨大的努力。越来越多的研究表明,心肌I/R损伤涉及多种生物学过程和信号传导途径,例如细胞内钙超载、线粒体通透性过渡孔的开放、活性氧的积累、心肌细胞凋亡以及炎症反应[12-14]。本实验证明了中高剂量的养心定悸胶囊可以改善心肌I/R损伤后大鼠心功能,减轻心肌细胞的凋亡并抑制炎症反应。
本研究结果显示,I/R大鼠的心肌收缩功能下降,100,150 mg/kg的养心定悸胶囊以剂量依赖性方式显著改善大鼠的心肌功能,减少了I/R大鼠的心肌梗死面积并改善了心肌组织的病理损伤。养心定悸胶囊源自《伤寒论》经典名方炙甘草汤,具有抗血栓、抗炎和抗心律失常等心脏保护作用。此外,近期研究表明,其还可以提高睡眠质量,改善焦虑、抑郁情绪及相关神经递质水平[15],由此可见,养心定悸胶囊在多种临床疾病治疗中发挥积极作用。凋亡被认为是再灌注缺血性心肌中大量细胞死亡的一种机制,了解心肌I/R中可能的分子途径以增强对细胞死亡与凋亡的抵抗力[16]。冠状动脉闭塞后,血流减少会产生有害的细胞过程,并通过激活来自线粒体通透性过渡孔或线粒体外膜通透性的凋亡来导致心肌细胞最终死亡[17]。因此,预防再灌注过程中心肌细胞凋亡可以增加缺血组织的修复能力,从而保护心脏免受I/R损伤。本研究中,100,150 mg/kg的养心定悸胶囊治疗显著抑制了大鼠心肌组织中细胞凋亡。
炎症反应是机体针对有害刺激的关键生理反应,在免疫反应中起着不可或缺的作用[10]。先前有研究证明心肌炎症反应是引起心肌I/R损伤的原因之一,心肌I/R损伤的过程伴随着炎性细胞因子的释放[18]。IL-1β是IL-1家族的成员,可诱导其他细胞因子如IL-6和TNF-α产生,进一步加剧炎症,在心肌I/R的炎症损伤中起关键作用。Caspase-1通过裂解无活性的IL-1β前体来激活IL-1β。NLRP3炎性小体由NLRP3、ASC和Caspase-1蛋白组成,并根据病原体相关的分子模式进行组装,当NLRP3确定为应力因素时,随后诱导ASC寡聚为大型复合物ASC斑点,与Caspase-1结合后,该蛋白酶通过自身催化过程被激活,继而裂解并激活促炎细胞因子pro-IL-1β和pro-IL-18炎症小体[6,19]。已有研究表明,NLRP3炎性小体可加重心肌细胞的损伤,而炎性损伤可通过抑制心肌I/R中的NLRP3活化来减轻[8]。本研究结果显示,养心定悸胶囊减少了I/R大鼠心肌血清中IL-1β、IL-6和TNF-α的释放,抑制了NLRP3炎症小体活化,并减少其下游效应分子IL-1β、Caspase-1蛋白以及ASC蛋白表达水平,从而表明NLRP3炎性小体可能参与了养心定悸胶囊的心脏保护作用。
综上所述,养心定悸胶囊在适当的剂量范围内能抑制NLRP3炎症小体活化、减缓炎症反应、抑制细胞凋亡等途径来改善I/R对大鼠心肌组织的损伤,这将为后续心肌I/R的治疗奠定新的理论和实践依据。
致谢:感谢西安交通大学基础医学院段红霞老师在动物实验上给予的帮助和支持。

