Rab6A通过调控AKT/p38信号通路影响胃癌细胞增殖和凋亡
马小平,蔡 爽,贾浴侦,邓朝伟,赵凌宇
(西安交通大学医学部基础医学院细胞生物学与遗传学系,西安 710061;*通讯作者,E-mail:zhaolingyu@xjtu.edu.cn)
胃癌(gastric cancer,GC)是全球常见的恶性肿瘤之一,其总体癌症发生率和癌症相关死亡率分别为第5位和第4位[1,2]。晚期胃癌根治性切除术后的复发率高达39%~60.8%[3,4],辅助化疗可作为晚期胃癌的可选手段,使5年生存率从35%提高到40%[5]。尽管一系列靶向药物已用于GC的治疗,但单靶向药物的治疗效果非常有限而且很容易产生耐药性[6-8]。胃癌发生是一个多步骤的过程,涉及众多的遗传和环境因素[9,10]。因此,进一步阐明胃癌发生的分子机制,已成为胃癌研究的关键。Rab蛋白(Rabs)属于小G蛋白的“Ras超家族”,它们在囊泡运输的调控中发挥着不可或缺的作用,包括囊泡形成、转运以及转运囊泡的对接和融合[11-13]。Rab蛋白已被证实在各种恶性肿瘤中异常表达,并与发病机制相关[14-18]。Rab6A是Rab6的4种亚型之一,Rab6A′和Rab6A的差异仅为3个氨基酸,Rab6B氨基酸序列与Rab6A′和Rab6A有91%的相似,只在C端存在差异;Rab6C由RAB6A′ mRNA反转录而来[19]。目前还没有Rab6A在胃癌的功能的研究报道,因此非常有必要探究Rab6A在胃癌中的作用及相关分子机制。本研究通过检测53例胃癌患者的胃癌组织和癌旁组织样本中Rab6A的表达水平和细胞学实验探究Rab6A对胃癌的细胞增殖、细胞周期和细胞凋亡以及AKT/p38信号通路相关分子的影响,为阐明Rab6A影响胃癌细胞增殖、凋亡的分子机制提供理论依据。
1 材料与方法
1.1 组织来源
本研究自2014年5月至2015年6月在西安交通大学第一附属医院肿瘤外科收集胃癌患者的术后胃癌组织和癌旁正常胃组织样本各53例,提取所有组织样本总RNA,采用实时定量PCR检测Rab6A在胃癌和癌旁组织中的mRNA表达变化,提取12对胃癌组织及癌旁组织蛋白,采用Western blot分析Rab6A在这两种不同组织中的蛋白表达变化。
1.2 主要试剂与仪器
RPMI-1640培养基、ECL化学增光剂、血清购于美国Thermo fisher公司;MTT、RnaseA、RIPA裂解缓冲液、碘化丙啶(PI)、青链霉素购于美国Sigma公司;Annexin Ⅴ-FITC凋亡试剂盒购于美国BD Bioscience公司;所有一抗和二抗均购于中国武汉三鹰生物技术有限公司;Lipofectamine2000和TRIzol Reagent购自于美国Invitrogen公司;逆转录试剂盒TaKaRa Ex Taq HS和SYBRR Premix Ex TaqTM kit购于中国TaKaRa公司。iQ5 Multicolor Real-Time PCR仪、垂直电泳仪、湿转系统、二氧化碳培养箱购于美国Bio-Rad公司;全自动酶标仪购于美国Bio-Tek公司;FASCalibar流式细胞仪购于美国FALS CALIBAR BD公司;GBOX-HR全自动凝胶成像分析系统购于英国Syngene公司。
1.3 细胞培养及实验分组
胃癌细胞BGC-823和SGC-7901由西安交通大学医学部教育部环境与基因相关疾病重点实验室提供。细胞培养于含10%胎牛血清,1%青霉素/链霉素的RPMI-1640培养基中,在37 ℃、5% CO2培养箱中培养。BGC-823细胞和SGC-7901细胞分别分为3组:阴性对照组、siRNA-1组和siRNA-2组,分别转染NC-siRNA(60 nmol/L)、Rab6A siRNA-1(60 nmol/L)和Rab6A siRNA-2(60 nmol/L),用于后续的细胞行为学实验。
1.4 TCGA数据分析Rab6A在胃癌中表达
通过癌症基因组图谱(the cancer genome altas, TCGA)与基因型-组织表达工程(the genotype-tissue expression project,GTEX)数据(https://xena.ucsc.edu)分析Rab6A在胃癌组织中的表达,R software(4.1.1)用于数据的可视化。
1.5 siRNA合成与转染
采用小干扰RNA(siRNAs)沉默人Rab6A基因用以探究其细胞学功能及可能的分子机制。具体序列如下:Rab6A siRNA-1 sense:5′-GAGCGGUUCAGGAGCUUGATT-3′,antisense:5′-UCAAGCUCCUGAACCGCUCTT-3′;Rab6A siRNA-2 sense:5′-CAGCUGUAGUAGUUUACGATT-3′,antisense:5′-UCGUAAACUACUACAGCUGTT-3′;NC-siRNA sense:5′-UUCUCCGAACGUGUCACGUTT-3′,antisense:5′-ACGUGACACGUUCGGAGAATT-3′;均由中国上海吉玛制药技术有限公司合成。依照LipofectamineTM2000转染试剂说明书,将胃癌细胞系BGC-823和SGC-7901用RPMI-1640培养基重悬,调整适宜细胞浓度接种于96或6孔板中,置37 ℃孵箱中培养过夜,siRNA稀释到60 nmol/L进行转染,并且该浓度用于后续探究Rab6A的细胞功能和分子机制的实验中。
1.6 实时定量PCR检测胃癌组织和细胞中Rab6A的表达变化
采用实时定量PCR分别检测53对胃癌组织和癌旁正常组织和转染Rab6A siRNAs的胃癌细胞BGC-823和SGC-7901细胞中Rab6A mRNA水平表达变化。胃癌组织取样于2 ml EP管中,加入TRIzol试剂1 ml,用匀浆机震荡破碎。接着根据生产制造商说明,提取已破碎的人胃癌组织和癌旁正常组织和转染Rab6A siRNAs的胃癌细胞BGC-823和SGC-7901的总RNA。使用SYBR Green PCR Master Mix和cDNA逆转录试剂检测Rab6A mRNA的表达水平。采用iCycler iQ多色qRT-PCR系统进行实时定量PCR。以GAPDH为内参对照,采用2-ΔΔCt方法来分析Rab6A mRNA的相对表达量。引物序列包括Rab6A上游引物:5′-CTTGGAGGATCGAACAGTAC-3′,下游引物:5′-GATATCATAAACAACAACTGCCA-3′;GAPDH上游引物:5′-GCCACATTACTCAGACAC-3′,下游引物:5′-GCCCA ATACGGTCAAATCC-3′。
1.7 MTT法检测胃癌细胞增殖
以1.3实验分组进行细胞培养,BGC-823细胞和SGC-7901细胞以3 000个细胞/孔分别接种于96孔板,每组5个复孔,每孔100 μl培养基,孵育24 h。转染后再分别培养24,48,72 h,每孔加10 μl 5 mg/ml MTT溶液,继续培养4 h,弃上清并加入150 μl DMSO,利用酶标仪在492 nm波长下检测吸光度。
1.8 流式细胞仪检测胃癌细胞周期
为了阐明Rab6A siRNAs抑制BGC-823和SGC-7901细胞增殖是否是细胞周期检查点阻滞所致,进行细胞周期实验。以1.3分组进行细胞培养及转染,BGC-823和SGC-7901细胞以2×105个细胞/孔分别接种于6孔板,每孔2 ml培养基。过夜后换无血清培养基培养24 h,再换完全培养基,转染。再培养24 h,然后收集各组细胞,用预冷PBS洗涤细胞2次。然后用1 ml 70.0%冰冷乙醇4 ℃过夜固定。PBS洗涤2次,加入50 μl浓度为100 μg/ml的无DNase的RNaseA,重悬细胞;再加入50 μl浓度为100 μg/ml PI染液,混合均匀,室温下避光孵育15 min。最后,通过流式细胞仪(FACS)检测细胞内PI含量,并用ModFit软件(Bio-Rad Laboratories,Hercules,CA,USA)分析细胞周期不同时相细胞比例。
1.9 流式细胞仪检测胃癌细胞凋亡
以1.3分组进行细胞培养及转染,再培养48 h,然后收集包括上清在内的各组细胞,然后用PBS清洗2次。用300 μl结合缓冲液重悬细胞,使其浓度为1×105/ml。取100 μl细胞悬液加入到5 ml流式管中,再加入5 μl 10 μg/ml Annexin Ⅴ/FITC和5 μl 20 μg/ml碘化丙啶,避光混匀,孵育15 min。在流式管中加入400 μl PBS。用流式细胞仪检测染色细胞,采用ModFit软件分析细胞凋亡。
1.10 Western blot检测胃癌组织和胃癌细胞中相关蛋白的表达变化
为了研究Rab6A在胃癌组织中的表达和Rab6A siRNAs对BGC-823和SGC-7901细胞中AKT/p38信号通路的影响,采用Western blot检测相关蛋白表达。使用RIPA裂解缓冲液裂解12对胃癌组织及其癌旁组织和以1.3分组培养及转染的细胞样本。用10% SDS聚丙烯酰胺凝胶分离总蛋白,并转印到PVDF膜上。将膜与包括Rab6A兔多克隆抗体(1 ∶1 000)、p-AKT兔单克隆抗体(1 ∶2 000)、AKT鼠单克隆抗体(1 ∶5 000)、p38兔单克隆抗体(1 ∶500)、p-p38兔单克隆抗体(1 ∶1 000)、CDK4兔单克隆抗体(1 ∶2 500)、细胞周期蛋白D1鼠单克隆抗体(1 ∶1 000)和GAPDH鼠单克隆抗(1 ∶4 000)孵育。随后用ECL试剂处理膜进行化学发光检测。通过CCD相机检测发光信号,并用Syngene GBox记录并定量。
1.11 统计学分析
应用SPSS26.0统计软件对实验结果进行t检验,各组实验数据均以平均数±标准误表示,应用GraphPad Prism 5软件绘图。以P<0.01表示差异有统计学意义。每组实验均重复3次以上。
2 结果
2.1 Rab6A在胃癌组织中表达上调
qRT-PCR结果显示:与癌旁组织相比,88.68%(47/53)的胃癌组织样本中Rab6A mRNA表达显著上调(P<0.01,见图1A)。Western blot分析显示,与癌旁组织相比,Rab6A在胃癌组织的蛋白水平显著高表达(P<0.01,见图1B)。TCGA联合GTEX数据库分析表明,与胃组织相比,Rab6A在胃癌组织高表达(P<0.01,见图1C),与实验结果一致。
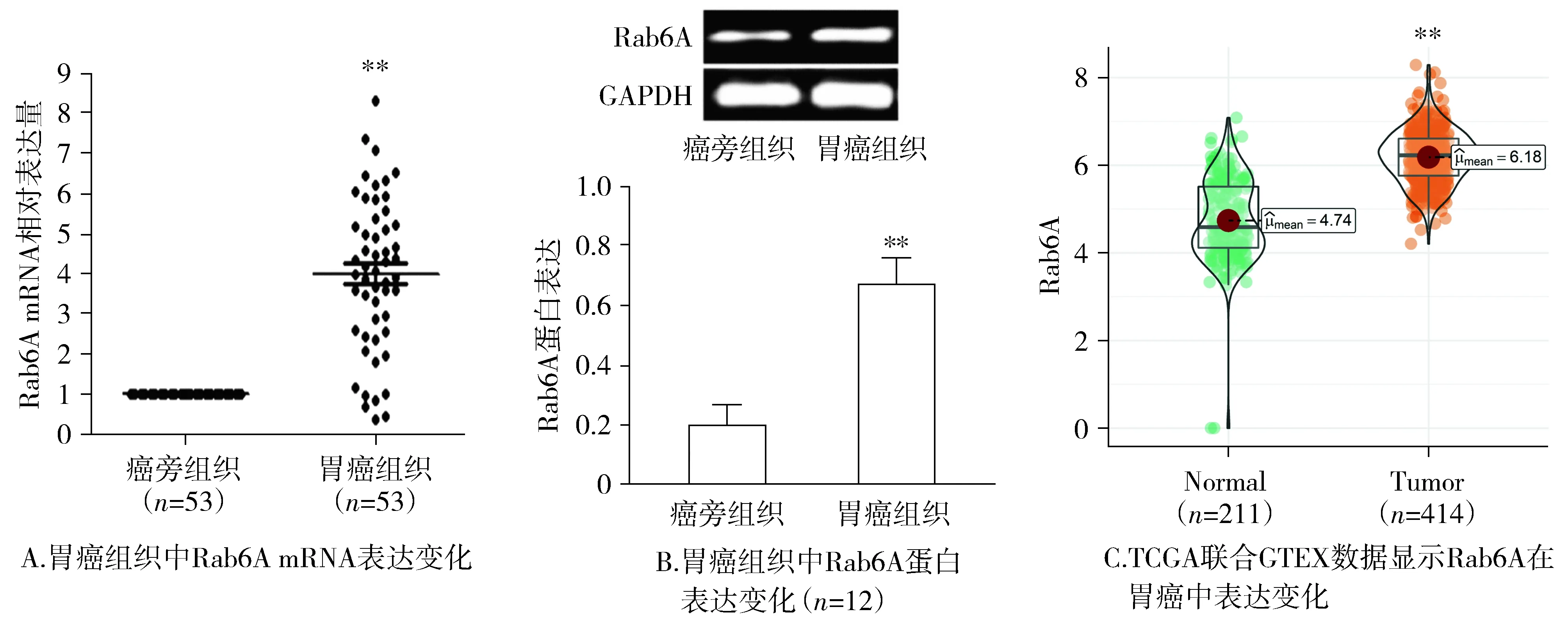
与癌旁组织比较,**P<0.01图1 Rab6A在胃癌组织中的表达Figure 1 Expression of Rab6A in gastric cancer tissues
2.2 转染siRNAs可以沉默胃癌细胞中Rab6A的表达
与阴性对照相比,在BGC-823和SGC-7901细胞中siRNA-1组和siRNA-2组Rab6A mRNA表达显著降低(P<0.01,见图2)。与阴性对照组相比,BGC-823和SGC-7901细胞中siRNAs组Rab6A蛋白表达也均明显下调(P<0.01,见图2)。
2.3 转染Rab6A siRNAs抑制胃癌细胞增殖
与阴性对照组相比,BGC-823和SGC-7901中沉默Rab6A 24 h时吸光度无显著差异;48 h和72 h时OD492 nm值均显著降低(P<0.01,见图3)。表明沉默Rab6A表达可抑制BGC-823和SGC-7901细胞增殖。
2.4 转染Rab6A siRNAs对胃癌细胞周期的影响
在BGC-823和SGC-7901细胞中,与阴性对照组相比,Rab6A siRNA-1组和siRNA-2组G0/G1期细胞比例显著增加(P<0.01),S期和G2/M期细胞比例显著减少(P<0.01,见图4)。表明沉默Rab6A可抑制BGC-823和SGC-7901细胞从G1期进入S期。
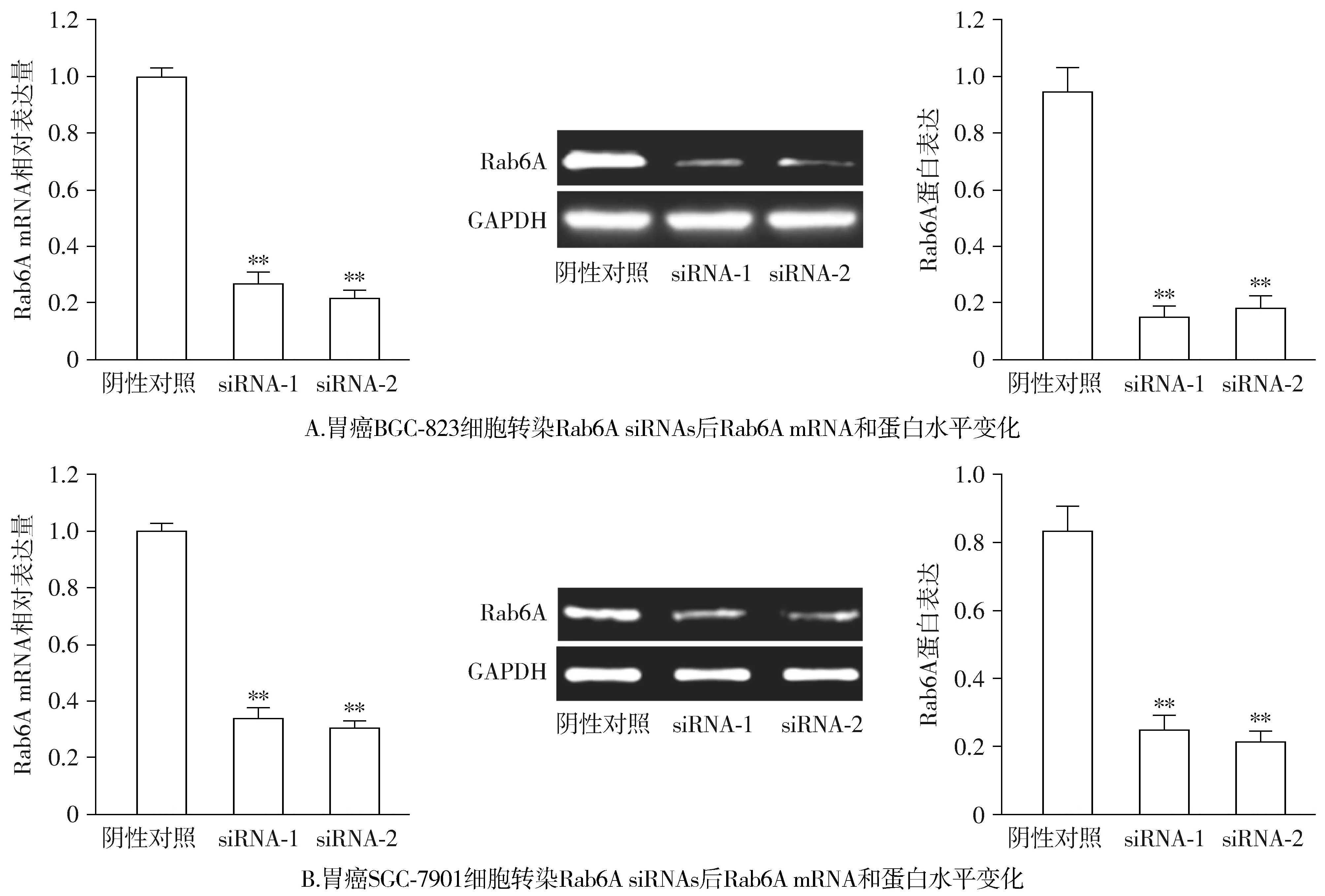
与阴性对照组比较,**P<0.01图2 在胃癌细胞中转染Rab6A siRNAs后Rab6A表达变化Figure 2 Changes of Rab6A expression after transfection with Rab6A siRNAs in gastric cancer cells
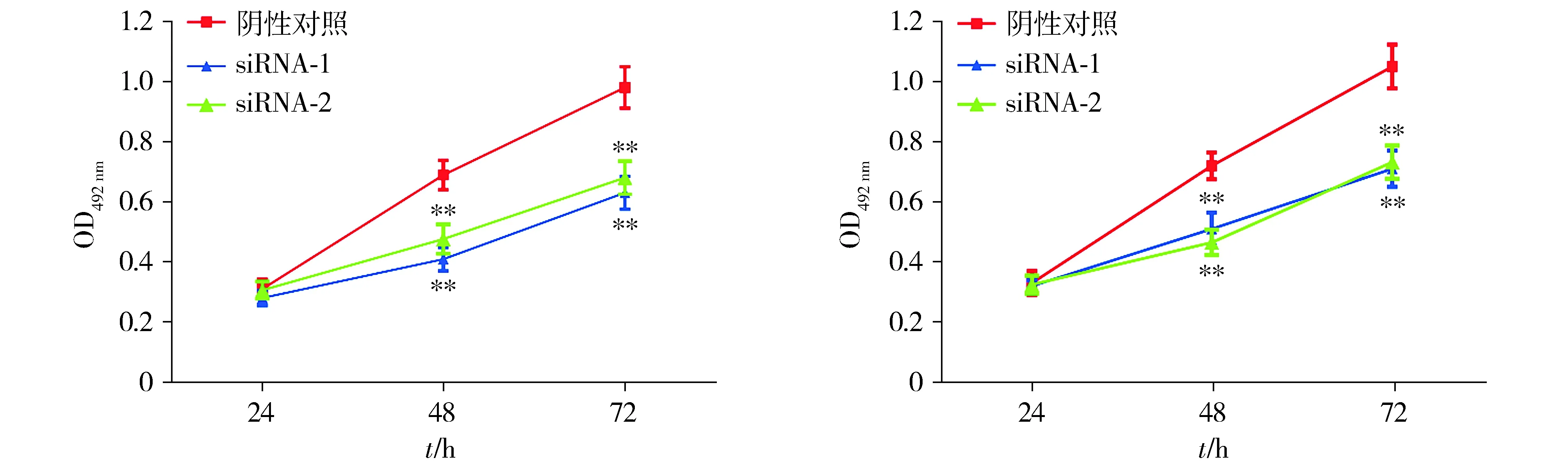
A.转染Rab6A siRNAs对BGC-823细胞增殖的影响B.转染Rab6A siRNAs对SGC-7901细胞增殖的影响与阴性对照组比较,**P<0.01图3 Rab6A siRNAs对胃癌细胞增殖的影响Figure 3 Effects of Rab6A siRNAs on the proliferation of gastric cancer cells
2.5 转染Rab6A siRNAs促进胃癌细胞凋亡
在BGC-823和SGC-7901细胞中,与阴性对照组相比,siRNA-1组和siRNA-2组早期和晚期凋亡细胞比例显著增加(P<0.01,见图5)。表明沉默Rab6A显著促进BGC-823和SGC-7901细胞凋亡。
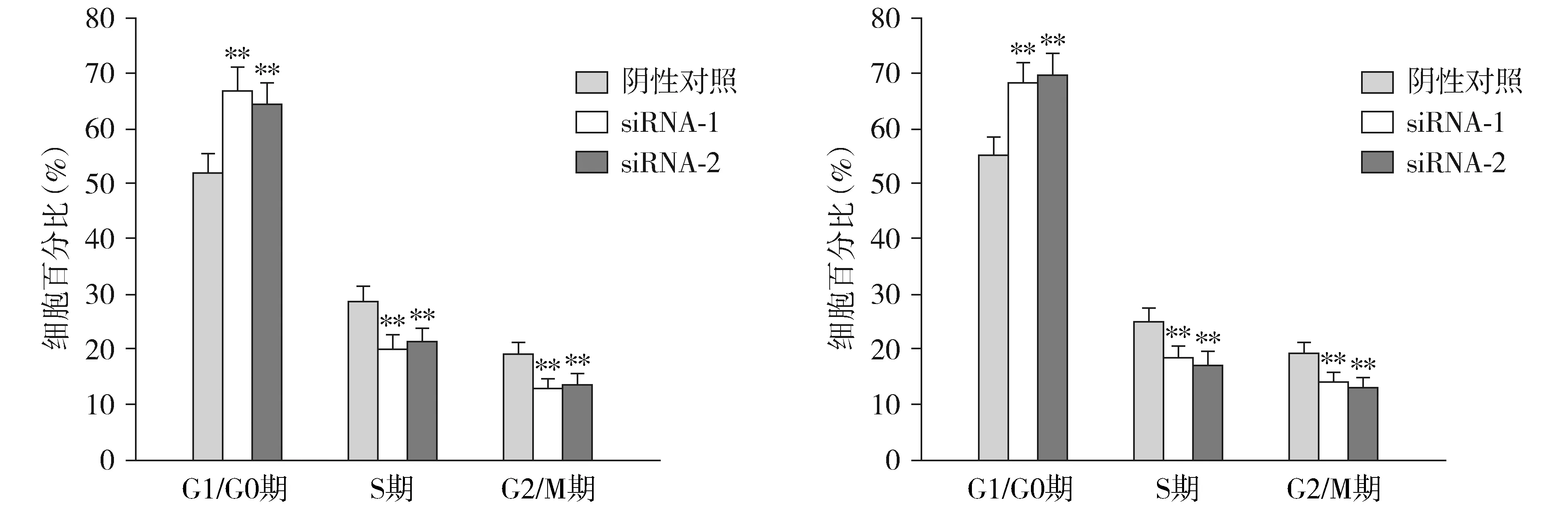
A.转染Rab6A siRNAs对BGC-823细胞周期影响B.转染Rab6A siRNAs对SGC-7901细胞周期影响与阴性对照组比较,**P<0.01图4 Rab6A siRNAs对胃癌细胞周期的影响Figure 4 Effects of Rab6A siRNAs on cell cycle of gastric cancer cells

A.转染Rab6A siRNAs对BGC-823细胞凋亡影响B.转染Rab6A siRNAs对SGC-7901细胞凋亡影响与阴性对照组比较,**P<0.01图5 Rab6A siRNAs对胃癌细胞凋亡的影响Figure 5 Effects of Rab6A siRNAs on apoptosis of gastric cancer cells
2.6 在胃癌细胞中转染Rab6AsiRNAs调控AKT/p38信号通路
为了进一步研究Rab6A诱导BGC-823和SGC-7901细胞增殖和凋亡的分子机制,沉默Rab6A后,采用Western blot检测AKT/p38信号通路相关蛋白表达。结果表明,与阴性对照相比,Rab6A siRNA-1组和Rab6A siRNA-2组BGC-823和SGC-7901细胞中p-AKT、CDK4和Cyclin D1表达显著下降,p-p38表达显著上升(P<0.01,见图6)。
3 讨论
Rab蛋白是膜转运系统中不可缺少的组分,可调控许多肿瘤相关蛋白的分泌、转运、再循环和降解,如β-整合素、表皮生长因子受体和基质金属蛋白酶等[20-22]。Rabs在癌症中作为肿瘤促进因子或抑制因子发挥作用[18,23,24]。Rabs的失调导致囊泡运输调控网络的破坏,从而影响细胞生长和行为,促进癌细胞的恶性进展[14]。Rab6参与高尔基体和细胞质囊泡的组成,调节高尔基体、内质网和核仁之间的蛋白质转运[25,26]。同时,Rab6介导的蛋白分泌参与细胞骨架的组织和mRNA[27,28]的转运。Rab6蛋白广泛参与细胞黏附、迁移等多种生理活动[29-32],其在肺癌组织中表达下调,其过表达可以抑制非小细胞肺癌的细胞增殖和克隆形成[33]。而Rab6A作为Rab6家族的主要成员之一,其在胃癌中的功能及作用机制还尚未见报道。
本研究中Rab6A在胃癌组织中表达显著上调,提示Rab6A在胃癌中可能作为癌基因而发挥作用。进一步研究发现沉默Rab6A的表达后,胃癌细胞增殖活力降低,细胞主要阻滞到G1期,细胞凋亡明显增加。这与RAS癌基因家族的Rab11A在食管癌[34]中的作用、Rab1A在胶质瘤[35]和结肠癌[36]中的作用一致,均发挥着癌基因的作用。接着探究了沉默Rab6A影响胃癌细胞增殖的分子机制。AKT信号通路是癌症中细胞增殖信号通路之一,经常被激活,从而调节许多下游蛋白质的功能,这些蛋白质参与癌症细胞存活、增殖、迁移等[37]。CDK4和细胞周期蛋白D1就是这些蛋白中的代表,这二者是G0/G1期的关键调控因子,其形成的复合物可调节G1/G0期至S期的进程[38,39]。在本研究中沉默Rab6A后p-AKT、CDK4和Cyclin D1表达显著下降。这暗示沉默Rab6A通过影响AKT信号通路进而抑制胃癌细胞的增殖。p38 MAP激酶是MAPKs家族的重要成员。p38 MAP激酶的磷酸化可诱导细胞凋亡,抑制其磷酸化可减少细胞死亡[40]。本研究中沉默Rab6A后p-p38表达显著上调,细胞凋亡增加,这说明沉默Rab6A通过影响MAPK p38信号通路来促进胃癌细胞的凋亡。
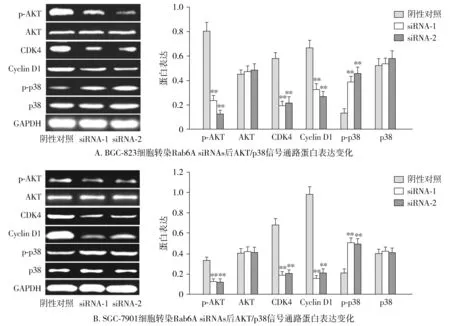
与阴性对照组比较,**P<0.01图6 Rab6A siRNAs对AKT/p38信号通路的影响Figure 6 Effects of Rab6A siRNAs on AKT/p38 signaling pathways
总而言之,沉默Rab6A可通过影响AKT/p38信号通路相关的蛋白表达,进而抑制胃癌细胞增殖,促进细胞凋亡。本次研究首次证明Rab6A在胃癌的表达及功能,为进一步探究Rab6A在胃癌中的作用网络打下了基础,也为胃癌进一步研究和治疗提供新思路。

