唐菖蒲伯克霍尔德菌椰毒致病变种污染调查及其生长与产毒特性分析
李兵,叶青华,赵美平,陈维,黄乙卿,吴清平,张菊梅
(1.华南农业大学食品学院,广东广州 510642)(2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,农业农村部农业微生物组学与精准应用重点实验室,广东广州 510070)(3.广东省微生物分析检测中心,广东广州 510070)
唐菖蒲伯克霍尔德菌椰毒致病变种(Burkholderia gladiolipathovarcocovenenans,BGC),国内又称为椰毒假单胞菌酵米面亚种、椰酵假单胞菌[1,2],是唐菖蒲伯克霍尔德菌(Burkholderia gladioli)中能引起严重食物中毒的致病型,也是迄今我国发现的发病率和死亡率最高的食源性致病菌[2,3]。该菌产生一种高度不饱和的三羧酸脂肪酸即米酵菌酸(Bongkrekic Acid)是引起食物中毒和死亡的主要毒性代谢物[4,5]。
米酵菌酸是一种无臭、无味、热稳定的物质[6],受污染的食物具有正常的外观、气味和风味,因此,米酵菌酸在食品制备和消费过程中很难被察觉到。由唐菖蒲伯克霍尔德菌椰毒致病变种引起的食物中毒在我国东北地区、广西、云南、甘肃、贵州、四川、山东[3]、浙江[7]、及广东等地皆有发生,中毒食物有发酵变质的米面制品、变质银耳和长时间泡发的木耳等。以往由该菌引起的食物中毒多发生在老少边穷地区,近年来由BGC 引发的食物中毒事件多次出现在经济发达地区,导致人们对它的关注度持续上升。其中,广东省在2018[8]、2019[9]和2020[10]年连续三年发生了因食用被污染变质的湿米粉和长时间泡发的木耳而引起米酵菌酸中毒事件。因此,唐菖蒲伯克霍尔德菌椰毒致病变种及其产生的米酵菌酸已经对我国公民健康和食品安全造成严重威胁。而目前对于该菌的研究报道,仍多限于疾病暴发与米酵菌酸的生物合成[11,12]及其毒理[13,14],对其在食品中的污染状况、存活与产毒特性及机制鲜有报道。
本研究调查了2020 年广州市市售米面、淀粉制品和木耳、银耳中唐菖蒲伯克霍尔德菌椰毒致病变种的污染情况,分析了在不同培养基、培养温度、培养时间、pH 和NaCl 浓度下该菌的生长和产毒情况,旨在掌握BGC 在食品中的分布规律与生长及产毒特性,对预防和控制食品中唐菖蒲伯克霍尔德菌椰毒致病变种的污染提供借鉴和参考。
1 材料与方法
1.1 材料
1.1.1 样品
根据GB 4789.1-2016[15]中样品的采集规则进行采样。于2020 年8~9 月,从广州市越秀区、荔湾区、增城区、从化区,采集四大类食品样品共100 份,其中淀粉类73 份,面粉类12 份,湿木耳9 份,湿银耳6 份。样品均采自当地超市或市场,同一地点同类样品只采集一份。采样时为避免二次污染,对于小包装规格的产品整包购买,大包装、散装规格的产品则从最新开封的产品中取适量样品后装入无菌均质袋并密闭包装,每份样品至少500 g。
1.1.2 仪器和试剂
Synergy HTX 多功能微孔板检测仪,美国伯腾仪器有限公司;MALDI-TOF MS AutoflexSpeed 基质辅助激光解吸电离飞行时间质谱微生物鉴定仪,德国布鲁克公司;生物安全柜,Thermo scientific;ACQUITYTM 超高效液相色谱仪和Waters XevoTM TQ MS 三重四极杆串联质谱仪,Waters 公司。
GVC 增菌液、马铃薯葡萄糖琼脂(PDA)培养基、改良马铃薯葡萄糖琼脂(mPDA)、PCFA 培养基、马铃薯葡萄糖半固体琼脂培养基、BHI、PD、LB 肉汤、玻璃纸,广东环凯微生物科技有限公司;米酵菌酸标准品(1 mg/mL),Sigma Aldrich;甲醇和乙腈(HPLC级),德国Merck 公司;甲酸(HPLC 级),德国CNW公司;氨水(分析纯),广州化学试剂厂;MAX 固相萃取小柱(2 mg/mL),Waters 公司;超纯水(18.2 MΩ·cm),实验室Milli-Q 自制。
1.1.3 标准菌株
唐菖蒲伯克霍尔德氏菌(CICC 10574)、唐菖蒲伯克霍尔德氏菌(ATCC 33664)由广东省科学院微生物研究所菌种保藏中心提供。
1.2 实验方法
1.2.1 唐菖蒲伯克霍尔德菌的分离和鉴定
参照GB 4789.29-2020 的方法稍许修改[16],取25 g 米面、淀粉制品样品或1 g 湿木耳、银耳加入到225 mL 或20 mL GVC 增菌液中,37 ℃增菌培养24~48 h 后,分别划线接种于mPDA 平板、PCFA 平板,再分别挑取5个以上典型或可疑菌落(低于5个全选),接种于PDA 平板,从纯培养的PDA 平板上挑取菌落用MALDI-TOF MS 进行菌种鉴定。
1.2.2 产毒培养和米酵菌酸的测定
产毒培养参照GB 4789.29-2020 的方法[16]:将鉴定为唐菖蒲伯克霍尔德菌的菌株接种于PDA 平板,37 ℃培养24 h 后,挑取适量菌苔于3 mL 无菌生理盐水中,充分涡旋,配成1 麦氏浓度的菌悬液(约为108CFU/mL),吸取0.5 mL 滴在铺好无菌玻璃纸的直径150 mm 的马铃薯葡萄糖半固体平板上,涂布均匀,26 ℃培养5 d。培养结束后,取下带菌的玻璃纸,将半固体平板置于100 ℃流动蒸汽中灭菌30 min,待室温冷却后,置于-20 ℃冰箱过夜。过夜后将冰冻好的半固体平板于室温融化,吸出冻融液过滤至无菌试管中(此为毒素粗提液),4 ℃下避光保存。
取粗提的毒素上清液50 μL,使用超高效液相色谱-质谱/质谱法进行米酵菌酸测定[12-17]。先将20 μL 米酵菌酸标准系列工作液注入液相色谱仪中,测定相应的峰面积,以标准工作液的浓度为横坐标,以峰面积为纵坐标,绘制标准曲线。再将毒素粗提液制成的试样溶液注入液相色谱仪中,以保留时间定性,同时记录峰面积,根据标准曲线得到待测液中米酵菌酸浓度。
1.2.3 生长曲线的测定
选取唐菖蒲伯克霍尔德菌标准菌株ATCC33664和CICC10574,进行生长曲线的测定。菌株分别接种于PDA 平板,37 ℃培养24 h,挑取单菌落接种至10 mL BHI,于37 ℃,200 r/min 培养约24 h;取10 μL菌液转移到10 mL BHI 液体培养基中混匀(稀释1 000 倍),取200 μL 稀释后的菌液加到96 孔板样品孔中(8 个平行孔),同时以BHI 肉汤为空白对照,置于多功能微孔板检测仪中进行测定。结果以培养时间为横坐标,OD600值为纵坐标,绘制生长曲线。
1.2.4 培养条件对BGC 生长和产毒的特性分析
1.2.4.1 菌株的活化
将保存于4 ℃菌株ATCC33664接种于PDA平板,37 ℃培养24 h,挑取单菌落接种于BHI 肉汤中,于37 ℃,200 r/min,培养至对数期后待用。
1.2.4.2 培养基对BGC 生长和产毒的分析
取10 μL 培养至对数期的菌液分别接种至10 mL PD、BHI、LB 液体培养基,37 ℃培养48 h,培养结束后测定菌液的OD600值。同时,将培养至对数期的菌液配成1 麦氏浓度的菌悬液分别涂布到铺有玻璃纸的PD 半固体平板、BHI 半固体平板与LB 半固体平板上,26 ℃培养5 d,培养结束后进行米酵菌酸的含量测定。
1.2.4.3 培养时间对BGC 产毒的分析
将培养至对数期的菌液配成1 麦氏浓度的菌悬液在铺有玻璃纸的马铃薯葡萄糖半固体平板上涂布均匀后,26 ℃培养1、2、3、4、5、6、7、10、15 d,培养结束后进行米酵菌酸的含量测定。
1.2.4.4 温度对BGC 生长和产毒的分析
取10 μL 培养至对数期的菌液接种于10 mL BHI液体培养基,4、15、20、25、30、37、42 ℃培养48 h,培养结束后测定各温度下菌液的OD600值。同时,将配成1 麦氏浓度的菌悬液涂布于铺有玻璃纸的马铃薯葡萄糖半固体平板,4、15、20、25、30、37、42 ℃培养5 d,培养结束后进行米酵菌酸的含量测定。
1.2.4.5 pH 对BGC 生长和产毒的分析
将BHI 与PD 液体培养基及马铃薯葡萄糖半固体培养基pH 值分别调至1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、11.0,取10 μL 培养至对数期的菌液分别接种于BHI 与PD 液体培养基,37 ℃培养48 h,培养结束后测定各pH 值下菌液的OD600值。同时,将配成1 麦氏浓度的菌悬液分别涂布于铺有玻璃纸调好pH 的马铃薯葡萄糖半固体平板,26 ℃培养5 d,培养结束后进行米酵菌酸的含量测定。
1.2.4.6 NaCl 浓度对BGC 生长和产毒的分析
在BHI 与PD 液体培养基及马铃薯葡萄糖半固体培养基中分别添加质量浓度为0、0.005、0.01、0.015、0.02、0.025、0.03、0.035、0.04、0.05、0.06 g/mL 的NaCl 的溶液,取10 μL 培养至对数期的菌液分别接种于10 mL BHI 与PD 液体培养基,37 ℃培养48 h,培养结束后测定各NaCl 浓度下菌液的OD600值。同时,将配成1 麦氏浓度的菌悬液涂布于铺有玻璃纸添加NaCl 的马铃薯葡萄糖半固体平板,26 ℃培养5 d,培养结束后进行米酵菌酸的含量测定。
1.2.5 数据处理
每个试验重复3 次,通过IBS SPSS 24.0 软件进行数据分析,并用Duncan 检验比较组间差异,采用Excel 2010、Origin 2019 软件制表作图。
2 结果与讨论
2.1 BGC 的污染调查
从100 份样品中共检出4 份唐菖蒲伯克霍尔德菌阳性样品,阳性率为4%,按照食品类型分析(表1),木耳[18]、银耳及淀粉类样品的检出率分别为20%、14.29%、1.33%,面粉类样品则无检出。4 份阳性样本共分离出12 株唐菖蒲伯克霍尔德菌,经产毒培养与毒素测定,1 株(S6,分离自木耳)米酵菌酸含量为14.9 μg/mL,其它菌株的含量均<0.005 μg/mL。需要注意的是,两株唐菖蒲伯克霍尔德菌标准株中,CICC10574 的含量<0.005 μg/mL,而ATCC33664 的米酵菌酸含量为131 μg/mL,且生长稳定、产毒量大,适合作为后续试验的标准株使用。

表1 按照食品类型分类的BGC 阳性样本分布Table 1 Distribution of BGC positive samples classified by food type
2018 年广东省首次因食用河粉引起米酵菌酸中毒事件,同年苏嘉妮等[19]调查分析了广东省1570 份米面制品、淀粉及其制品中BGC 的污染情况,检出率为0.06%(1/1570)。陈荣桥等[20,21]调查我国南方部分省份食品工业中常用的米和食用淀粉中BGC 污染情况,检出率为3.1%(4/129),4 份阳性样本全部来自于进口碎米;并利用全基因组重测序与单核苷酸多态性分析菌株的同源关系,表明原料米中BGC 的基因组序列与产地溯源具有较大相关性,在湿粉生产加工过程中存在BGC 污染传递的风险。近年来我国暴发了多起因食用泡发2~3 d的干木耳引起米酵菌酸中毒事件,并有多例重症和死亡病例[22]。黑木耳是我国栽培产量第二大的食用菌品种[23],随机抽查的木耳中检出唐菖蒲伯克霍尔德菌和BGC,表明木耳中存在较高的被唐菖蒲伯克霍尔德菌椰毒致病变种污染的风险。
2.2 唐菖蒲伯克霍尔德氏菌的生长曲线
如图1 所示,产毒株ATCC33664 和不产毒株CICC10574在培养0~10 h内均处于延迟期,生长缓慢,在培养约10 h 后先后进入对数生长期,并持续到约20 h,20~50 h 时进入稳定期,50 h 后进入衰亡期。产毒株与不产毒株的唐菖蒲伯克霍尔德氏菌在生长趋势上无明显区别。

图1 唐菖蒲伯克霍尔德氏菌的生长曲线Fig.1 The growth curve of Burkholderia gladiolus
2.3 培养条件对BGC 生长和产毒的特性分析
2.3.1 不同培养基对BGC 生长和产毒的影响
如图2,BGC 在BHI、PD 和LB 中均生长良好,且在BHI 中生长最好,其次为LB、PD 水;产毒培养中,培养于PD 半固体琼脂(马铃薯半固体琼脂)的菌株产毒量(231.24 μg/mL)明显大于BHI 半固体琼脂(55.85 μg/mL)和LB 半固体琼脂(38.84 μg/mL),说明马铃薯半固体琼脂更适宜椰毒假单胞菌酵米面亚种的产毒。间接证实了BGC 主要污染的食品类型为富含多糖、淀粉类的发酵米面制品、银耳、木耳等。
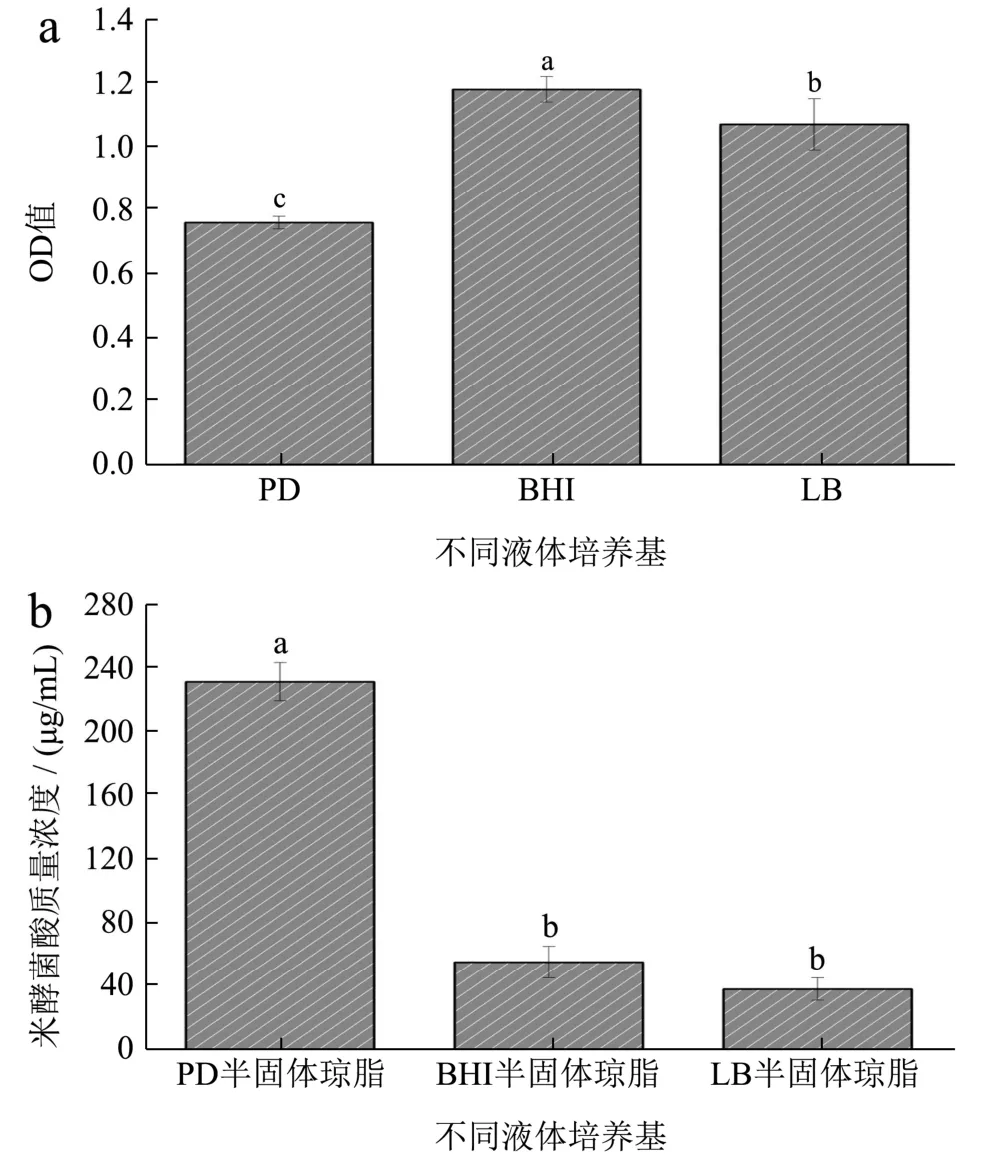
图2 BGC(ATCC 33664)在不同培养基中的生长与产毒情况Fig.2 Growth and toxin production of BGC (ATCC 33664) in different media
2.3.2 培养时间对BGC 产毒的影响
如图3 所示,前3 d 仅有微量的米酵菌酸的生成(0.56~1.84 μg/mL),从第4 d 开始,米酵菌酸大量产生(40.63 μg/mL),并在第5 d 达到最高值(606.9 μg/mL);继续进行产毒培养,6~15 d 米酵菌酸的含量仍然处于高含量范围(4 3 5.1 9~515.86 μg/mL),无明显下降趋势,且在第15 d 时,半固体培养基表面仍有少量淡黄绿色菌苔生长。提示消费者们,为最大限度降低或消除风险隐患,不可食用长时间泡发的米面制品、银耳木耳等。

图3 BGC(ATCC 33664)在不同培养时间下的产毒情况Fig.3 Toxin production of BGC (ATCC 33664) under different culture time
2.3.3 温度对BGC 生长和产毒的影响
由图4a 可以看出,在4、15 ℃培养2 d,BGC 的OD600值增长缓慢;20~37 ℃温度下,随着温度的升高该菌的OD600值逐渐增大,在37 ℃时增至最大;在温度达到42 ℃时,该菌的OD600值趋近于0,说明该菌的适宜生长温度为20~37 ℃,最适生长温度为37 ℃,低于15 ℃或高于42 ℃条件下,生长缓慢或几乎不生长。
由图4b 可以看出,BGC 在4 ℃下不产米酵菌酸(<0.005)、15 ℃下产生米酵菌酸的含量较低(2.11 μg/mL);20~30 ℃范围内,随着温度的升高,产毒量逐渐增大(23.03~1 225.17 μg/mL);随着温度的进一步提升,产毒量逐渐下降,37℃下该菌的产毒量仍然维持在较高的状态(528.3 μg/mL),直至42 ℃,仅极微量米酵菌酸产生(0.28 μg/mL);说明该菌的适宜产毒温度在20~37 ℃,最适产毒温度为30 ℃,低于15 ℃或高于42 ℃条件下,产毒量较少或几乎不产毒。BGC 在低温环境下(4~15 ℃)仍然存活,且产生少量的米酵菌酸,需引起消费者的注意。

图4 BGC(ATCC 33664)在不同培养温度下的生长与产毒情况Fig.4 Growth and toxin production of BGC (ATCC 33664)under different culture temperatures
2.3.4 pH 对BGC 生长和产毒的影响
由图5a 可以看出,pH 值在1.0~3.5 和9.0~10.5时,BGC 在BHI 中的生长受到了明显的抑制,OD600值几乎接近于0,而在PD 水中BGC 在pH 值为9.0~10.5 的条件下仍能较好生长,说明BGC 在碱性环境下(9.0~10.5)的生长受培养基的影响较大;pH 值在4.0~8.5 时,BGC 在BHI 与PD 中均生长良好;当pH 值为11.0 时,BGC 在BHI 与PD 水中的OD600值均趋于0。
BGC 在不同pH 值的马铃薯葡萄糖半固体琼脂上的产毒情况与在PD 水中的生长趋势一致,如图5b 所示,在pH 值≤3.5 时,BGC 几乎不产毒(0.004 μg/mL);当pH 值在4.0~7.0 时,随着pH 值的升高,产毒量迅速上升(36.98~425.61 μg/mL),并在pH 值为7.0 时达到最大值(425.61 μg/mL);继续增大pH 值至10.0 时,该菌的产毒量仍然处于较高水平(2 2 7.8 1~348.5 μg/mL),当pH 值为11 时,BGC 几乎不生长,产毒量也下降趋至0。

图5 BGC(ATCC 33664)在不同pH 值下的生长与产毒情况Fig.5 Growth and toxin production of BGC (ATCC 33664)under different pH
2.3.5 NaCl 浓度对BGC 生长和产毒的影响
由图6a 可以看出,在BHI 和PD 水中添加0~0.02 g/mL 质量浓度的NaCl 时,随着NaCl 的增加,OD600值均逐渐降低;当NaCl 质量浓度≥0.02 g/mL时,在BHI 中的OD600值开始趋于0,而在PD 水中NaCl 质量浓度为0.02~0.04 g/mL 时,该菌仍然生长较好,直到质量浓度≥0.04 g/mL 时,才趋于0。在产毒方面,NaCl 的添加严重抑制BGC 的产毒:当NaCl质量浓度≤0.035 g/mL 时,该菌仍然有一定的产毒量(52.27~37.44 μg/mL),直到0.04 g/mL 时,才趋于0。
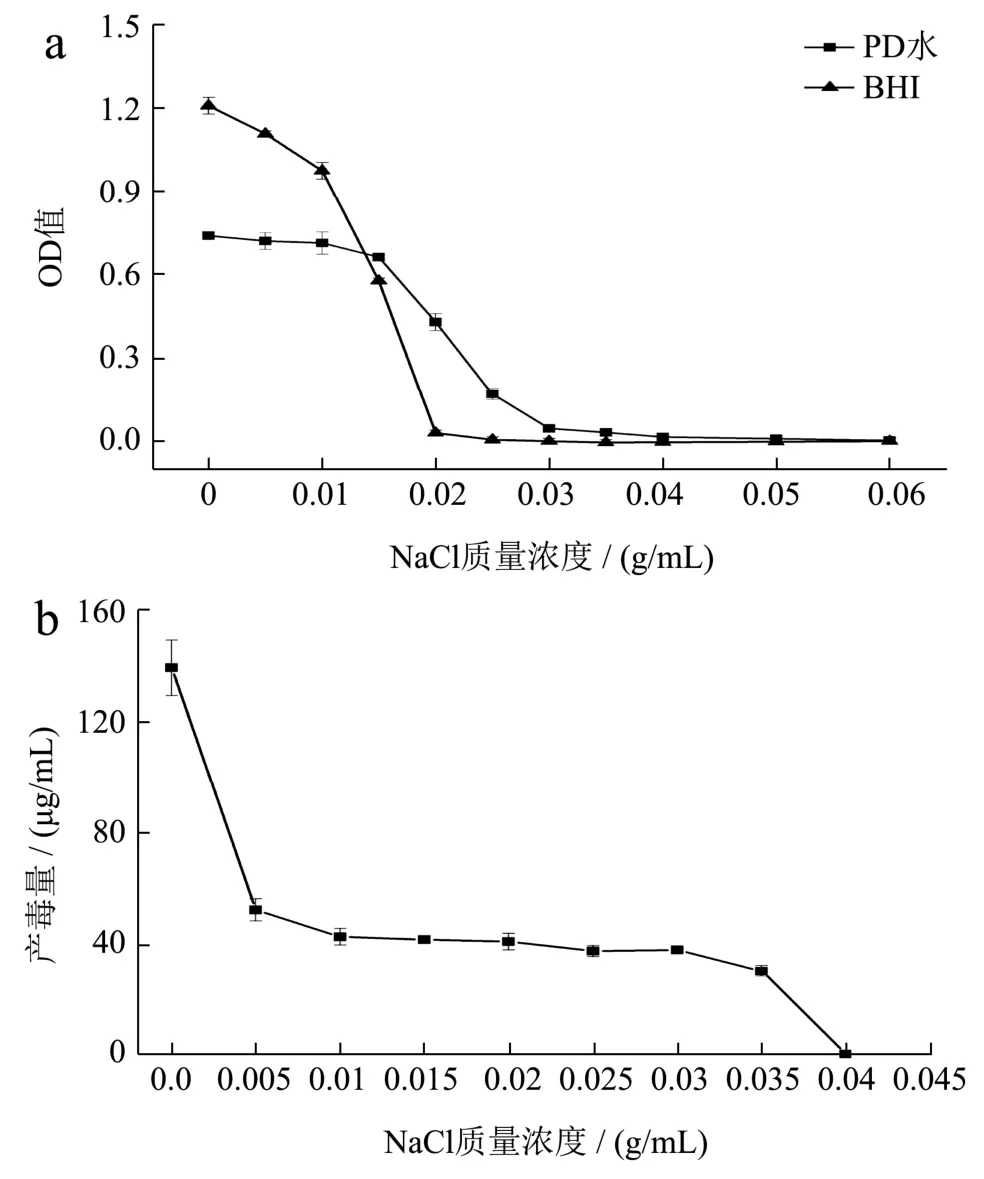
图6 BGC(ATCC 33664)在不同NaCl 浓度下的生长与产毒情况Fig.6 Growth and toxin production of BGC (ATCC 33664)under different NaCl concentrations
唐菖蒲伯克霍尔德菌椰毒致病变种是一种发病率和死亡率极高的食源性致病菌,易对米面发酵品、变质银耳、长时间泡发的木耳及薯类制品等造成污染。因此开展食品中唐菖蒲伯克霍尔德菌椰毒致病变种的污染调查工作,是保障食品安全与公共卫生的重要措施之一。本研究针对广东地区居民饮食中常见的湿淀粉类与湿面制品、湿木耳与银耳进行BGC 分离鉴定。结果显示,从100 份样品中检出4 份唐菖蒲伯克霍尔德菌阳性样品,总检出率为4%(4/100),检出1 份BGC 阳性样品(产毒量为14.9 μg/mL),总检出率为1%(1/100),其中湿木耳的检出率为11.11%(1/9),银耳与淀粉类制品无检出。
由唐菖蒲伯克霍尔德菌椰毒致病变种引起的食物中毒多发生在偏远、经济相对落后的地方,近年来,由该菌产生的毒素所引起的食物中毒偶有发生在经济发达地区,也因此人们对它的关注度持续上升。本研究分析了BGC 在不同环境条件下的生长和产毒情况,结果显示,该菌的生长与产毒受培养基的影响较大;在碱性(pH 值为9.0~10.5)与一定渗透压(NaCl 质量浓度为0.02~0.04 g/mL)环境下,BGC 在PD 中能生长,而在BHI 几乎不生长;BGC 最适生长温度与pH 值分别为37 ℃、6.0,最佳产毒温度与pH 值为30 ℃、7.0;BGC 在低质量浓度的NaCl(0~0.02 g/mL)环境下生长良好,当NaCl 质量浓度≥0.025 g/mL,BGC 的生长受到抑制,同时NaCl 的添加对BGC 的产毒具有明显的抑制,当NaCl 质量浓度达到0.04 g/mL 时,则完全抑制米酵菌酸的产生。结果提示在食品加工或贮存过程中添加一定浓度的NaCl 以及营造低温环境可有效减少由米酵菌酸引起的食物中毒。对相应食品在生产、运输、储存、销售等环节提出了切实建议,为相关部门在各环节加强安全监管,保障人民的身体健康和饮食安全提供了理论基础。
3 结论
本研究对广州地区淀粉类,面粉类,湿木耳及湿银耳中唐菖蒲伯克霍尔德菌椰毒致病变种的污染情况进行了调查,并对BGC 在不同培养条件下的生长与产毒特性进行了分析,初步了解了BGC 的污染与分布情况,掌握了BGC 在不同培养基、培养时间、培养温度、pH 和NaCl 浓度下的生长与产毒规律。对市售的米面制品、木耳银耳等进行了风险预警,为相关企业加强防控,相关部门规范管理提供了参考。同时,对于该菌在不同环境下的存活机理和产毒机制的研究则将是下一步的工作重点。

