β-环糊精丁烯酸酯对噻菌灵的增溶效果及其复合物的抑菌活性
李咏富,罗其琪,田竹希,何扬波,石彬,龙明秀
(1.贵州省农业科学院现代农业发展研究所,贵州贵阳 550006)(2.贵州省特色农产品辐照保鲜与加工工程技术研究中心,贵州贵阳 550006)
噻菌灵(2-(4-thiazolyl)-1H-benzimidazole)是一种苯并咪唑类杀菌剂,属于内吸性广谱杀菌剂,作用机制为抑制真菌有丝分裂过程中的微管蛋白的形成,可防治多种真菌引起的真菌病害[1]。此外,在水果保鲜领域中,噻菌灵也可用于柑橘、荔枝和梨等水果贮藏期的真菌病害[2,3]。噻菌灵虽然具有较好的抑菌活性,但其水溶性差,其溶解度随溶液的pH 值变化而变化,25 ℃条件下,当水溶液的pH 值2 时,水中溶解度约为10 g/L,当pH值5~12时,水中溶解度低于50 mg/L[4]。虽然在低pH 值条件下,噻菌灵在水溶的溶解性较高,但在果蔬保鲜过程中,较低的pH 值处理果蔬表皮会对其表皮组织产生不可逆的损伤。处理后,噻菌灵经果皮逐渐向果肉渗透,增加了人体摄入的风险。因此,增加噻菌灵在水溶液中的溶解度且降低其向果蔬组织内部迁移是提高噻菌灵在果蔬保鲜领域中应用安全性的有效途径。
β-环糊精是一种常用的疏水性药物的包埋载体,但在室温下其溶解度较低,仅为18.5 g/L(16.3 mmol/L),在水中的溶解度随着温度的升高而升高,室温下对疏水性药物的增溶效果有限。因此,需要对β-环糊精进行化学改性,增加其溶解性,并提高其对疏水性药物的包埋能力。张志飞[5]和冯鸣等[6]分别制备了2-羟丙基-β环糊精和6-羟丙基-β环糊精,其在水中的溶解度分别为700 g/L 和500 g/L。
本研究通过将β-环糊精的羟基酯化制备丁烯酸β-环糊精酯,以期增加其在水中的溶解度,同时在β-环糊精中引入乙烯基基团,可作为制备β-环糊精的高分子聚合物的结构单体;同时,将丁烯酸β-环糊精酯作为药物载体,增加疏水性抑菌剂噻菌灵在水中的溶解度。同时,本研究通过相溶解度实验[7,8],考察丁烯酸β-环糊精酯对噻菌灵的增溶效果,并确定噻菌灵同β-环糊精及其丁烯酸酯衍生物形成的药物复合物的稳定常数(Kc)。通过抑菌实验,考察药物包结复合物的抑菌活性。
1 材料与方法
1.1 主要试剂
β-环糊精、丁烯酸、N,N-羰基二咪唑、二甲氨基吡啶、N,N-二甲基甲酰胺、氢化钙、三乙胺、磷酸、癸烷磺酸钠和无水乙醇均为分析纯试剂,采购于上海阿拉丁生化科技股份有限公司。实验用水为超纯水。噻菌灵标准试剂采购于上海阿拉丁生化科技股份有限公司。黑曲霉(CMCCF98003)采购于南京乐诊生物技术有限公司。
1.2 仪器设备
Agilent-1260 型高效液相色谱仪,美国安捷伦科技有限公司;Spectrum 400 ART-红外光谱仪,珀金埃尔默科技有限公司;IKA-10 旋转蒸发仪,德国艾卡科技有限公司。
1.3 噻菌灵的液相检测
1.3.1 离子对试剂
取7.0 mL 磷酸加入盛有200 mL 水的烧杯中,搅拌稀释,然后加入1.0 g 癸烷磺酸钠,溶解,再加入10.0 mL 三乙胺,加水稀释至1 000 mL。使用三乙胺调节pH 值至2.4。
1.3.2 色谱条件
色谱柱:C18 柱,100A(250 mm×4.60 mm),Kromasil,德国Eka Chemicails 公司;流动相:甲醇/离子对试剂(50/50),流量0.8 mL/min;检测条件:检测波长300 nm;色谱柱温度30 ℃;进样量10.00 μL[9]。
1.3.3 噻菌灵标准曲线
准确称取10.00 mg 噻菌灵于烧杯中,加入少量甲醇溶解,并定容至10 mL。将上述溶液梯度稀释至1.0、5.0、10.0、50.0、100.0 和500.0 μg/mL,得到不同浓度的标准工作液。每个质量浓度标准工作液进行液相色谱测量,每个样品进样3 次。根据峰面积同浓度建立标准工作曲线:
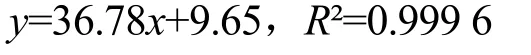
1.4 β-环糊精-丁烯酸酯的合成
1.4.1 催化剂溶液配制
称取0.61 g 4-二甲基吡啶加入少量N,N-二甲基甲酰胺溶解,之后再100 mL 容量瓶中定容备用。
1.4.2β-环糊精-丁烯酸酯的合成
准备洁净的250 mL 三角瓶将其置于120 ℃烘箱中,加热30 min 烘干备用。分别称取11.35 gβ环糊精和7.74 g 丁烯酸置于250 mL 三角瓶,加入100 mL N,N-二甲基甲酰胺磁力搅拌溶解,之后再加入7.0 mL催化剂。称取14.59 g N,N-羰基二咪唑置于250 mL 三角瓶中并加入100 mL N,N-二甲基甲酰胺溶解。待三角瓶中无固体颗粒存在时,将羰基二咪唑溶液加入溶有环糊精的三角瓶中,25 ℃水浴磁力搅拌下反应20 min,反应结束后加入20 mL 水终止反应[10]。
1.4.3 产物纯化
上述反应后的混合溶液于60 ℃,减压(5 mbar)旋转蒸发至溶液粘稠,向旋蒸瓶加入100 mL 无水乙醇沉淀出粗产物;将沉淀物加入到料理杯中充分搅拌,每次加入50 mL 无水乙醇,搅拌过后倒出静止一段时间去除上清液,重复该操作5 次。将上述洗涤后的沉淀转移至空的SPE 小柱,真空抽滤,在SPE 小柱中分3 次加入100 mL 无水乙醇冲洗上述沉淀物,得到纯化后的产物。产物在55 ℃下烘干备用。
1.5 β-环糊精-丁烯酸酯的结构表征
ATR-FTIR 谱图采用红外光谱仪Spectrum 400(Perkin Elmer Co.美国)进行检测。ATR 附件包含金刚石晶体内反射部件,红外光束的入射角45 °。光谱分辨率为4 cm-1,光谱在该分辨率上执行总共16 次扫描背景和样本[11,12]。每个样品大约10 mg,加样后立即进行扫描。确保样品表面无空气气泡,在样品上方放置一小块铝箔。采样结束后,ATR 附件晶体用75%(V/V)的酒精清洗,在收集下一个样品图谱前,重新进行背景扫描。每个样品重复三次,取其均值使用Origin 2018 数据处理软件进行作图。
1.6 β-环糊精-丁烯酸酯的溶解度测定
称取1.00 gβ-环糊精-丁烯酸酯到15 mL 离心管内,加入10 mL 超纯水,于25 ℃水域中磁力搅拌24 h,在6 000 r/min 的速度下离心,除去上清液,沉淀物于100 ℃烘箱内至恒重,称量质量。溶解实验重复三次。
1.7 相溶解度实验
相溶性研究是一种评价环糊精对疏水药物溶解度的影响传统的方法,该方法由Higuchi 和Connors 在1965 年提出[13]。表观稳定系数的计算如式(1)所示:

式中:
S0——噻菌灵在纯水中的溶解度;
slope——相溶解度图中线性方程的斜率;
Kc——表观稳定系数。
将噻菌灵(100 mg)分别加入含有10 mL 不同浓度β-环糊精-丁烯酸酯(0、4.15、8.31、12.47 和16.62 mmol/L)和β-环糊精(0、0.88、2.64 和4.41 mmol/L)的具塞三角瓶内。然后用封口膜将具塞三角瓶瓶口密封以防止溶液中水分的蒸发。将封口的三角瓶置于温度为30、40 和50 ℃水域摇床中,振荡3 d。当溶液中药物达到溶解平衡后,将悬浊液用0.45 μm 微孔滤膜过滤,除去未溶解的药物,收集滤液,将滤液稀释一定浓度后,使用高效液相色谱(HPLC)进行分析测试。
1.8 抑菌实验
噻菌灵-β-环糊精复合物和噻菌灵-β-环糊精丁烯酸酯复合物对黑曲霉的抑制实验采用察氏琼脂法[14]。对照组为30、40 和50 ℃下噻菌灵在纯水中的饱和溶液,处理组为上述温度下噻菌灵在β-环糊精及其丁烯酸酯水溶液(β-环糊精浓度为0.88、2.64 和4.41 mmol/L;β-环糊精丁烯酸酯的浓度为4.15、8.31、12.47 和16.62 mmol/L)中的饱和溶液。上述溶液经0.45 μm 过滤后,分别用移液枪准确吸取7.5 μL 药物溶液添加加到直径为6 mm 的滤纸片上,药物添加两次(共计15 μL)。将含有药物的滤纸片均匀的分布于琼脂培养基上。培养皿于35 ℃恒温培养箱内培养36 h后,用游标卡尺测定抑菌圈的大小,抑菌圈的定义为滤纸片边缘同抑菌圈边缘之间的距离(单位:mm)。
1.9 数据处理
所有实验均进行三次重复。实验结果均值±标准差表示。实验数据采用Prism 5.0 GraphPad 软件进行统计学分析。差异的显著性通过配对t检验来计算。p<0.05 认为有统计学意义,两者有显著差异,p>0.05认为两者无显著差异。
2 结果与分析
2.1 β-环糊精-丁烯酸酯的红外结构解析
β-环糊精(图1a)、丁烯酸(图1b)和β-环糊精-丁烯酸酯(图1c)的红外光谱图如图1 所示。
丁烯酸的红外图谱(图1b)中,在1 683 cm-1出现了C=O 的伸缩振动,在1 650 cm-1出现了C=C 的伸缩振动,在1 421 cm-1出现了C-OH 面内弯曲振动,在1 314 cm-1和1 223 cm-1出现了羧酸C-OH 伸缩振动,在β-环糊精-丁烯酸酯中没有出现丁烯酸的特征吸收峰,说明未反应的丁烯酸经纯化过程被除去了。在β-环糊精-丁烯酸酯的红外图谱中(图1c)同样观察到了β-环糊精的红外图谱(图1a)中的特征吸收,如说明在形成酯的过程中保留了β-环糊精完整的环状结构。β-环糊精-丁烯酸酯中,在1 738 cm-1出现了不饱和酯羰基C=O 伸缩振动[15],这是由于当烯类双键与酯羰基的C 原子相连时,共轭效应使羰基振动频率向低频移动;同时β-环糊精-丁烯酸酯保留了不饱和双键C=C 的伸缩振动(1 650 cm-1),但该伸缩振动的吸收峰强度显著降低。同时,在1 253 cm-1观察到了酯键中C-O 的伸缩振动频率(1 240 cm-1~1 150 cm-1)[16],频率升高的原因是由于不饱和双键上的π电子与羰基相的C-O 上氧原子的电子形成了大共轭体系,增强了酯键中C-O 的键级[17]。通过红外图谱对比分析,可以确定β-环糊精丁烯酸酯的合成。

图1 β-环糊精、丁烯酸和β-环糊精-丁烯酸酯的红外光谱图Fig.1 FT-IR spectra of β-cyclodextrin,butenic acid and β-cyclodextrin-butenate
2.2 噻菌灵-β-环糊精丁烯酸酯药物复合物的红外图谱解析
在噻菌灵的红外图谱中(图2a),在1 456 cm-1、1 404 cm-1和1 393 cm-1处,观察到了噻菌灵化学结构中苯环骨架的振动吸收峰,在737 cm-1处观察到了芳环中C-H 的面外弯曲振动吸收峰[18],在1 579 cm-1处观察到了噻菌灵化学结构中C=N 的伸缩振动[19,20];在噻菌灵-β-环糊精-丁烯酸酯复合物的红外图谱中同样观察到了1 579 cm-1处噻菌灵化学结构中C=N 的伸缩振动吸收峰,说明β-环糊精-丁烯酸酯可以同噻菌灵形成包结复合物;但在药物复合物中未观察到噻菌灵苯环结构的红外特征吸收峰,说明噻菌灵同β-环糊精-丁烯酸酯的作用位点是其结构中的苯环同β-环糊精-丁烯酸酯中的疏水性内腔通过弱的分子间相互作用力结合。
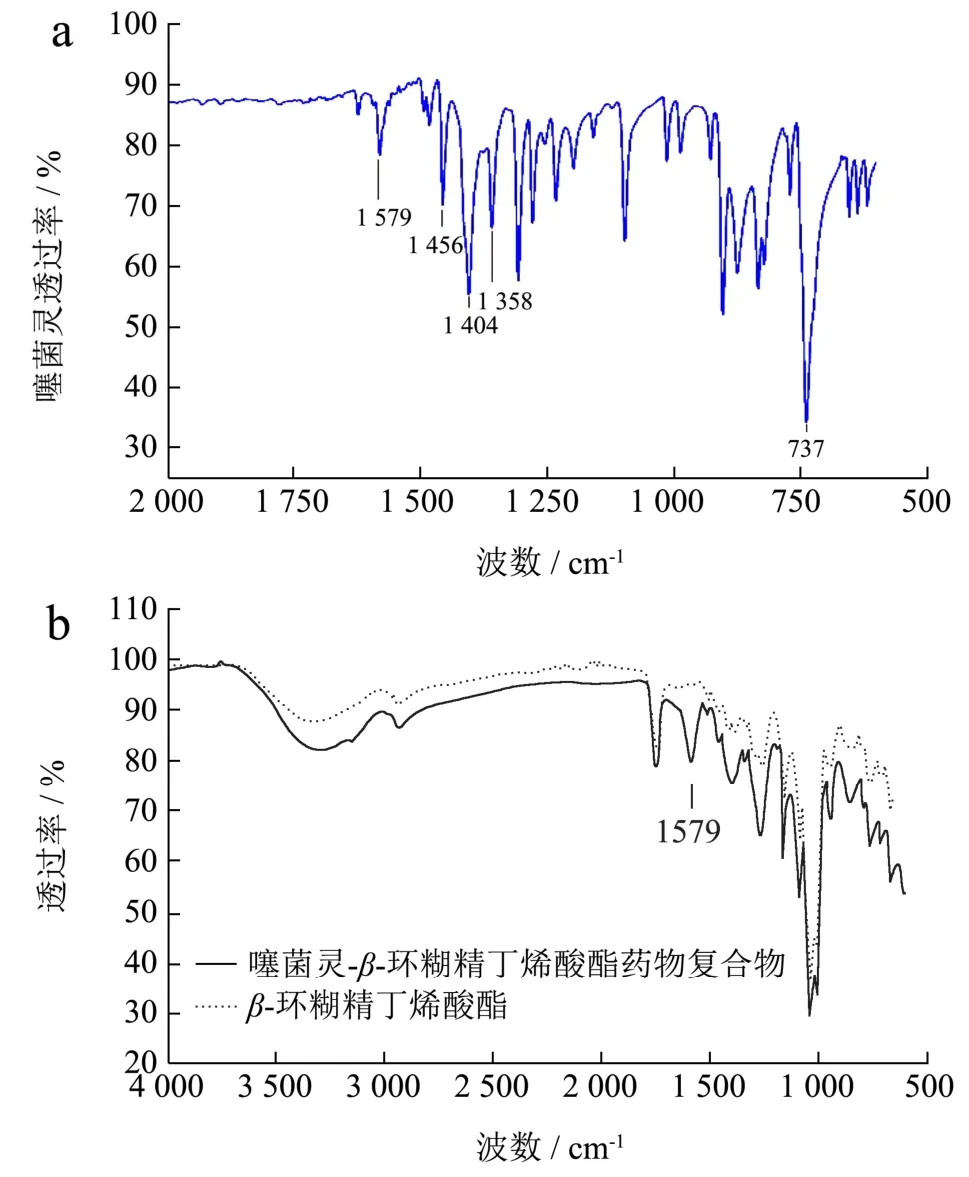
图2 噻菌灵和噻菌灵-β-环糊精-丁烯酸酯复合物的红外光谱图Fig.2 FT-IR spectra of thiabendazole and thiabendazole-β-cyclodextrin-butenate complex
2.3 液相色谱分析
通过观察液相色谱图发现,在相同色谱条件下,噻菌灵的保留时间为10.54 min,噻菌灵-β-环糊精复合物的保留时间为9.94 min,噻菌灵-β-环糊精丁烯酸酯复合物的保留时间为9.88 min,如图3 所示。保留时间的差异说明噻菌灵同β-环糊精及其丁烯酸酯衍生物形成包结复合物后,其亲水性有了一定程度的提高。由于噻菌灵-β-环糊精丁烯酸酯复合物的保留时间更靠前,也说明-β-环糊精丁烯酸酯的亲水性优于β-环糊精,也从侧面佐证了β-环糊精丁烯酸酯的溶解度高于β环糊精。
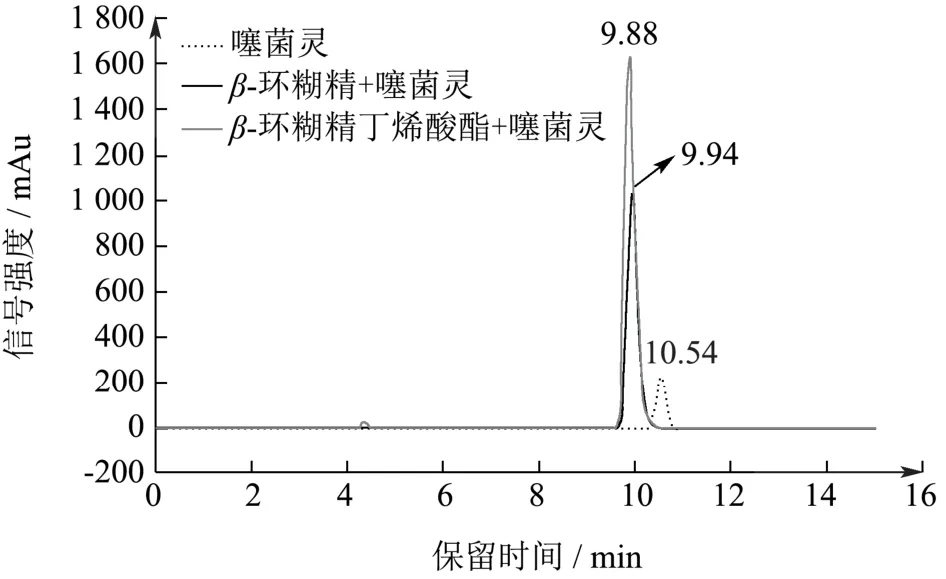
图3 噻菌灵、噻菌灵-β-环糊精和噻菌灵-β-环糊精丁烯酸酯复合物的液相色谱图Fig.3 Liquid chromatographic diagram of thiabendazole,and thiabendazole-β-cyclodextrin complex and thiabendazole-β-cyclodextrin butenate complex
2.4 β-环糊精及其丁烯酸酯衍生物对噻菌灵的增溶效果
β环糊精及其丁烯酸酯衍生物均可增加噻菌灵在水中的溶解度,如图4 所示。随着温度及β环糊精及其丁烯酸酯衍生物水溶液浓度的升高,噻菌灵在水中的溶解度也随之升高。

图4 不同温度下噻菌灵在β-环糊精及其丁烯酸酯衍生物水溶液中的浓度Fig.4 Concentration of thiabendazole in β -cyclodextrin and its butenatederivant aqueous solution at different temperatures
Ayşe Nur Oktay 在药物复合物的相溶解度研究中发现,当客体(药物)浓度与包埋物溶液浓度成线性关系时,两者的化学计量比应为1:1[21]。噻菌灵的浓度同β-环糊精及其丁烯酸酯衍生物在水溶液中的浓度成良好的线性关系,表明噻菌灵同β-环糊精及其丁烯酸酯衍生物形成的复合物的化学计量比为1:1。通过线性拟合,得到不同温度下的斜率,结合噻菌灵在水溶液中的初始浓度S0值,利用式(1)计算得到药物复合物的表观稳定系数Kc,如表1 所示。

表1 不同温度下复合物噻菌灵-β-环糊精和噻菌灵-β-环糊精丁烯酸酯的表观稳定系数Kc及S0值Table 1 The Kc and S0 value of thiabendazole-β-cyclodextrin complex and thiabendazole-β-cyclodextrin-butenate complex at different temperature
随着温度的升高噻菌灵-β-环糊精和噻菌灵-β-环糊精丁烯酸酯复合物的表观稳定系数Kc逐渐升高,升温有利于药物复合物的形成。经方差显著性分析Kc-β-环糊精和Kc-β-环糊精丁烯酸酯并无显著性差异(p>0.05),说明两种药物复合物在水中的稳定性相近。β-环糊精丁烯酸酯对噻菌灵的增溶效果是因为其自身在水中的溶解度高于β-环糊精。在β-环糊精丁烯酸酯的溶解实验中,其水溶液中的溶解度为37.92g/L,β-环糊精在水溶液中溶解度的2.05 倍。目前,未见关于噻菌灵同β-环糊精形成包结复合物的相关报道,但根据姜慧明等的研究报道[22],多菌灵在羟丙基-β-CD 中的表观稳定系数为600 M-1,说明多菌灵同羟丙基-β-环糊精形成的包结复合物在水溶液中的稳定性更高,这是因为相较于多菌灵分子,噻菌灵的分子结构更大,其4 位的噻唑基的亲水性更强,同疏水性的β-环糊精内腔的亲合力更低。
2.5 噻菌灵药物复合物的抑菌活性
噻菌灵-β-环糊精复合物及噻菌灵-β-环糊精丁烯酸酯复合物的抑菌圈直径如图5a 和图5b 所示。随着β-环糊精及其丁烯酸酯水溶液浓度的增加,抑菌圈的直径也逐渐增大。在制备药物复合物时,水溶液温度越高,噻菌灵药物复合物的抑菌效果越强。在水温为50 ℃时,噻菌灵-β-环糊精复合物及噻菌灵-β-环糊精丁烯酸酯复合物的抑菌圈直径分别比噻菌灵对照组增大了1.74 倍和2.09 倍。经配对t检验,处理组的抑菌圈直径同对照组存在显著差异(p<0.05);在50 ℃条件下,β环糊精水溶液浓度为4.41 mmol/L,β环糊精丁烯酸酯水溶液浓度为4.15 mmol/L 时,抑菌圈的直径分别为6.18 mm 和5.93 mm,两者间无显著差异(p>0.05)。图5c(1)为不同温度下,噻菌灵水溶液的抑菌圈(对照组),图5c 中(2)和(3)为不同温度下(β环糊精及其丁烯酸酯衍生物水溶液浓度分别为4.41 mmol/L 和16.62 mmol/L),噻菌灵药物复合物的抑菌圈(处理组),由图5c 可直观地证明β-环糊精及其丁烯酸酯衍生物可提高噻菌灵在水中的溶解度,进而提升其抑菌效果。这是由于随着水溶液温度、β-环糊精及其丁烯酸酯浓度的升高,噻菌灵在水溶液中的浓度也越高。
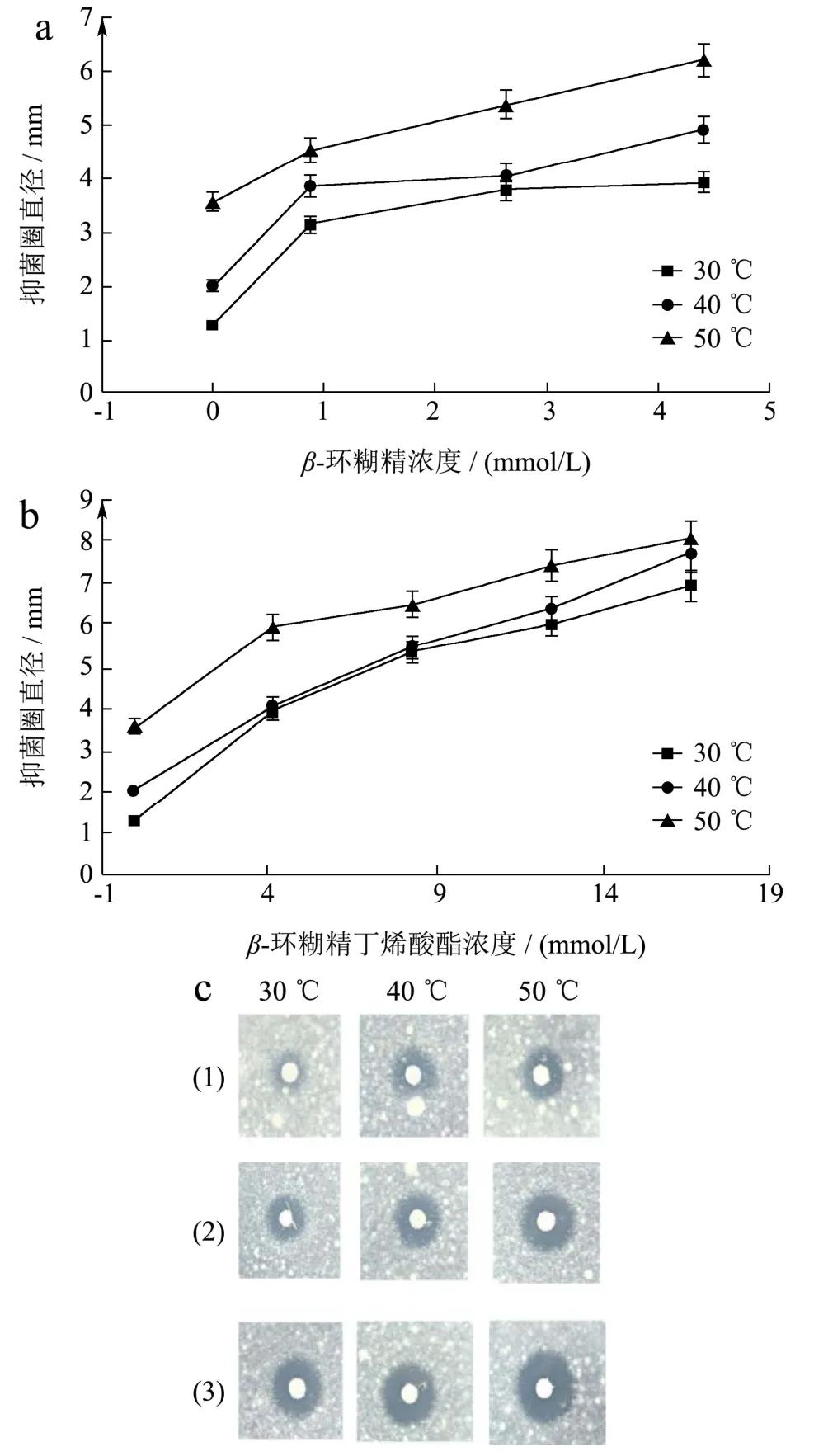
图5 不同浓度下噻菌灵复合物的抑菌圈直径Fig.5 The inhibition zone diameter of thiamethazim complex at different concentrations
3 结论
β-环糊精-丁烯酸酯在水中的溶解度要略好于β-环糊精,溶解度较β-环糊精提高了2.05 倍。β-环糊精-丁烯酸酯在水中的溶解度要低于2-羟丙基-β-环糊精和6-羟丙基环糊精,这是由于丁烯酸酯基的亲水性要低于羟丙基的亲水性。噻菌灵同β-环糊精及其丁烯酸酯衍生物形成包结复合物后,噻菌灵在水中的溶解度得到一定程度上的提升,且随着β-环糊精及β-环糊精丁烯酸酯水溶液浓度的升高而升高;噻菌灵复合物的抑菌效果也强于噻菌灵对照组,抑菌能力的提升原因在于β-环糊精及β-环糊精丁烯酸酯可提高噻菌灵在水溶液中的溶解度。噻菌灵-β-环糊精复合物及噻菌灵-β-环糊精-丁烯酸酯水中的表观稳定系数无显著性差异,随着温度升高,表观稳定系数也随之增高。在近似浓度下(4 mmol/L),噻菌灵-β-环糊精复合物和噻菌灵β-环糊精丁烯酸酯复合物的抑菌效果之间无显著性差异(p>0.05)。噻菌灵同β-环糊精及其丁烯酸酯衍生物形成的包结复合物在水中的稳定性要低于多菌灵-羟丙基β-环糊精复合物在水中的稳定性。

