新疆牛源和人源产志贺毒素大肠埃希氏菌毒力岛的分布
佟盼盼,陈文霞,王芋丹,张萌萌,张毅,郑晓风,刘璐瑶,苏战强,谢金鑫
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
产志贺毒素大肠埃希氏菌(Shiga toxin-producingEscherichiacoli,STEC)是与人类出血性结肠炎(hemorrhagic colitis,HC)和溶血性尿毒症综合征(hemolytic uremic syndrome,HUS)相关的食源性病原体[1]。牛和牛肉制品是其主要宿主和传染源。STEC每年在全世界引起病例数多达280万[2]。虽然O157∶H7 STEC是最常报道的血清型,但目前的研究表明,非O157 STEC感染的病例数有时超过O157 STEC[3]。
细菌的毒力决定簇主要由移动基因编码或与遗传元件相关,如噬菌体、质粒、插入元件或转座子。大量毒力决定簇位于毒力岛(pathogenicity islands,PAIs)上,可以在不同细菌物种之间交换,并通过选择压力组装和稳定,发生致病性变异[4]。越来越多的证据表明,致病菌株和非致病菌株的毒力差异不同程度归因于PAIs上的基因差异[5]。一些致病大肠埃希氏菌利用Ⅲ 型分泌系统(type Ⅲ secretion system,T3SS),编码在PAI肠细胞脱落位点(locus of enterocyte effacement,LEE)上,将广泛的效应蛋白转移到宿主细胞,以破坏细胞信号级联,促进细菌定植[6]。编码T3SS基因位于LEE中并分散于染色体各处[6]。在感染人类的致病菌株中除了确定位于LEE上的基因以外,还鉴定到大量的非LEE效应基因(non-LEE encoded effectorsnles)位于其他PAIs上,这些基因参与宿主细胞内的各种功能,有助于细菌在肠道中定植和毒性,包括抗凋亡活性,破坏宿主固有免疫反应,增加细胞膜通透性、阻断细胞分裂、破坏微管细胞骨架和抑制吞噬等[7]。基于nle基因含量检测的分子风险评估已被用于预测STEC菌株对人类健康是否构成重大风险[8-11]。
STEC的致病性主要归因于其携带的多个毒力基因组岛,如STX(志贺毒素)、LEE PAI和Hly(溶血素),除此之外,一些非LEE基因组O岛(O-island,OI)也与细菌毒力相关,如OI-57、OI-71及OI-122与人类暴发HC和HUS相关[8-9,11-12]。
目前,除了LEE以外,关于STEC的其它PAIs的研究很少。基于PAIs可以作为区分强毒株和弱毒株的标记,本研究拟调查OI-36、OI-57、OI-71和OI-122在新疆牛源和人源STEC中的分布和流行情况,以预测牛源STEC感染人的风险。
1 材料与方法
1.1 材料
1.1.1 菌株来源 受试菌株为2017年-2021年本实验室(新疆农业大学动物医学学院临床实验室)保存的139株牛源非O157 STEC[13-14]和3株人源非O157 STEC(来自2019年临床腹泻样本,由乌鲁木齐市沙依巴克区疾病预防控制中心惠赠)。142株STEC有34株仅携带stx1,24株仅携带stx2,84株同时携带stx1和stx2,9株eae+。用含有终浓度150 mL/L甘油的生理盐水保菌并储存于-80℃,从最初分离限次传代以确保其遗传稳定性。
1.1.2 主要试剂 Thermo PCR反应试剂(2×TaqPCR Green Mix)、Gelgreen(Biotium),中国北京鼎国昌盛生物技术有限责任公司产品;E.coli营养肉汤(EC肉汤)、麦康凯培养基(MAC),中国青岛高科技工业园海博生物技术有限公司产品。
1.1.3 主要仪器 PCR仪(TC1000-G),美国SCILOGEX公司产品;电泳仪(DYY-6D),中国北京六一生物科技有限公司产品;凝胶电泳成像系统,美国Bio-Red公司产品。
1.2 方法
1.2.1 引物合成 参考文献[8]合成OI-36(nleB2、nleC、nleH1-1和nleD),OI-57(nleG2-3、nleG5-2和nleG6-2),OI-71(nleA、nleF、nleG、nleG2-1、nleG9和nleH1-2),OI-122(ent/espL2、nleB和nleE)基因的引物;参考文献[12]合成IO-122上的4个特定基因Z4321、Z4326、Z4332和Z4333的引物(表1),由上海生工生物工程技术服务有限公司合成,按说明书稀释后保存于-20℃冰箱备用。
1.2.2 毒力岛OI-36、OI-57、OI-71和OI-122的PCR扩增 使用细菌DNA提取试剂盒提取142株受试菌的基因组DNA,利用PCR方法进行PAIs OI-36(nleB2、nleC、nleH1-1和nleD);OI-57(nleG2-3、nleG5-2和nleG6-2);OI-71(nleA、nleF、nleG、nleG2-1、nleG9和nleH1-2);OI-122(ent/espL2、nleB和nleE)基因检测,PCR反应体系:12.5 μLTaqMaster Mix,1 μL细菌DNA模板,上、下游引物(10 μmol/L)各1 μL,加入ddH2O至25 μL。反应程序:95℃预变性5 min;94℃变性10 s,55℃退火1 min,72℃ 1 min 30个循环;72℃延长10 min。根据扩增基因的不同,调整退火温度,参数见表1。
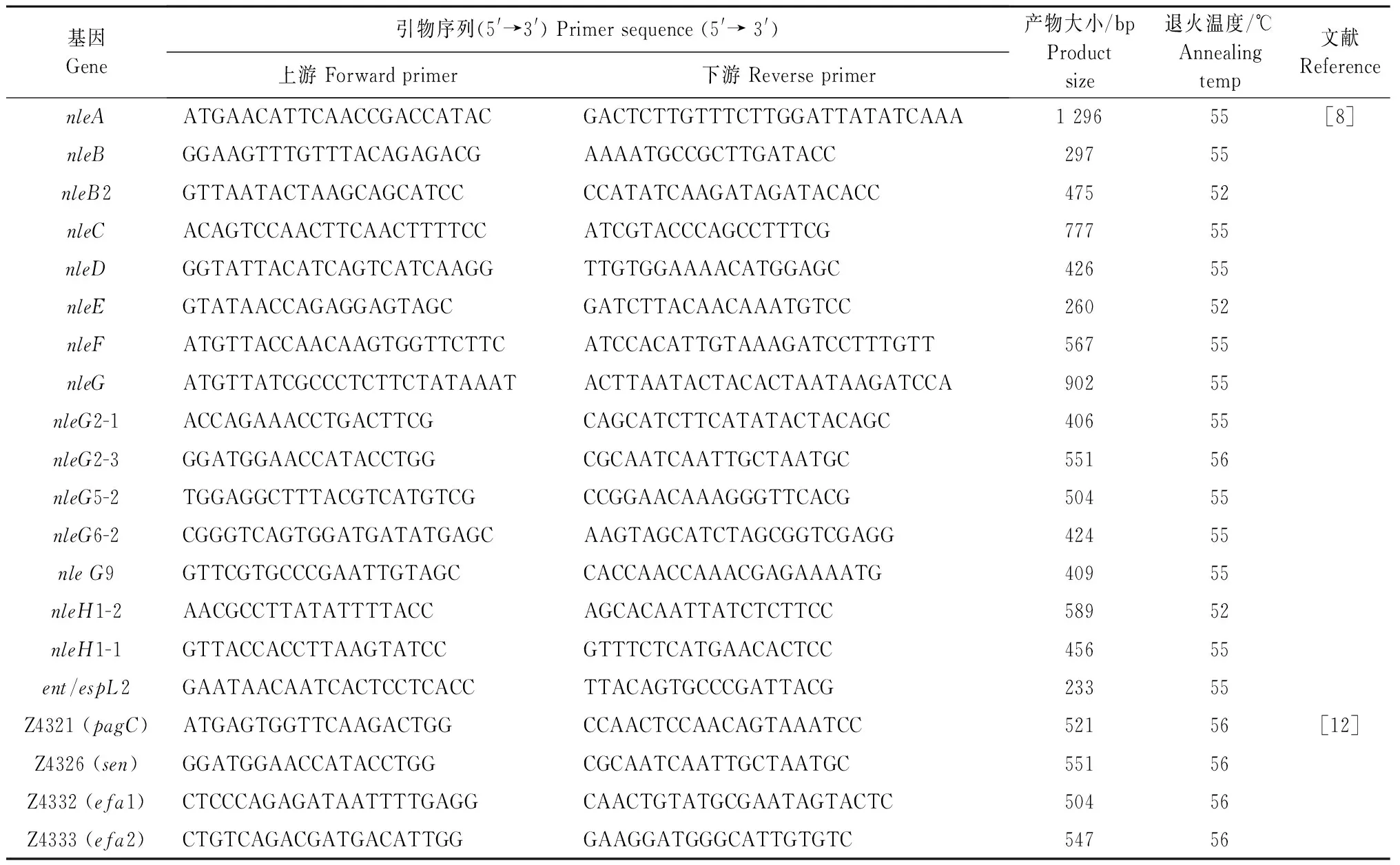
表1 本研究中编码OI毒力基因的引物序列
1.2.3 OI-122特定基因的PCR扩增 利用PCR扩增IO-122上的4个特定基因Z4321、Z4326、Z4332和Z4333。根据Karmali M A提出的模块化方式分析检测结果,同时检出这4个基因为完整的OI-122(COI-122),检出1个~3个基因为不完整的OI-122(INC),4个基因都未检出,表明不存在OI-122(ABS);进一步划分为模块1(Z4321)、模块2(nleB、nleE、ent/espL2和Z4326)和模块3(Z4332、Z4333),每个模块至少检测出1个基因标记即可判断存在OI-122[12]。
2 结果
2.1 编码OI单个毒力基因的检出情况
在142株非O157 STEC中编码OI单个毒力基因的检出频率不同,牛源和人源STEC均不同程度携带20种OI毒力基因,但有24株未携带其中任意一种,单个毒力基因中nelG9(OI-71)检出率最高,为63%;Z4321和Z4326(OI-122)次之,分别为33%和36%;nleC(OI-36)检出率最低,为1%。这2株菌均为人源分离株。
2.2 编码OI的毒力谱分布
编码OI的毒力谱的分布,(a)OI-36有6种毒力谱,其中nleD+nleH1-1组合最多,占40%;(b)OI-57有4种毒力谱,其中nleG2-3+nleG5-2组合最多,占43%;(c)OI-71有11种毒力谱,nleG9最多,占83%;(d)OI-122显示7种毒力谱,其中Z4321最多,占43%。OI-122由位于岛上不同区域的7个标记基因确定,在142株受试菌株中,84株(59%)至少携带1种OI-122毒力基因,9株为eae+。
2.3 编码OI-122毒力基因的模块化分析
OI-122的特定基因PCR扩增结果显示,142株受试菌株中有83株(58%)携带不完整的OI-122,58株携带1种毒力基因,25株携带2种~3种毒力基因,59株(42%)不存在OI-122。模块1、模块2和模块3分别出现在33%、37%和6%的菌株中。
2.4 编码OI毒力基因与eae和stx关系分析
142株受试菌,携带编码OI毒力基因在11种以上(包含11种)的菌株有10株,如表2所示,9株为eae+菌株,其中有6株eae+菌株至少携带14种编码OI毒力基因,且均携带stx1基因,表明编码OI-36、OI-57、OI-71和OI-122的毒力基因与eae+STEC高度相关。
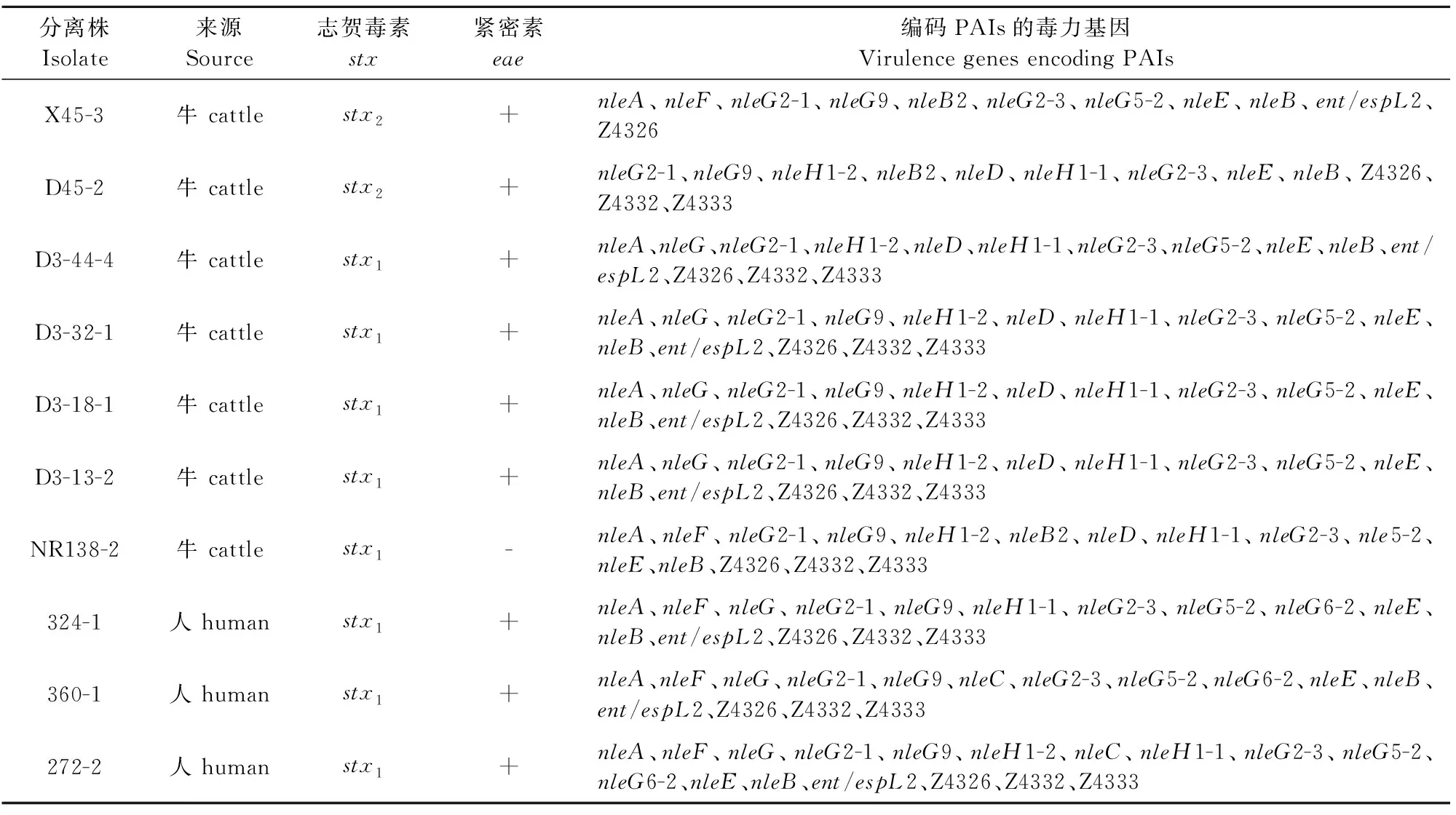
表2 携带11种以上编码OI毒力基因的非O157 STEC
3 讨论
本研究首次在国内牛源和人源非O157 STEC上调查PAIs的分布。单个编码OI毒力基因的检测结果与Soledad-Cadona等的检测结果相比[6],相同之处在于nleC(OI-36)的检出率都很低(分别为1%和2%),本研究中2株携带nleC的STEC来自于人,Soledad-Cadona等检出的4株中有3株也来源于人[6];不同之处在于本研究发现nleG9(OI-71)的检出率最高(63%),而Soledad-Cadona等发现Z4321(OI-122)的检出率最高(61%)[6]。虽然我们了解NleG蛋白为泛素连接酶,但对nleG9的确切功能还不清楚。通过分析每种OI毒力谱分布发现在非O157 STEC中有多种编码OI毒力基因的缺失,这印证了Soledad-Cadona等的假设,PAIs在STEC中可能不稳定[6]。
位于PAIs上的毒力基因可用于识别新出现的致病菌[12,15-16]。已有研究表明,同时检出eae、ent/espL2、nleB、nleE和nleH1-2的STEC菌株对人的毒性更高[11]。nleB和nleE是NF-KB通路的抑制因子,nleB通过阻止免疫调节因子NF-κB易位至细胞核进而抑制宿主细胞的炎症反应,并拮抗死亡受体诱导感染的细胞凋亡[17]。本研究中9株eae+菌株(6株牛源+3株人源)携带了11种及以上编码OI的毒力基因,值得注意的是,eae、ent/espL2、nleB、nleE和nleH1-2同时存在于4株牛源和1株人源STEC菌株中,表明eae+且同时携带多种编码OI毒力基因的非O157 STEC潜在感染人的风险。24株未携带任何被检基因,且均为eae-,表明eae-菌株,似乎更容易缺乏OI基因。
已有研究表明COI-122阳性菌株与HUS暴发相关[10,18-19],LEE的核心区域缺乏可能与移动遗传元件相关,有研究指出OI-122的核心区域包含几个与移动遗传元件相关的基因[14],可能导致OI不如LEE稳定。本研究中142株STEC中均未携带完整的COI-122,可能与其核心区域的遗传元件相关,还需进一步研究确认。
本研究发现PAIs在牛源和人源非O157 STEC上分布不同,PAIs与eae+菌株关系密切。与牛源STEC相比,腹泻患者源STEC携带的编码PAIs的毒力基因更丰富,部分牛源STEC同人源分离株携带同种编码PAIs的毒力基因,提示其潜在感染人的风险。