齿状回未成熟颗粒神经元在氯胺酮快速抗抑郁中作用的最新研究进展
魏 盛,耿希文,赵 峰,李自发,张 浩,胡明会
(山东中医药大学实验中心,济南 250355)
重度抑郁症(major depressive disorder,MDD)已成为威胁人类健康的严重疾病之一,具有高患病率、高复发率、高致残和致死率等特点,被称为“第一心理杀手”。目前的治疗药物主要是选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI),有30%~40%抑郁患者对该类药物治疗不敏感,起效慢,而且精神性不良反应大,部分患者还会产生耐药性,有明显的时间滞后性和低效性[1]。近年来,氯胺酮的快速抗抑郁效果备受人们关注,单次使用氯胺酮就可于数小时内展现出明显的抑郁症状缓解[2]。然而,虽然氯胺酮快速抗抑郁效果理想,临床应用仍面临药物成瘾和不良反应等巨大风险,这与该药物作用机制尚未完全揭示有关。
一直以来,氯胺酮作为一种非竞争性N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体拮抗剂被人们熟知[3]。Yang等[4]和Cui等[5]曾于Nature杂志同刊发文,首次揭示MDD发生与外侧缰核的簇状放电密切相关,而氯胺酮则可通过阻断NMDA受体,直接抑制外侧缰核的这一异常放电而起到快速抗抑郁效应(图1)。但是,仅有少数NMDA受体拮抗剂会产生快速抗抑郁作用,这意味着氯胺酮快速抗抑郁效应背后可能涉及其他未知机制。有报告表明,这可能与氯胺酮的代谢产物参与BDNF、eEF2K、mTOR等细胞信号通路调控密切相关[6-8]。尽管有大量围绕众多分子信号通路和神经环路参与氯胺酮快速抗抑郁机制的工作给出证据,但人们仍未找到脑内参与这一过程的特异性且可靶向调控的细胞群,这使得该药物快速抗抑郁机制的脑区及靶向性细胞种类仍存疑惑。
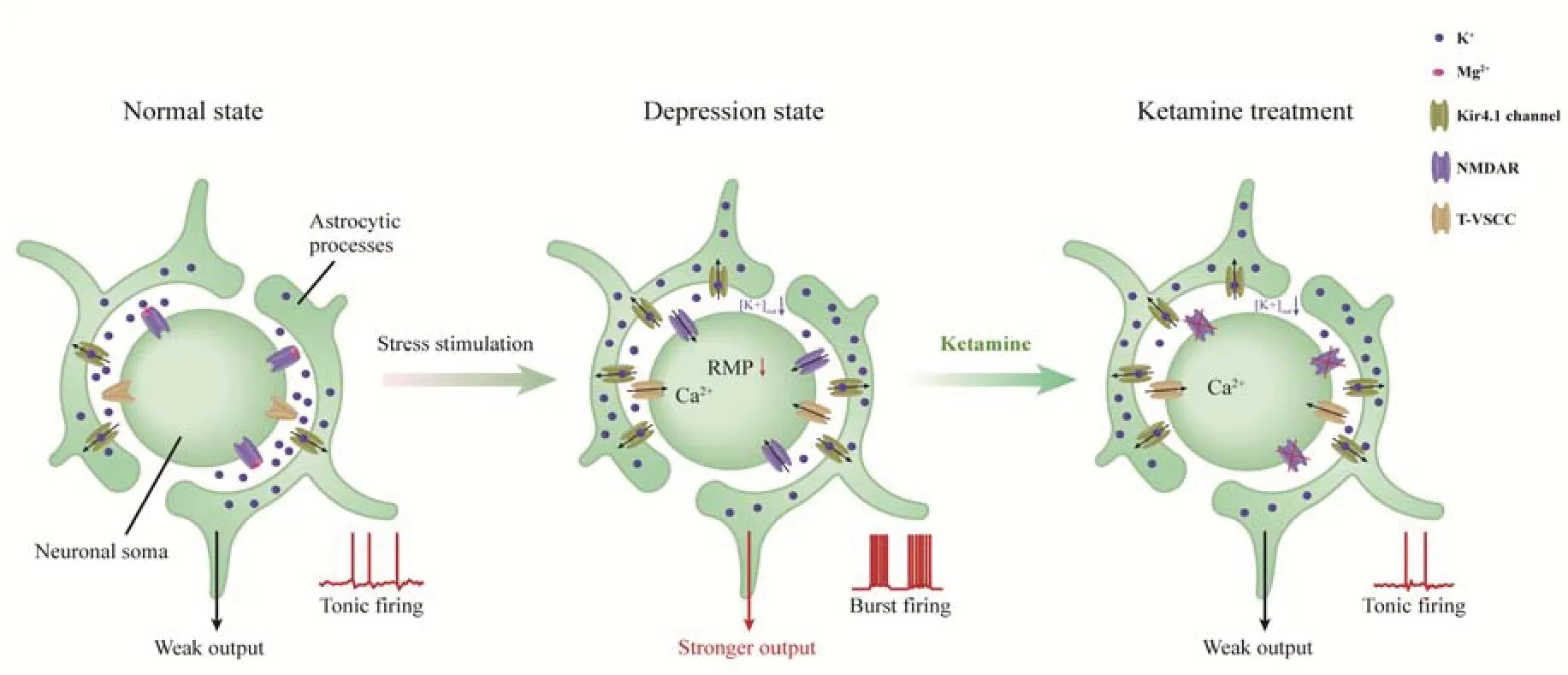
图1 氯胺酮通过阻断NMDA受体抑制外侧僵核簇状放电以发挥快速抗抑郁效应Figure1 Ketamine blocks the function of NMDA receptors,decreases neuronal bursting,and rescues depression-like phenotypes
海马是脑中枢调控精神活动的关键区域,其结构功能异常与MDD具有密切关系。有证据表明传统抗抑郁药物可增加成年海马神经再生,如促进海马颗粒神经元发育,来逆转抑郁状态下异常改变。此外,直接抑制海马神经再生,可阻断抗抑郁药对抑郁模型动物行为异常的改善[9]。然而,生成新的颗粒神经元并整合参与到海马区域的神经环路中往往要花费数周时间,这可能是众多抗抑郁手段起效缓慢的原因之一。以往研究表明,海马齿状回颗粒细胞包括早期颗粒细胞、未成熟颗粒细胞(adult-born immature granule neurons,ABINs)和成熟颗粒细胞。其中,ABINs由于其细胞内在的兴奋性高、突触可塑性强、对外界信息输入的响应程度高等特点,在抑郁症等海马相关的神经系统疾病的研究中备受关注[10]。有证据表明,MDD患者的海马神经发生显著减少,在应用抗抑郁手段治疗之后可恢复正常[11]。此外,值得关注的是,海马齿状回中ABINs的急性激活可从小鼠模型中诱导出快速抗抑郁效果[12],这在一定程度上为研究氯胺酮快速抗抑郁的可能机制提供了线索与启示。
1 文献介绍:氯胺酮通过激活海马未成熟颗粒神经元发挥快速抗抑郁效应
2022年5月Nature Communications杂志发表Rawat等[13]的研究论文,报告小鼠海马齿状回中ABINs的急性激活是氯胺酮快速抗抑郁作用的可能机制(实验设计技术路线见图2)。

图2 Rawat等(2022年)的实验设计技术路线解读示意图Figure 2 Schematic diagram of the experimental design of Rawat et al.(2022)
研究人员首先利用野生型C57BL/6小鼠,通过三箱社交实验和悬尾实验,验证氯胺酮给药对小鼠抑郁样行为及海马依赖社交记忆的作用。表明单次腹腔注射3 mg/kg氯胺酮24 h后,可显著增加小鼠社会交互系数和社交新鲜感并缩短悬尾测试的不动时间。
考虑到海马齿状回是调控社交行为的关键区域,随后研究人员通过免疫荧光染色特异性标记小鼠海马齿状回即刻早期基因cFOS和早期生长应答因子1(early growth response 1,EGR1),验证氯胺酮快速抗抑郁效应是否伴随海马齿状回细胞激活。结果表明,氯胺酮给药分别增加了小鼠海马齿状回cFOS单阳性和EGR1单阳性细胞数量,提示药物作用激活了该脑区神经活动。为明确激活细胞的类型,研究人员又对EGR1阳性细胞进行了再次标记。已知神经元成熟过程中,细胞首先会在神经前体细胞阶段特异性表达神经源性分化因子1(neurogenic differentiate factor 1,NeuroD1)和双皮质素(doublecortin,DCX),随后在神经元阶段特异性表达神经元特异性核蛋白(neuronal nuclei,NeuN),当到达成熟阶段会特异性表达钙结合蛋白(calbindin,Calb),这类蛋白(NeuN和Calb)在未成熟的颗粒细胞是不表达的。基于此,研究人员对上述几种特异性标志物与EGR1蛋白进行了荧光免疫组织化学双标染色,结果显示:几乎所有表达EGR1蛋白的细胞均同时呈现NeuN阳性,且几乎均不表达NeuroD1或DCX。进一步的实验表明,氯胺酮干预可以显著增加EGR+Calb-未成熟神经元的数目,对EGR+Calb+成熟神经元的数目没有明显作用,提示氯胺酮主要激活了齿状回中未成熟神经元而发挥快速抗抑郁作用。
为进一步明确激活神经元所处阶段,研究人员又对海马齿状回区域进行了EGR1和钙网膜蛋白(calretinin,CR)的双标染色。CR是神经元有丝分裂后,表达Calb之前瞬时表达的一种蛋白。结果发现氯胺酮显著增加了EGR1+CR+双阳性细胞数量,而对EGR1+CR-细胞数量没有影响。以上表明,氯胺酮激活的是齿状回中处于表达NeuroD和DCX之后、表达Calb之前的未成熟颗粒神经元,即ABINs。
有研究表明,ABINs的激活可以导致小鼠产生一个显著的、几乎瞬时发生的缓解抑郁/焦虑样行为效应[12]。因此,研究人员假设正是在齿状回观察到的ABINs激活介导了氯胺酮快速抗抑郁效应。为了验证这一假设,利用化学遗传学结合Ascl1-Cre转基因模型小鼠,研究人员选择性地对齿状回区域ABINs进行了抑制。化学遗传学方法通过将hM4Di特异性地表达在齿状回ABINs上,当腹腔注射氯氮平-N-氧化物(clozapine-N-oxide,CNO)后,可以通过启动经典抑制性Gi通路抑制ABINs活动。如前所述,正常动物中,氯胺酮给药可显著提高小鼠的社会交互系数和社交新鲜感并缩短悬尾不动时间,但在接受CNO注射的转基因动物上,由于齿状回区域ABINs的活性受到了抑制,氯胺酮抗抑郁效应被屏蔽。进一步的形态学研究结果表明,氯胺酮并没有影响ABINs总数量,但显著提高了激活的ABINs(EGR1阳性)数量,在CNO的抑制作用下,氯胺酮增加激活ABINs数量的效应也消失了。以上结果表明,沉默海马齿状回的ABINs可显著抑制氯胺酮快速抗抑郁效应,即海马齿状回ABINs的激活是氯胺酮快速抗抑郁的必要条件。
随后,研究人员选择慢性不可预知温和应激制备抑郁症小鼠模型,评价氯胺酮对模型小鼠抑郁样行为快速改善效果,进一步探讨ABINs在这一过程中的作用。结果表明,模型组动物较对照组动物表现出显著抑郁样行为,即社会交互系数和社交新鲜感减少以及悬尾测试不动时间增加,氯胺酮给药逆转了这一行为异常。而应用CNO对ABINs进行特异性抑制,则可阻止氯胺酮改善模型小鼠行为异常的作用。因此,氯胺酮的快速抗抑郁效应依赖海马齿状回ABINs的激活,这在正常动物和抑郁动物上是一致的。
NMDA受体与α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid,AMPA)受体是成熟兴奋性神经元上的两种主要离子型谷氨酸受体,它们与离子通道耦联,形成受体通道复合物,参与介导多项神经生理功能。NMDA受体通过受体本身、其共轭的离子通道以及调节部位这三个部分形成的复合体而发挥功能,对钙离子高度通透;AMPA受体则对钠离子和钾离子的通透性强。研究表明,NMDA和AMPA受体均参与MDD的发病以及抗抑郁药物的作用机制[14]。包括氯胺酮在内的多种NMDA拮抗剂被证实具有显著的抗抑郁作用[2]。亦有研究表明,AMPA受体参与氯胺酮快速抗抑郁机制,抑制AMPA受体可屏蔽氯胺酮的快速抗抑郁效应[15]。为了验证ABINs激活是否整合到上述AMPA受体相关的氯胺酮作用机制,研究人员探查了抑制AMPA受体是否可以阻断氯胺酮对ABINs的激活及其介导行为效应。与以往大量研究结果一致,当给予小鼠AMPA受体拮抗剂NBQX后,氯胺酮的快速抗抑郁效应被明显阻断。此外,NBQX也阻断了氯胺酮增加EGR+Calb-细胞数量的效果。以上证据表明,氯胺酮通过激活ABINs发挥快速抗抑郁效应是依赖AMPA受体实现的。
对ABINs激活在氯胺酮快速抗抑郁中作用进行必要性验证后,研究人员又进行了充分性验证。研究人员将hM3Dq特异性表达在齿状回ABINs上,当腹腔注射CNO后,可以通过激活Gq通路提高细胞活性。应用慢性不可预知温和应激制备抑郁症模型小鼠后,分别予CNO和氯胺酮给药,结果表明,CNO激活齿状回ABINs 24 h后,产生了与氯胺酮给药类似的快速抗抑郁效应,表现为小鼠的社会交互系数和社交新鲜感增加以及悬尾不动时间缩短。进一步的形态学证据表明,CNO和氯胺酮给药均可增加齿状回区域激活的ABINs(EGR1+)数量。以上证据表明,直接激活海马齿状回的ABINs可模拟氯胺酮的快速抗抑郁效应,即激活海马齿状回ABINs是氯胺酮快速抗抑郁的充分条件。
2 文献结果点评
Rawat等[13]的研究采用免疫荧光染色和化学遗传学方法,通过正向/反向验证,分别对海马齿状回中的ABINs进行了特异性抑制和激活,证明齿状回ABINs的激活是氯胺酮发挥快速抗抑郁效应的关键机制,且进一步的证据表明,上述作用是依赖于AMPA受体介导实现。
众所周知,氯胺酮可发挥显著的快速抗抑郁效应,但单次给药的药效消退后,反复氯胺酮用药极易引起药物成瘾和不良反应[16]。药物进入体内后无差别作用于广泛脑区,既能产生治疗作用,也能带来不良反应。因此,进一步探查药物作用的脑区和细胞类型,从而进行特异性靶向用药,可能是消除氯胺酮不良反应的可行途径之一。Rawat等[13]的研究从ABINs这一视角揭示了氯胺酮快速抗抑郁机制,锁定了其作用的特定脑区和细胞类型,有助于围绕该特定靶点开发新型快速抗抑郁药物。
在Rawat等[13]的研究中,利用化学遗传学特异性激活/抑制ABINs为探查该类神经元的作用提供了强大方法学支撑。hM4Di和hM3Dq在ABINs中的特异性表达,使得调控该类神经元的活动成为可能,且补充实验中证实这一特异性的操控并未对神经再生和固有ABINs数量造成影响,排除了可能的干扰因素,使得其方法学体系更为严谨可信。利用化学遗传学手段,Rawat等[13]通过正向抑制/反向激活的充分必要验证,证实了海马齿状回ABINs的激活参与氯胺酮快速抗抑郁机制,结合进一步的药理学方法,发现了该作用依赖于AMPA受体的参与。然而,也有大量报告证实其他类型AMPA受体激动剂也可发挥抗抑郁效应[17],但其作用有效性远不及氯胺酮。因此,笔者认为应当通过进一步的实验验证氯胺酮是否也靶向其他脑区的AMPA受体,或同时作用于其他相关靶点,从而发挥快速抗抑郁效应。
以往研究中,关于氯胺酮快速抗抑郁机制的假说大多关于NMDA受体,该假说认为氯胺酮对于该受体的竞争性抑制作用是介导其快速抗抑郁效果的关键,这在啮齿类动物模型为研究对象的实验中已经得到了证实。当氯胺酮选择性阻断NMDA受体对γ-氨基丁酸能神经元的作用后,会导致锥体神经元产生去抑制和谷氨酸爆发,继而导致AMPA受体活性增强,BDNF释放增多,TrkB激活等后续细胞内级联反应[6]。也有证据表明,氯胺酮阻断NMDA受体后,可以导致eEF2去磷酸化,也可导致AMPA受体活性的增强[7]。Rawat等[13]的研究证实,氯胺酮可以激活ABINs,且该过程依赖AMPA受体的参与,这与以往报告一致。
成年人海马区域的神经元是否可以再生?这一问题是神经科学家们一直争论的焦点。但亦有大量证据表明海马区域有神经新生,且DCX阳性细胞即可在一定程度上被认为是新生细胞。海马神经新生被广泛证实参与记忆、认知和情绪等多种生理机能。有研究指出,激活海马内的新生神经元可以直接发挥抗抑郁/焦虑效应[12]。这也证实,海马神经新生高度参与抑郁情绪调控,并且可能是抗抑郁药物的潜在靶点,这一过程可能包括神经前体细胞、未成熟颗粒细胞、成熟神经元等在内的多个环节。Rawat等[13]研究发现氯胺酮可以直接激活DCX阳性细胞,进一步的证据表明氯胺酮是激活了ABINs,从而发挥快速抗抑郁作用。这与上述海马神经新生在抑郁/抗抑郁治疗中的相关性相吻合。此外,在Rawat等[13]的研究中,对于抑郁样行为的评价主要采用了小鼠社会交互实验和悬尾实验。社会交互实验主要用于评价动物对外界环境或个体的探索倾向,而悬尾实验则通过评价其“行为绝望”状态而反应抑郁情绪的程度,均未涉及对抑郁症核心症状“快感缺失(Anhedonia)”的评价,造成模型表面效度不佳,和临床原型差距较大,说服力不足。因此笔者建议行为检测中引入如糖水偏好、喷糖实验、雌性尿液嗅探等一种或几种测试方法,可更为全面地评价模型行为表型及抗抑郁药效。
3 研究展望
近年来,关于氯胺酮快速抗抑郁机制的研究不胜枚举,有多种细胞信号通路被证实参与这一过程[6-8],且随着神经环路记录、鉴定及示踪技术的发展,氯胺酮快速抗抑郁的神经环路机制也逐渐被揭示[18](图3)。大量文献证据表明,海马是氯胺酮快速抗抑郁的作用脑区,但除海马外,其他多个脑区也参与了氯胺酮的药效过程。神经发生是指由神经干细胞产生神经元的过程,成年个体神经发生有比较活跃的两个区域:一个是侧脑室的脑室下区,新生神经元由此处生成并迁移至嗅球或者纹状体;另一重要区域是海马齿状回。成年哺乳动物的海马区域中的神经发生是由活化神经干细胞增殖产生子代,包括神经前体细胞,进一步分裂成为未成熟的齿状回颗粒神经元,整合到局部神经环路当中。即未成熟的齿状回颗粒神经元与CA1和CA3的锥体神经元三者形成三突触回路,信息由内嗅皮层到达齿状回,然后通过颗粒细胞到达CA3锥体细胞,再从CA3区神经元投射到CA1锥体细胞,最后再返回内嗅皮层[19-20]。此外,近年有学者指出,ABINs可通过谷氨酸能投射作用于γ-氨基丁酸能神经元,而抑制成熟颗粒细胞的活性[21]。因此,在Rawat等[13]的研究结论基础上,可结合环路示踪和鉴定技术进一步明确海马齿状回ABINs的上/下游投射是否参与了氯胺酮快速抗抑郁机制。神经环路方面近年来多个课题组工作表明,内侧前额叶皮质与脑内多个部位的投射广泛参与到氯胺酮的快速抗抑郁作用中[22]。Rawat等[13]所揭示的海马齿状回区域与包括内侧前额叶皮质在内的多个脑区存在密切的纤维投射联系,综合利用先进的在体/离体神经环路鉴定技术,如光/化学遗传操控、膜片钳记录、神经示踪、光纤记录、超微显微成像、双光子观测、功能磁共振检测等,结合药理学及分子生物学手段,围绕齿状回及其相关联脑区的神经环路在氯胺酮快速抗抑郁中的机制展开广泛且深入的研究,将为药物作用靶点的揭示提供更为充足的实验证据。
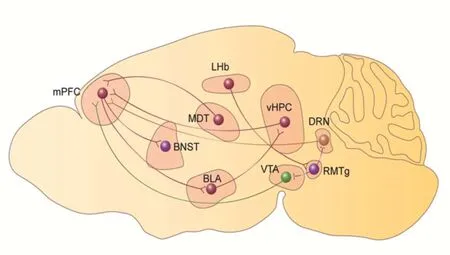
图3 氯胺酮快速抗抑郁的神经环路机制示意图Figure 3 Neural circuits involved in the antidepressant actions of ketamine
笔者所在课题组一直从事抑郁症发生及药物干预的分子及神经环路机制研究,已经围绕内侧前额叶皮质在抑郁症发生机制中的作用展开了系列工作(结果尚待发表)。笔者课题组前期工作证实,内侧前额叶皮质中γ-氨基丁酸能中间神经元对锥体神经元的过度抑制作用是抑郁症发生的可能机制,而快速抗抑郁药物可使中间神经元抑制功能发生短暂降低,γ-氨基丁酸合成减少,从而产生去抑制作用,进而发挥抗抑郁药效。此外,利用光纤钙信号记录及超微显微成像技术,课题组前期实验观测到内侧前额叶皮质γ-氨基丁酸能神经元在抑郁样行为发生过程中伴随显著的神经钙活动变化,而抗抑郁药干预可有效逆转上述变化,进一步提示该脑区γ-氨基丁酸能神经元与抑郁症发生及抗抑郁药作用密切相关。
如上所述,内侧前额叶皮质与海马区域存在广泛纤维投射联系,内侧前额叶皮质中γ-氨基丁酸能神经元介导的去抑制是否可通过传出投射作用于海马神经元,进而调控抑郁症发生?内侧前额叶皮质中γ-氨基丁酸能神经元的改变是否由海马向其发出的上游投射参与介导?接下来,笔者课题组将围绕上述科学问题,进一步探索内侧前额叶皮质与海马间神经环路在抑郁症发生及抗抑郁药作用中的机制。
另外,Rawat等[13]的研究表明,齿状回ABINs的激活参与了氯胺酮的快速抗抑郁机制,并且排除了神经再生即固有ABINs数量与这一过程的关联,证实氯胺酮的快速抗抑郁作用是通过激活ABINs即可起效而不必依赖神经再生介导。然而,有大量证据表明,海马神经元的突触可塑性与氯胺酮的持续抗抑郁作用具有密切联系[23]。我们有理由推测,氯胺酮的持续抗抑郁作用可能与神经再生密切相关,而海马齿状回可能是氯胺酮发挥快速且持续抗抑郁效应的共有靶向区域;围绕该问题开展进一步的系统性实验验证,对揭示氯胺酮起效的更广泛机制,进而开发针对性治疗药物,具有重大意义。
虽然各国食品药品监督管理部门已经批准氯胺酮作为重度抑郁症治疗药物使用,近年来也有药物研发企业针对该药物开发不同新剂型投入使用,但面临的成瘾、不良反应等风险一直是制约氯胺酮在临床广泛应用的棘手问题。进一步深入揭示氯胺酮的可能作用靶点,围绕相关靶点开展针对性治疗药物开发,是目前亟待解决的共识性问题。
[作者贡献Author Contribution]
魏盛撰写和修改文稿;耿希文撰写文稿;赵峰作图并修改文稿;李自发修改文稿;张浩检索文献并作图;胡明会检索文献。
[利益声明Declaration of Interest]
所有作者均声明本文不存在利益冲突。

