转化生长因子β调节子4对人肺鳞状细胞癌类器官增殖、侵袭和转移的影响
王安生,王祖义,郑传明,陈娜娜,李 伟,洪海宁,4 ,桑海威 ,王康武 ,李其才,陈力维,朱浩楠,5
(1.蚌埠医学院第一附属医院胸外科,安徽 蚌埠 233004;2.蚌埠医学院第一附属医院急诊外科,安徽 蚌埠 233004;3.蚌埠医学院第一附属医院呼吸病科,安徽 蚌埠 233004;4.蚌埠医学院研究生院,安徽 蚌埠 233030;5.阜阳市人民医院胸外科,安徽 阜阳 236012)
肺癌作为全球最常见的恶性肿瘤,其病死率一直位于肿瘤相关病死率的首位。据报道,2018年肺癌的发生率占全部恶性肿瘤的15%左右,肺癌的死亡比例占全部恶性肿瘤死亡病例的25%左右[1]。尽管靶向治疗和免疫治疗相关的新药研发提高了肺癌的总体生存期(overall survival,OS),但2012~2015年中国的肺癌患者5 a存活率仍仅为19.7%,其中农村地区患者5 a生存率仅为15.4%[2],而预计肺癌仍会是未来10年病死率最高的肿瘤之一。有研究报道,肺癌的发生是由众多基因的突变引起的,包括上皮生长因子细胞增殖和信号传导的受体基因、鼠类肉瘤病毒癌基因、p53和磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)基因等基因,但肺癌发生的具体机制尚不完全清楚,值得深入探讨[3]。
原始干细胞或成体干细胞在体外3D环境下培养形成类器官模型,是最近新兴起来的体外模型,其在结构和功能上与成体组织高度接近[4]。类器官模型弥补了细胞系和小鼠品系等传统模型存在细胞系细胞类型单一和某些小鼠品系胚胎容易致死等问题[5]。肺癌类器官是收集患者手术切除的癌组织,然后进行消化分离出肿瘤细胞,紧接着进行3D细胞培养,使得肿瘤细胞形成“微器官”。与传统的肿瘤细胞系相比,该模型的优点是具有更高的临床相关性和个体多样性。
转化生长因子β调节子4(transforming growth factor β regulator 4,TBRG4)是编码转化生长因子-β(transforming growth factor-β,TGF-β)的调节子。近年来越来越多的研究发现,TBRG4的异常高表达与肿瘤的发生、发展密切相关[6],但其在肺癌中的作用尚未阐明。因此,本研究采用沉默TBRG4的慢病毒转染人肺鳞状细胞癌类器官观察TBRG4是否通过PTEN/磷脂酰肌醇激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路调节人肺鳞状细胞癌类器官增殖、侵袭和迁移等生物学行为,为初步探讨TBRG4基因作为治疗肺鳞状细胞癌的可能潜在靶点提供实验基础。
1 材料与方法
1.1 主要试剂与仪器TBRG4沉默慢病毒购自汉恒生物科技(上海)有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海贝博生物有限公司,小鼠抗β-actin抗体、兔抗增殖细胞核抗体(proliferating cell nuclear antibody,PCNA)、兔抗PTEN抗体、兔抗磷酸化PI3K (phosphorylated PI3K,p-PI3K)抗体以及兔抗磷酸化AKT(phosphorylated PI3K,p-AKT)抗体均购自英国Abcam公司,所有抗体稀释比例均为11 000;双面超净操作台购自苏州净化设备有限公司,冷冻离心机购自德国Beckman公司;光学显微镜购自重庆光电仪器厂,电热恒温水浴锅购自北京医疗设备厂,低速大容量离心机购自上海安亭科学仪器厂,小型固定转速离心机购自美国SCILOGEX公司,立式压力蒸汽灭菌器购自上海博讯实业有限公司医疗设备厂,电热鼓风干燥箱购自上海市实验仪器总厂,Millipore实验室纯水机购自美国Pall公司,-80 ℃超低温冰箱购自日本三洋公司,CO2细胞培养箱、酶标仪购自美国Thermo Scientific公司,恒温多功能振荡器购自美国HRYSTAL公司,旋涡混合器购自邯郸天仪电子仪表有限公司,电子分析天平购自上海精科天平厂,移液器购自法国PIPETMAN公司,PowerPac TM Basic电泳仪电源、垂直电泳槽购自美国Bio-Rad公司,化学发光成像系统购自北京天伦生物科技有限公司。
1.2 Western blot法检测人肺鳞状细胞癌患者癌组织和癌旁组织中TBRG4蛋白表达收集2020年1月至2021年1月蚌埠医学院第一附属医院手术切除的早期肺鳞状细胞癌患者癌组织和癌旁组织(距病灶>5 cm以上的正常肺组织),置于-80 ℃ 冰箱冻存以供后续研究使用。取1 g冻存的癌组织和癌旁组织加入1 mL裂解液[苯甲基磺酰氟/RIPA裂解液(RIPA Lysis Buffer)],使用前加入2 μL蛋白酶抑制剂与5 μL磷酸酶抑制剂Cocktail(2×)混合,用研磨器充分研磨组织,置于冰盒上,震摇裂解约15 min后,于4 ℃下14 000×g离心15 min,用移液器吸出上清液保存于新的离心管中,将其置入-80 ℃冰箱保存备用。紧接着用二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒测定蛋白浓度,调整蛋白浓度。取30 μg等量蛋白上样,聚丙烯酰胺凝胶电泳分析细胞蛋白后,进行常规湿法转膜。用50 g·L-1脱脂牛奶在室温条件下封闭膜 1 h,然后加入一抗稀释液4 ℃ 孵育过夜。用含吐温-20的 Tris缓冲盐溶液(Tris-buffered saline and Tween-20,TBST)洗膜后,加入二抗稀释液室温孵育1 h。洗膜后进行化学发光显色。以β-actin作为内参对照,应用Image J软件对目的蛋白的表达进行量化。
1.3 人肺鳞状细胞癌肿瘤细胞的分离及体外类器官培养将收集的癌组织标本冰上切割成直径约4 mm的组织块,用提前预冷的磷酸盐缓冲液(phosphate-buffered saline,PBS)冲洗干净。然后用胶原酶消化组织1 h,用胰蛋白酶TrypLE Express在37 ℃条件下轻微振荡消化10 min,最后形成的单细胞悬液既分离得到的肿瘤细胞。用细胞计数仪对单细胞悬液进行计数,调节细胞密度为1×107L-1,然后将细胞和基质胶均匀混合后重悬,最后按照每孔 50 μL 细胞接种于24孔板中形成基质胶凝固液滴,将其放置于37 ℃培养箱中固化10~20 min。每孔中加入500 μL肺鳞状细胞癌类器官条件培养基,使其完全淹没基质胶凝固液滴,最后置于37 ℃、含体积分数5% CO2培养箱中培养48 h。所有与获取人肺鳞状细胞癌标本相关的实验程序均在蚌埠医学院第一附属医院伦理委员会的监督和指导下完成,符合医学伦理要求。获取人肺鳞状细胞癌标本已获得患者知情同意。
1.4 慢病毒转染人肺鳞状细胞癌类器官将培养的人肺鳞状细胞癌类器官分为对照组和TBRG4沉默组。对照组类器官转染空载体慢病毒,TBRG4沉默组类器官转染TBRG4沉默慢病毒,具体方法为:将含有慢病毒的肺癌类器官培养基与人肺鳞状细胞癌组织单细胞悬液均匀混合,然后将其接种于48孔板中,用封口膜密封48孔板,32 ℃下2 000 r·min-1离心1 h,然后继续培养6 h。最后按照“1.3”项所述方法对细胞进行肺鳞状细胞癌类器官培养。72 h后用荧光显微镜观察TBRG4在肺鳞状细胞癌类器官中的沉默效率,培养2代后即可获得稳定沉默目的基因的肺鳞状细胞癌类器官。
1.5 CCK-8法检测人肺鳞状细胞癌类器官增殖活力取对照组和TBRG4沉默组类器官消化制备单细胞悬液,按每孔1 500个细胞接种到96孔板进行培养。对照组和TBRG4沉默组各铺9个孔。分别在转染24、48、72、96 h时,每孔加10 μL CCK-8试剂,继续培养2 h,应用酶标仪检测450 nm波长处各孔的吸光度值,绘制细胞活力曲线。每组设3个复孔,实验重复3次,取均值。
1.6 Transwell法检测人肺鳞状细胞癌类器官的迁移和侵袭能力取2组转染慢病毒后的人肺鳞癌类器官,消化制备单细胞悬液。将Transwell小室置于24孔板中。侵袭实验前,取50 μL(18稀释)基质胶铺于小室内,4 ℃凝固后备用。迁移实验无需铺胶。收集转染48 h的各组细胞,消化后制成3×108L-1的细胞悬液。向小室上室内加入200 μL的细胞悬液,下室加入500 μL的含20%血清的培养基,将含有小室的24孔板置于细胞培养箱常规培养24 h。取出小室,擦去上室面未过膜细胞,甲醇固定下室面15 min,结晶紫染色后置于显微镜下观察并拍照,计算穿膜细胞数。每组设置3个复孔,实验重复3次。
1.7 Western blot法检测人肺鳞癌类器官TBRG4、PCNA、PTEN、p-PI3K、p-AKT蛋白表达取2组转染慢病毒后的人肺鳞癌类器官,消化制备单细胞悬液,收集细胞加入RIPA裂解15 min后提取细胞蛋白。用BCA蛋白定量试剂盒测定蛋白浓度,调整蛋白浓度。取30 μg等量蛋白上样,聚丙烯酰胺凝胶电泳分析细胞蛋白后,进行常规湿法转膜。50 g·L-1脱脂牛奶室温下封闭膜1 h,然后加入TBRG4、PCNA、PTEN、p-PI3K、p-AKT一抗稀释液4 ℃ 孵育过夜。用TBST缓冲液洗膜后,加入二抗稀释液室温孵育1 h。洗膜后进行化学发光显色。以β-actin作为内参对照,应用Image J软件对目的蛋白进行量化,分析其表达水平。
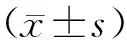
2 结果
2.1 肺鳞状细胞癌组织和癌旁组织中TBRG4蛋白表达比较结果见图1。肺鳞状细胞癌组织和癌旁组织中TBRG4蛋白的相对表达量分别为0.98±0.04、0.50±0.12,肺鳞状细胞癌组织中TBRG4蛋白相对表达量显著高于癌旁组织,差异有统计学意义(t=3.120,P<0.05)。
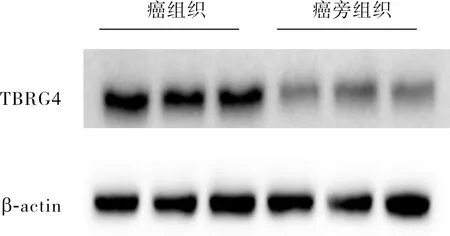
图1 肺鳞状细胞癌组织和癌旁组织中TBRG4蛋白的表达
2.2 对照组和TBRG4 沉默组人肺鳞状细胞癌类器官增殖活力比较结果见表1。 TBRG4沉默组人肺鳞状细胞癌类器官在转染24、48、72、96 h时的增殖活力均显著高于对照组,差异有统计学意义(P<0.05)。

表1 对照组和TBRG4 沉默组人肺鳞状细胞癌类器官增殖活力比较
2.3 对照组与TBRG4沉默组人肺鳞状细胞癌类器官的迁移和侵袭能力比较结果见图2。TBRG4沉默组、对照组穿膜细胞数分别为(46.73±8.26)、(148.72±11.90)个,迁移细胞数分别为(38.64±7.92)、(178.53±10.87)个;TBRG4沉默组穿膜细胞和迁移细胞数均显著少于对照组,差异有统计学意义(t=-8.220、-10.518,P<0.05)。

图2 2组人肺鳞状细胞癌类器官的侵袭和迁移情况
2.4 对照组和TBRG4沉默组人肺鳞状细胞癌类器官中TBRG4和PCNA蛋白表达的比较结果见图3和图4。TBRG4沉默组和对照组人肺鳞状细胞癌类器官中TBRG4蛋白的相对表达量分别为0.16±0.12、0.63±0.02,PCNA蛋白的相对表达量分别为0.530±0.243、1.390±0.560;TBRG4沉默组人肺鳞状细胞癌类器官中TBRG4、PCNA蛋白的相对表达量均显著低于对照组,差异有统计学意义(t=-3.214、-4.324,P<0.05)。
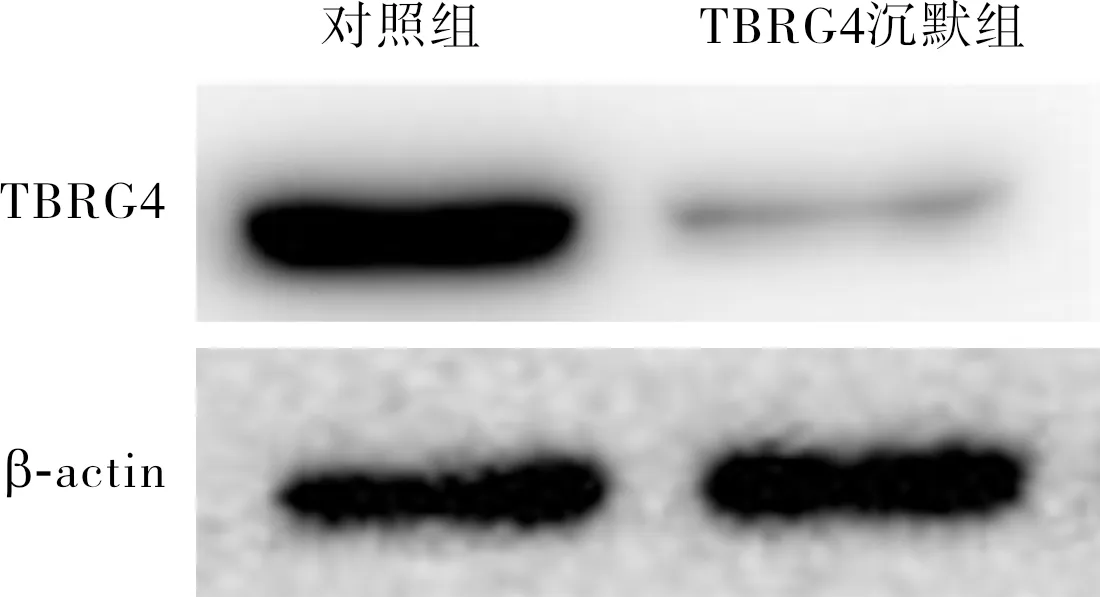
图3 对照组和TBRG4沉默组人肺鳞状细胞癌类器官中TBRG4蛋白的表达

图4 对照组和TBRG4沉默组人肺鳞状细胞癌类器官中PCNA蛋白的表达
2.5 对照组与TBRG4沉默组人肺鳞状细胞癌类器官中 PTEN、p-PI3K、p-AKT相对表达量比较结果见表2和图5。TBRG4沉默组人肺鳞状细胞癌类器官中PTEN蛋白的相对表达量显著高于对照组,p-PI3K、p-AKT蛋白的相对表达量显著低于对照组,差异有统计学意义(P<0.05)。

表2 对照组和TBRG4沉默组人肺鳞状细胞癌类器官中PTEN、p-PI3K、p-AKT蛋白相对表达量比较
3 讨论
使用靶向药物治疗肺癌可以提高部分临床患者的生存率[7],但耐药性和药物不良反应的存在仍然限制了其使用,患者的生存率仍较低,不超过15%[8]。基于此,深入研究肺癌发生发展的新机制和关键分子具有重要意义。小干扰RNA沉默技术是一种主要通过外源性小分子干扰RNA或内源性小分子RNA沉默靶基因的调控方法[9]。慢病毒载体具有低免疫原性,能转染细胞并将携带的外源基因片段整合到宿主基因组中,因此,在基因工程中得到广泛应用[10-11]。
TBRG4是位于7号染色体上可以编码TGF-β调节子的基因。有研究报道,TBRG4不仅可以参与细胞周期调控,还可以维持细胞的稳定性[12]。张伟[13]研究表明,TBRG4可能通过调节线粒体mRNA的稳定性和细胞周期蛋白CLN1和CLN2的转录来调节细胞增殖。此外,TBRG4蛋白在多发性骨髓瘤患者髓外肿瘤组织[14]、原代乳腺癌细胞中[15]异常高表达,且其表达水平与乳腺癌的恶性程度呈正相关[15]。目前,成体组织来源的干细胞培养的类器官发展较为迅速,正逐渐成为研究疾病发生发展的良好模型。基于此,本研究采用沉默TBRG4基因的慢病毒对人肺鳞状细胞癌类器官进行特异性干扰,以期探索TBRG4对肺癌生物学行为的影响。本研究结果显示,沉默TBRG4基因能够抑制人肺鳞状细胞癌类器官的增殖,这表明TBRG4可以在体外抑制肺癌增殖;此外,沉默TBRG4基因还能够抑制人肺鳞状细胞癌类器官的侵袭和迁移能力。
PTEN具有脂质和蛋白的双重特异性磷酸酶活性,是继p53之后第2个被发现的抑癌基因。PTEN发挥作用的主要方式是调控多种信号通路,以此达到抑制肿瘤细胞增殖、转移、黏附,促进肿瘤细胞分化、凋亡等目的[16]。研究发现,PTEN低表达是促进非小细胞肺癌发生和转移的原因[17-18]。本研究结果表明,TBRG4基因敲低可能通过激活人肺鳞状细胞癌类器官中PTEN的表达,进而下调p-PI3K、p-AKT等下游基因的表达,从而发挥抑制人肺鳞状细胞癌类器官增殖、侵袭和迁移的作用。
综上所述,TBRG4可能成为肺癌的潜在治疗靶点,在调节肺癌的增殖、侵袭和迁移等方面发挥重要的作用,但其具体调节机制有待进一步深入研究。

