慢性阻塞性肺疾病患者外周血单个核细胞中S100A10表达及意义
宋亚茹,李荣凯,翟成凯,韩 飞,娄运伟,王 辉
(1.新乡医学院附属人民医院呼吸与危重症医学科二病区,河南 新乡 453000;2.新乡医学院医学检验学院,河南 新乡 453003;3.河南省免疫与靶向药物重点实验室,河南 新乡 453003)
慢性阻塞性肺疾病 (chronic obstructive pulmonary disease,COPD)是指肺功能持续性下降的慢性呼吸系统疾病,其发病机制复杂,与环境因素、遗传因素密切相关。免疫和炎症介质在COPD致病过程中发挥重要作用[1-2],如外周血中白细胞介素(interleukin,IL)-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等细胞因子水平和淋巴细胞亚群水平与COPD病情的严重程度密切相关[3-4]。S100蛋白是一类多功能的小分子Ca2+结合蛋白家族,S100A10是该蛋白家族的一个成员,S100A10缺乏EF-hand Ca2+结合结构域[5-7]。S100A10是由2个相对分子质量为11 000的亚单位组成的二聚体,属于胞内蛋白,当其与配体Annexin A2结合后,以(S100A10)2-(Annexin A2)2四聚体的形式存在于细胞膜上,是纤溶酶原的受体[7-8]。已有研究表明,S100A10在多种炎症相关疾病患者如抗磷脂综合征、系统性红斑狼疮和多种肿瘤组织中呈异常表达[9-11]。S100A10通过调节纤维蛋白酶的产生和基质金属蛋白酶9的活性调节巨噬细胞和中性粒细胞向炎症部位的迁移,S100A10还可通过影响肿瘤相关巨噬细胞向肿瘤组织的浸润来参与肿瘤的进程[12-13]。最近研究发现,S100A10在Toll样受体信号转导和抗感染免疫过程中发挥重要作用,如S100A10基因缺陷的巨噬细胞过度活化,分泌更多的TNF-α、IL-6、IL-12和 干扰素-β等细胞因子,提示在免疫应答过程中S100A10可抑制多种促炎细胞因子的产生[14]。但S100A10在COPD患者中的表达变化未见报道,S100A10在COPD进程发挥的作用仍不清楚。基于此,本研究通过比较健康对照者和COPD患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中S100A10的表达变化,分析其表达水平与肺功能相关指标的相关性,探讨S100A10在COPD疾病过程中的潜在作用,以期为S100A10在临床COPD诊疗中的应用提供实验依据。
1 资料与方法
1.1 一般资料选择2020年8月至2021年6月新乡医学院附属人民医院呼吸与危重症医学科收治的42例COPD患者为研究对象,其中男29例,女13例;年龄42~78(62.43±2.09)岁。病例纳入标准:(1)符合中华医学会呼吸病学分会慢性阻塞性肺疾病学组制定的COPD诊断标准[15];(2)首次被诊断为COPD;(3)至少0.5 a内未服用过免疫调节剂和激素制剂;(4)意识清晰,主动配合;(5)患者同意加入本研究。排除标准:(1)有支气管哮喘、间质性肺纤维化和肺癌等其他呼吸系统疾病史;(2)合并除呼吸系统疾病以外的其他脏器严重功能障碍者,如罹患严重心血管疾病、肝肾疾病和严重自身免疫性疾病的患者;(3)患有精神类疾病,存在交流障碍和认知障碍的患者。选择同期在新乡医学院附属人民医院体检中心体检的健康志愿者31例为对照组,其中男20例,女11例;年龄37~76(61.51±1.78)岁。2组受试者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究获得新乡医学院附属人民医院伦理委员会审核批准(批准文号:2020072001),受试者均知情并签署知情同意书。
1.2 方法
1.2.1 体质量指数(body mass index,BMI)、吸烟指数检测患者入院后,应用医用身高体重测量仪测量患者身高和体质量,并计算BMI[体质量(kg)/身高(m)2];通过询问病史,记录患者的吸烟情况,并计算吸烟指数(每天吸烟支数×吸烟年数)。
1.2.2 肺功能测定2组受试者休息30 min后,应用RSF900肺功能检测仪(德国耶格公司)检测第1秒用力呼气容积(forced expiratory volume in one second,FEV1)占预计值的百分比(FEV1%pred)和FEV1占用力肺活量(forced vital capacity,FVC)的百分比(FEV1/FVC)等肺功能指标。
1.2.3 血液采集及PBMC分离2组受试者均于清晨抽取空腹外周静脉血3 mL,置于乙二胺四乙酸抗凝管中,在超净台中无菌操作下采用Ficoll密度梯度离心法分离获取PBMC。
1.2.4 实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)检测PBMC中S100A10 mRNA表达取2组受试者PBMC,向PBMC中加入1 mL 细胞RNA提取液(RNAiso Plus,购自日本TaKaRa公司)裂解细胞。室温静置5 min,然后加入0.2 mL氯仿,震荡15 s,室温静置3 min,4 ℃ 12 000 r·min-1离心10 min,取上层水相置于新EP管中,加入0.5 mL异丙醇,室温放置10 min,4 ℃ 12 000 r·min-1离心10 min,弃上清,加入1 mL 体积分数为75%的乙醇进行洗涤,涡旋混合,4 ℃12 000 r·min-1离心5 min,弃上清,然后加入50 μL无RNA酶的去离子水溶解RNA沉淀。用分光光度计测定RNA浓度,应用RT Master mix反转录试剂盒(日本TaKaRa公司)将细胞总RNA反转录成cDNA。以反转录的cDNA为模板,以β-actin为内参使用TB Green Premix Ex Taq II试剂盒(日本TaKaRa公司)进行实时荧光定量PCR。引物序列(由苏州金唯智生物科技有限公司合成):S100A10正义链为5′-CCAGGTTTCGACAGACTCTTC-3′,反义链为5′-CCGTTCCATGAGCACTCTC-3′,扩增长度为135 bp;内参β-actin 正义链为5′-GGAAATCGTGCGTGACATTAA-3′,反义链为5′-AGGAAGGAAGGCTGGAAGAG-3′,扩增长度189 bp。反应程序为:95 ℃预变性3 min,95 ℃变性10 s,60 ℃退火30 s,共40个循环。每份标本的S100A10和内参均做3个复孔,复孔之间的Ct值误差控制在0.5以内,采用2-ΔΔCt法计算S100A10基因的相对表达量。
1.2.5 Western blot法检测PBMC中S100A10蛋白表达取2组受试者的PBMC,每份样品中加入100 μL放射免疫沉淀( radio-immunoprecipitation,RIPA) 蛋白裂解液(上海碧云天生物技术公司)和蛋白酶抑制剂的混合液,冰上裂解30 min,4 ℃下12 000 r·min-1离心15 min后取上清液,采用二喹啉甲酸法测定上清液蛋白浓度(二喹啉甲酸检测试剂盒购自上海碧云天生物技术公司)。在剩余样品中加入适量体积的5×蛋白 loading buffer,100 ℃加热10 min,将这些蛋白样品保存在-20 ℃冰箱。取15 μg 蛋白样品进行十二烷基硫 酸 钠 聚 丙 烯 酰 胺凝胶电泳后转移到聚偏二氟乙烯膜上,加入体积分数5%脱脂奶粉室温封闭1 h,加入S100A10抗体(滴度11 000)和β-actin 抗体(滴度11 000),4 ℃孵育过夜,次日洗膜后加入相应种属的HRP标记的二抗(滴度15 000),室温孵育 1 h,然后滴加电化学发光液染色,应用Amersham Imager 600RGB仪器曝光显色并进行图像采集,使用Image J图像分析软件分析条带的灰度值,目的蛋白的相对表达量以目的蛋白灰度值与内参蛋白灰度值的比值表示。
1.2.6 流式细胞术检测PBMC细胞亚群中S100A10的表达将收集的健康对照组和COPD组的PBMC保存在液氮中,进行流式细胞术分析时,把冻存的PBMC快速解冻复苏后用固定打孔试剂盒(Fixation/Permeabilization Solution Kit,购自美国BD公司)进行固定打孔。PBMC中S100A10应用小鼠抗人单克隆抗体(滴度1100,购自美国BD公司)进行染色,同型对照应用小鼠IgG单克隆抗体(滴度1100,购自美国Biolegend公司)进行染色;然后,用别藻蓝蛋白荧光标记的兔抗小鼠的二抗(美国Thermo Fisher Scientific公司)识别一抗。细胞充分洗涤后,用含体积分数1%小鼠血清和体积分数1%胎牛血清的封闭液封闭,然后用抗体CD4(滴度1200)、CD8(滴度1100)、CD14(滴度1200)和CD19(滴度1200)混合液染色30 min,充分洗涤后,用FACSCanto流式细胞仪(美国BD公司)检测,通过前向角散射(forward scatter,FSC)-A和侧向角散射(side scatter,SSC)-A排除细胞锁片,通过FSC-A和FSC-H排除粘连的细胞,接着分别圈出CD4+T淋巴细胞、CD8+T淋巴细胞、CD14+单核细胞和CD19+B淋巴细胞,再分析各亚群中的S100A10平均荧光强度,S100A10蛋白的相对表达量以各个亚群中S100A10平均荧光强度表示。

2 结果
2.1 2组受试者的体质量指数(body mass index,BMI)、吸烟指数及肺功能指标FEV1%pred、FEV1/FVC比较结果见表1。COPD组患者的BMI、FEV1%pred、FEV1/FVC显著低于健康对照组,吸烟指数显著高于健康对照组,差异有统计学意义(P<0.05)。
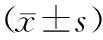
表1 2组受试者BMI、吸烟指数及肺功能指标FEV1%pred、FEV1/FVC比较
2.2 2组受试者PBMC中S100A10 mRNA和蛋白相对表达量比较结果见表2和图1。COPD组患者PBMC中S100A10 mRNA和蛋白相对表达量显著低于健康对照组,差异有统计学意义(P<0.05)。

表2 2组受试者的PBMC中S100A10 mRNA和蛋白相对表达量比较
2.3 2组受试者PBMC不同细胞亚群中S100A10蛋白相对表达量比较结果见表3。COPD组患者的CD4+T淋巴细胞、CD8+T淋巴细胞、CD19+B淋巴细胞中S100A10蛋白相对表达量与健康对照组比较差异无统计学意义(P>0.05);COPD组患者的CD14+单核细胞中S100A10蛋白相对表达量显著低于健康对照组,差异有统计学意义(P<0.05)。

表3 2组受试者的PBMC不同淋巴细胞亚群中S100A10蛋白相对表达量比较
2.4 COPD患者PBMC中S100A10 mRNA表达水平与FEV1%pred的相关性分析结果见图2。COPD患者PBMC中S100A10 mRNA表达水平与FEV1%pred呈负相关(r=-0.610,P<0.05)。
3 讨论
COPD是慢性气道炎症性疾病,气流受限呈现进行性发展,与肺部对香烟烟雾等有害气体或有害颗粒产生异常炎症反应密切相关。在COPD疾病早期即可见促炎症细胞如中性粒细胞和单核/巨噬细胞的浸润和多种促炎症介质的释放,随着疾病的进展可导致肺间质细胞不断增生,从而破坏局部肺组织的正常结构,出现肺功能受损和组织重构。本研究结果显示,COPD组患者的吸烟指数显著高于对照组,BMI、FEV1%pred、FEV1/FVC显著低于健康对照组,提示COPD与肺部对香烟烟雾等有害气体或有害颗粒产生异常炎症反应相关,COPD患者存在一定程度的肺组织重构和肺功能受损。因此,如何有效阻止或逆转肺组织重构和肺功能受损这一过程是预防和治疗COPD的关键[1,16-17]。
目前认为,S100A10是一种抗炎蛋白,一方面参与调节血纤维蛋白溶酶原依赖的单核/巨噬细胞和中性粒细胞向炎症部位的迁移及浸润,另一方面还直接控制这些免疫细胞的活化状态以避免过度活化造成免疫病理损伤。因此,S100A10可通过抑制固有免疫应答及随后的适应性免疫应答参与多种炎症性疾病的发病和进展。有研究报道,与健康对照者和无自杀倾向的精神疾病患者相比,有自杀倾向的精神疾病患者外周血PBMC中S100A10的表达水平显著下降,认为PBMC中S100A10的表达水平可作为评估自杀风险的潜在的生物标志物[18]。GREEN等[19]研究报道,帕金森病患者PBMC中S100A10的表达水平显著降低,单核细胞、自然杀伤细胞和CD8+毒性T淋巴细胞中S100A10的表达水平与帕金森病的严重程度呈正相关,自然杀伤细胞中S100A10的表达水平与抑郁评分亦呈正相关的关系。以上这些研究结果提示,循环外周血中免疫细胞上的S100A10表达水平与帕金森病的进程和抑郁的程度存在关联。但是S100A10在COPD患者中的表达变化及是否参与COPD疾病进程尚不明确。
本研究结果显示,COPD组患者的PBMC中S100A10 mRNA和蛋白相对表达量显著低于健康对照组,且COPD组患者的CD14+单核细胞中S100A10蛋白相对表达量显著低于健康对照组,而CD4+T淋巴细胞、CD8+T淋巴细胞、CD19+B淋巴细胞中S100A10蛋白相对表达量与健康对照组比较无显著差异,这一结果提示,S100A10可能是选择性地通过影响单核细胞的功能参与COPD进程。COPD发病过程中在多种刺激因素的作用下,如急性加重期常伴有流感嗜血杆菌和卡他莫拉菌等多种细菌感染,可使COPD患者的免疫系统被异常活化,从而诱导单核/巨噬细胞活化,释放大量TNF-α、IL-6和IL-1β等促炎介质,CD4+效应性T淋巴细胞活化分泌IL-17和IL-23等细胞因子,这些促炎介质和细胞因子作用于PBMC,进而抑制S100A10的表达。有研究报道,COPD患者中CD45+CD11b+F4/80+巨噬细胞和CD4+T淋巴细胞和Th17细胞数量和比例增加,而调节性T细胞的数量和比例减少[20-22]。S100A10作为一种重要的抗炎蛋白,其表达被抑制可能意味着其抑制炎症反应的能力被削弱。本研究通过分析S100A10 mRNA表达水平与肺功能指标FEV1%pred的相关性发现,COPD患者PBMC中S100A10 mRNA表达水平与肺功能指标FEV1%pred存在明显的负相关,证实S100A10 mRNA表达在COPD发病过程中具有重要作用。
综上所述,COPD患者PBMC中S100A10呈异常表达,可选择性地通过影响单核细胞的功能参与COPD进程,但其细胞和分子机制以及能否作为生物标志物用于临床诊断COPD和成为潜在治疗靶点有待于进一步深入的研究。

