富血小板血浆联合骨髓间充质干细胞促进兔前交叉韧带重建后腱骨愈合
张 豪,杨保刚,陈 宇
(1.浙江省台州医院 急诊科,浙江 台州 317300;2.浙江省人民医院 骨科,浙江 杭州 310014)
前交叉韧带(anterior cruciate ligament, ACL)重建术是最常见的腱骨愈合手术,腱骨愈合效果不佳的原因是腱骨中的肌腱移植、矿化和成熟并不总是令人满意。富血小板血浆(platelet-rich plasma, PRP)是各种生长因子的自体富集来源,已在创伤和骨科手术中广泛使用。骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)具有促进肌腱再生的巨大潜力,含有来自骨髓的BMSCs的宿主细胞有助于腱骨愈合。Wnt/β-catenin途径已被证明在骨骼发育中至关重要,并作为潜在靶点受到了广泛关注。近年来,大量研究报告了Wnt/β-catenin信号通路在成骨分化和骨形成中起着重要作用,但PRP联合BMSCs通过Wnt/β-catenin信号通路对兔ACL重建后腱骨愈合的研究甚少。因此,本实验采用自体PRP联合BMSCs顶端注射的方法将相应的凝胶注入骨道内,观察PRP联合BMSCs是否对腱骨愈合有促进作用。
1 材料与方法
1.1 实验动物 45只12 周龄新西兰白兔,体质量(2.5±0.2)kg,购自浙江省实验动物中心。
1.2 主要试剂 胎牛血清购自北京赛默飞世尔生物化学制品有限公司;DMEM/F12培养基购自美国Gibco公司;青霉素、链霉素、油红O和茜红素购自北京索莱宝科技有限公司;CD29、CD90、CD34、CD45、Wnt1、Wnt3a及β-catenin的抗体购自美国Abcam公司;兔VEGF ELISA试剂盒和兔TGF-β1 ELISA试剂盒购自南京森贝伽生物科技有限公司;β-actin抗体和IgG-HRP抗体购自美国Cell Signaling Technology公司。
1.3 BMSCs的提取、分离、培养及体外分化 取5只新西兰兔下肢,75%乙醇浸泡后超净工作台中剥离附着的肌肉,充分暴露出股骨和胫骨。去除股骨和胫骨两端的骨骺,用100 mL无菌注射器吸取DMEM/F12培养基反复冲洗髓腔至澄清。将冲洗出的骨髓吹打成悬液,1 000 ×g/min离心10 min,弃上清。加入DMEM/F12培养基,缓和吹洗;将上述重悬细胞液各取4 mL接种于细胞培养瓶中,加入含有15%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM /F12培养基,置于37 ℃、5% CO的培养箱中培养。48 h后弃去培养基,PBS溶液冲洗 2~3次去除未贴壁细胞,加入完全培养基继续培养。
1.4 PRP及实验凝胶制备 造模前30 min抽取兔耳缘静脉血5 mL,置于含有1 mL枸橼酸钠的无菌离心管中。3 000 ×g/min,离心15 min,全血分为3层,吸取上部血清及界面下少量红细胞转移至新的无菌离心管中;继续3 000 ×g/min,离心15 min,去掉上层含有极少量未沉降血小板的血浆层,剩余血浆及血细胞成份摇匀即为PRP。在1 mL EP管中分别加入凝血酶与纤维蛋白原按1∶4比例混合,再加入1×10个/mL BMSCs细胞悬液、PRP。
1.5 模型制作、分组及给药 40只新西兰白兔随机分为4组:control组、PRP组、BMSCs组和PRP+BMSCs组,每组10只。每只兔术前禁食12 h,耳缘静脉注射水合氯醛麻醉,取左侧下肢进行ACL重建术,其ACL重建术方法参照杨军军等报道。配制PRP和BMSCs凝胶,采用顶端注射的方法注入骨道内。control组仅注射生物蛋白凝胶1 mL;PRP组注射PRP凝胶1 mL;BMSCs组注射BMSCs凝胶1 mL;PRP+BMSCs组注射PRP及BMSCs凝胶1 mL。注射后用生物耳胶封闭骨道外口,最后逐层缝合伤口。术后前3天常规肌肉注射青霉素预防感染。术后28天各组新西兰白兔经耳缘注射水合氯醛麻醉,进行取材。
1.6 观察指标
1.6.1 细胞形态及分化鉴定 第3代BMSCs在含有脂向诱导剂的完全培养基中培养,进行2周的成脂分化,用0.5%油红O染色细胞内脂滴显示脂肪形成。第3代BMSCs在含有骨向诱导剂的完全培养基中培养4周,进行成骨分化,用2%茜素红S(pH 4.1~4.3)染色评估。
1.6.2 BMSCs表面标记物鉴定 待第3代BMSCs融合至80%~90%时,将细胞以6 000个/μL的密度重悬,并分别用CD29、CD90、CD34和CD45抗体标记。随后,在黑暗中孵育25 min, PBS洗涤2次后上机检测表面标记CD29、CD90、CD34和CD45的表达。
1.6.3 兔腱骨病理变化 取各组兔重建韧带后的膝关节,剔除关节周围的组织,置于4%多聚甲醛中固定72 h,之后在室温下用EDTA溶液脱钙4周。组织经乙醇脱水、石蜡包埋、切片、苏木素-伊红染色,封片后使用显微镜进行拍摄。
1.6.4 各组兔血清中VEGF、TGF-β1含量的变化 各组兔经静脉采血6~8 mL。静置30 min后,以3 000 ×g/min,离心15 min,分离血清,按照ELISA试剂盒说明书测定各组兔血清中VEGF、TGF-β1的含量。
1.6.5 各组兔腱骨结合处骨密度的变化 通过Micro-CT扫描仪在60 kV扫描电压下以36 μm各向同性体素分辨率扫描所有组织,使用CTAn分析并计算腱骨结合处骨组织的骨密度。
1.6.6 各组兔腱骨最大加载负荷的变化 除重建的ACL之外的所有肌肉、软组织、韧带和缝线均被剔除;之后在Instron 553A材料测试系统中已45°屈曲固定,通过20 mm/min的速度连续增加拉伸负荷来进行测试,通过负荷-变性曲线记录最大加载负荷。
1.6.7 各组兔腱骨界面组织中Wnt1、Wnt3a、β-catenin蛋白的表达 RIPA裂解液提取各组兔腱骨界面组织中的总蛋白。各组蛋白变性后经上样-电泳-转膜-封闭-一抗孵育[Wnt1抗体(1∶1 000)、Wnt3a抗体(1∶1 000)、β-catenin抗体(1∶1 000)和β-actin抗体(1∶2 000),4 ℃ 过夜]-二抗孵育[对应一抗种属来源的IgG-HRP标记的二抗(1∶5 000),室温1.5 h]-显影曝光,采用Image-Pro Plus 6.0图像分析系统对蛋白条带的灰度值进行分析。
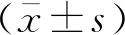
2 结果
2.1 BMSCs的形态及分化鉴定 从新西兰白兔股骨中提取的BMSCs具有梭形形状而且呈旋涡分布(图1A),体外分化可见细胞内存在大量的脂质滴(图1B)和许多钙化结节(图1C)。

A.BMSCs的形态(400×);B.BMSCs的成脂分化(油红O染色,400×);C.BMSCs的成骨分化(茜素红染色,200×)
2.2 BMSCs表面标记物鉴定 流式细胞术结果见图2,第3代BMSCs的表面标记为CD29阳性(95.5%)、CD90阳性(97.2%)、CD34阴性(4.3%)和CD45阴性(2.8%),与BMSCs的免疫表型特征一致。

图2 BMSCs表面标记物检测
2.3 各组兔腱骨病理变化 Control组中,肌腱和骨骼之间的界面主要由成纤维细胞组成,几乎没有发现胶原和软骨纤维;PRP组中,肌腱和骨连接处的纤维和软骨细胞增加;BMSCs组中,在肌腱和骨连接处的胶原纤维、软骨细胞和纤维软骨增加;PRP+BMSCs组中,肌腱和骨连接处的软骨纤维和软骨细胞较PRP和BMSCs组增加。见封三图1。
2.4 各组兔血清中VEGF、TGF-β1含量及骨密度和最大加载负荷的变化 与PRP组和BMSCs组比较,PRP+BMSCs组兔血清中VEGF、TGF-β1含量和兔腱骨结合处骨密度、最大加载负荷均增加,差异均有统计学意义(均<0.05)。见表1。

表1 各组兔血清中VEGF、TGF-β1含量及骨密度和最大加载负荷的变化
2.5 各组兔腱骨界面组织中Wnt1、Wnt3a和β-catenin蛋白表达的变化 Western blot结果表明:与control组比较,PRP组、BMSCs组和PRP+BMSCs组兔腱骨界面组织中Wnt1、Wnt3a和β-catenin蛋白表达水平上调,且PRP+BMSCs组最高,差异均有统计学意义(均<0.01)。见图3。

注:与control组比较,**P<0.01,***P<0.001;与PRP组比较,##P<0.01;与BMSCs组比较,&&P<0.01。
3 讨论
前交叉韧带(ACL)是膝盖中的重要组成部分,其损伤是体育活动中的一种严重而常见的损伤。最近,外科重建加上软组织自体移植或同种异体移植已成为ACL撕裂的标准治疗方法,但是约有四分之一的患者长期效果不理想,因此寻找更好的方法改善肌腱-骨界面的愈合至关重要。
研究发现,干细胞疗法在ACL重建后用于腱骨愈合具有生物学潜力。骨髓间充质干细胞(BMSCs)是多能干细胞,可以在体外分化为多种细胞。实验表明,骨髓间充质干细胞能够在体内形成骨骼,这突出了治疗应用的广阔前景。我们从新西兰白兔股骨中提取BMSCs,经过鉴定后,采用顶端注射的方法,将BMSCs凝胶1 mL注射到骨道内。经过28天后,我们发现,ACL兔肌腱和骨连接处的软骨纤维和软骨细胞增加、腱骨结合处骨密度和最大加载负荷也增加,提示BMSCs能促进前交叉韧带重建后腱骨愈合。
VEGF是特异性作用于血管内皮细胞的生长因子,能够促进损伤组织的血管新生。研究表明,VEGF在腱骨愈合过程中可促进愈合组织的再血管化,提高愈合韧带的强度。TGF-β1是参与细胞外基质重建的细胞因子,对骨基质内胶原的合成具有促进作用,同时也能在一定程度上诱导成骨细胞的分化。在本实验中,我们发现,PRP联合BMSCs可促进VEGF和TGF-β1的生成,从而促进腱骨愈合。Wnt/β-catenin信号通路是一个调控细胞生长、发育和分化的重要信号途径。研究表明,Wnt/β-catenin信号通路的激活可以诱导成骨细胞分化,抑制破骨细胞分化并抑制软骨形成。在本实验中,PRP联合BMSCs激活了Wnt/β-catenin信号途径,从而促进肌腱-骨界面的骨形成,从而促进了腱骨愈合,与上述文献报道一致。
综上所述,PRP联合BMSCs促进了VEGF和TGF-β1的生成、增加了肌腱和骨连接处的软骨纤维和软骨细胞、腱骨结合处骨密度和最大加载负荷,其有可能与Wnt/β-catenin信号途径有关,因此,PRP联合BMSCs具有临床应用潜力。
感谢杭州医学院基础医学与法医学院邓思思老师在实验研究中给予的帮助。

